… v kontextu s novými doporučenými postupy ESC (GL).
Regulace homeostázy glukózy
Homeostáza glukózy = rovnováha mezi příjmem glukózy z potravy, její endogenní produkcí a její utilizací periferními tkáněmi. Hlavním hormonem snižujícím glykémii je inzulín.
Biosyntéza inzulínu – inzulín je produkován beta buňkami pankreatu nejdříve jako jeden řetězec o 86 aminokyselinách (preproinzulín) s následným odštěpením N terminálního konce za vzniku proinzulínu. (aminokyselinový řetězec je složen a navázán navzájem pomocí disulfidových vazeb (-S-S-). Odštěpením 31 aminokyselinových zbytků z místa ohybu vznikne C peptid, řetězec A (21 aminokyselin) a řetězec B (30 aminokyselin). C peptid je proto dobrým markerem syntézy a sekrece inzulínu.
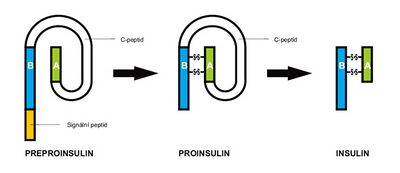
Sekreci inzulínu stimuluje glykémie > 3,9 mmol/l následujícím mechanismem. Glukóza je do buňky resorbována pomocí GLUT transportéru (celkem až 14 typů, nejvýznamnější jsou GLUT 1 – erytrocyty a mozek, GLUT 2 – beta buňky pankreatu a játra, GLUT 3 – neurony, placenta, GLUT 4 – svalstvo, tuk). Limitujícím krokem je následná fosforylace glukózy na glukóza-6-P glukokinázou a celý proces pokračuje glykolýzou. Vzniká ATP, které jednak pohání GLUT, jednak inhibuje ATP senzitivní K+ kanál s následnou depolarizací buňky, která umožňuje otevření voltážově dependentního Ca2+ kanálu. Influx Ca2+ stimuluje adenylylcyklázu a vznikající cAMP stimuluje uvolnění sekrečních granul s inzulínem. Jeho sekrece je stimulována glukózou, dále aminokyselinami, GLP-1 a snižována somatostatinem a katecholaminy.
… import glukózy GLUT – glykolýza – vznik ATP – inhibice ATP senzitivního K+ kanálu – depolarizace buňky – otevření voltážového Ca2+ – cAMP – uvolnění granul s inzulínem.
Účinek inzulínu – po svém uvolnění do portální krve je z 50 % odstraněn first pass efektem při průchodu játry. Plazmatický poločas je 3 – 5 minut. Inzulín inhibuje glykogenolýzu, glukoneogenezi a ketogenezi a stimuluje glykolýzu, tvorbu FFA a lipogenezi z glukózy. Dále má anabolický účinek.
Diabetes mellitus
Klasifikace – hlavními patofyziologickými mechanismy vzniku diabetes mellitus (DM) je absolutní nedostatek tvorby inzulínu (podstata DM I. typu), rezistence periferních tkání k inzulínu (podstata DM II. typu) nebo kombinace obojího. Mezi ostatní typy diabetu patří sekundární DM (hyperglykémie je vyvolána jinou chorobou, např. jiné onemocnění pankreatu), MODY (monogenně podmíněný DM) a gestační diabetes (vzniká po 20. týdnu gravidity). Někdy bývá jako samostatná jednotka uváděn LADA (latent autoimmune diabetes in adults), patogeneticky jde ale o DM I. typu. Jako prediabetes (předstupeň DM) se označuje zvýšená glykémie na lačno a porušená glukózová tolerance. Tedy etiologicky lze DM klasifikovat na:
- DM I. typu (5 %)
- DM II. typu (93 %)
- Specifické typy diabetu (2 %):
- MODY – monogenně způsobený DM vzniklý mutacemi nejméně 14 genů. Mezi jeho charakteristiky patří, že vzniká v mladém věku, není závislý na inzulínu a většinou bývá AD dědičný (přítomen v každé generaci a opět v mladém věku). Pravděpodobnost mody lze online spočítat na speciálním kalkulátoru: https://www.diabetesgenes.org/exeter-diabetes-app/ModyCalculator
- sekundární DM
- choroby exokrinního pankreatu (pankreatitidy, pankreatektomie, tumory, cystická fibróza, hemochromatóza apod.).
- endokrinopatie (akromegalie, Cushingův syndrom, glukagonom, feochromocytom, hyperyteoidismus apod.).
- polékové (glukokortikoidy, beta-sympatomimetika apod.).
- infekce (vrozená rubeola, coxsackieviry, cytomegalovirus).
- Gestační DM
Patogeneze – příčinou vzniku
- DM I. typu – autoimunitní destrukce beta buněk pankreatu se vznikem absolutního nedostatku inzulínu.
- DM II. typu – dva mechanismy:
- porucha funkce beta buněk – úvodní kompenzační hyperinzulinémie vede k jejich vyčerpání se vznikem absolutního nedostatku inzulínu.
- inzulinová rezistence – periferní tkáně mají sníženou citlivost k inzulínu.
Epidemiologie – DM má v ČR 9 % populace, u dalších cca 5 % ještě nedošlo ke stanovení diagnózy a dalších 8 % trpí prediabetem (tedy 22 % jedinců v ČR má poruchu metabolismu glukózy!!!). 93 % představuje DM II. typu, 5 % DM I. typu a 2 % ostatní typy.
Klinický obraz – všechny příznaky jsou důsledkem hyperglykémie:
- mezi klasické trias patří žízeň, polydypsie, polyurie. Ke glykosurii dochází při překročení renálního absorpčního prahu pro glukózu (při glykémii cca 11 mmol/l) – SGLT2 transportéry v proximálním tubulu již nejsou schopny navýšit svoji kapacitu a dochází ke glykosurii s následnou osmotickou diurézou a dehydratací se vznikem pocitu žízně a zvýšeného příjmu tekutin.
- dále hubnutí, únava a kolísání zrakové ostrosti (změna koncentrace glukózy a osmotických poměru v čočce spolu se změnou její lomivosti).
- při dlouhodobé hyperglykémii je predispozice k urogenitálním a kožním infekcím a důsledkem dlouhotrvajícího DM je pak vznik mikro- a makrovaskulárních komplikací.
U DM II. typu je poměrně typický oligosymptomatický nebo asymptomatický průběh. Zcela zásadní je dobrá kompenzace DM.
Diagnostika – ke stanovení diagnózy diabetu je možné použít tři způsoby:
- glykémie na lačno – nejméně 8 hodin po předchozím jídle. 3,9 – 5,5 mmol/l je norma, 5,6 – 6,9 mmol/l je zvýšená glykémie na lačno, > 7,0 mmol/l a více (při dvou různých měřeních) splňuje kritéria DM. Náhodný nález glykémie > 11,1 mmol/l je potřeba ověřit glykémií na lačno s nálezem > 7,0 mmol/l.
- orální glukózový toleranční test (oGTT) spočívá ve vypití 75 g glukózy ve 200 ml tekutiny, následně se stanoví glykémie po 2 hodinách. Norma je glykémie do 7,7 mmol/l, při glykémii 7,8 – 11,1 mmol/l jde o porušenou glukózovou toleranci, při glykémii > 11.1 mmol/l jde o diabetes mellitus (stačí jediný výsledek).
- glykovaný hemoglobin (HbA1c, produkt neenzymové glykace hemoglobinu), diagnostická pro DM je hodnota ≥ 48 mmol/mol.
Z dalších testů se provádí:
- stanovení C peptidu k odhadu vlastní sekrece inzulínu B-buňkami
- protilátek proti antigenům B-buněk při diagnostice DM I. typu:
- anti-GAD (dekarboxyláza kyseliny glutamové)
- anti-IA2 (tyrozinfosfatáza IA-2)
- IAA (proti inzulínu), pouze, pokud pacient nebyl dosud léčen exogenním inzulínem
- genetické vyšetření (MODY)
Posouzení kompenzace DM – zásadním parametrem je HbA1c, který odráží kompenzaci za poslední 2 – 3 měsíce. Vyšetření ketonémie i ketonurie je zásadní u pacientů s DM I. typu při podezření na rozvoj ketoacidózy. Poslední dobou se užívá kontinuální monitorace glykémií pomocí podkožních senzorů. Z toho lze odvodit i tzv. glykemickou variabilitu dle kolísání glykémie v čase (časté střídání hypo- a hyperglykémie mohou zvýšit riziko komplikací nezávisle na HbA1c).
Sledování komplikací DM – vždy je potřeba provést oční vyšetření, posouzení renálních funkcí (urea, kreatinin, eGFR, albuminurie), vyšetření DKK ke screeningu diabetické neuropatie. Z preventivních důvodů dále TK, lipidogram a EKG. CAVE K přechodným vzestupům glykémie může docházet při stresových stavech, kdy je hyperglykémie „normální“.
Screening diabetu – glykémie na lačno by měla být stanovena u nerizikových jedinců jednou za dva roky, u rizikových jedinců každoročně.
Stratifikace kardiovaskulárního rizika (KVR)
- velmi vysoké riziko – pacienti s kardiovaskulárním onemocněním, diabetes mellitus II. typu + prokázané mikrovaskulární onemocnění nejméně ve 3 různých lokacích (např. retinopatie, neuropatie, nefropatie) nebo DM +CKD IIIb nebo IIIaA2 nebo jakékoliv A3.
- vysoké riziko – diabetici nesplňující kritéria velmi vysokého ani středního rizika.
- střední riziko – pacienti s dobře kontrolovaným diabetem < 10 let trvání, bez ostatních KV rizikových faktorů a bez mikrovaskulárních manifestací diabetu.
- při posouzení KVR může být použito kalciové skóre, CT koronarografie, SPECT myokardu nebo ABI, naopak stanovení tloušťky karotické intimy medie nebo stanovení cirkulujících biomarkerů není doporučeno. Podobně nelze použít i SCORE tabulky pro běžnou populaci, protože KVR u diabetiků zásadním způsobem podhodnocují.
Terapie – základním cílem léčby DM je dosažení normoglykémie a snížení rizika akutních i chronických komplikací. Cesty k jeho dosažení jsou odlišné u DM I. i II. typu.
- Dieta a životní styl
- cílem diety u DM I. typu je pravidelný a rovnovážný příjem cukrů během dne a jeho sladění s aplikací inzulínu (toho je absolutní nedostatek).
- u diabetu II. typu jde spíše o snížení celkového počtu kalorií (podíl živin by měl být následující – sacharidy 50 %, tuky 35 %, bílkoviny 15 %).
- doporučeno je okamžitě přerušení kouření za každou cenu
- vhodná je středomořská dieta, která je bohatá na poly- a mononenasycené mastné kyseliny. Naopak suplementace vitamínu nebo minerálů není nutná.
- Fyzická aktivita – obecně platí, že čím více, tím lépe (v kardiologických GL je uvedeno nejméně 150 minut středně intenzivní aktivity týdně).
- Farmakoterapie – u DM I. typu spočívá léčba téměř výhradně v aplikaci inzulínu, u DM II. typu se používají i perorální přípravky:
Perorální antidiabetika
Metformin – snižuje glukoneogenezi v játrech a zlepšují inzulinovou rezistenci. Dle studie UKPDS snižuje terapie metforminem riziko IM o 39 %, úmrtí z koronárních příčin o 50 % a CMP o 47 % při follow-up cca 10 let u pacientů s DM II. typu, nadváhou a bez předchozího KVO. Úvodní dávka metforminu je 500 mg večer, poté lze navyšovat dle tolerance na 2,5 – 3 g denně rozdělené do třech denních dávek. Mezi hlavní nežádoucí účinky (NÚ) patří nevolnost, meteorismus a průjem. Při intoleranci lze zkusit retardovaný XR metformin, který se podává v jedné dávce večer (CAVE dávky XR a prostého metforminu nejsou identické, maximální denní dávka metforminu XR je 2 g). Nepůsobí hypoglykémii.
Mezi hlavní kontraindikace metforminu patří:
- renální insuficience – při eGFR < 0,5 ml/s je metformin kontraindikován (KI), při 0,5 – 1 ml/s by léčba již nově zahájena být neměla, u pacientů již léčených metforminem by měla být dávka snížena na polovinu.
- srdeční selhání NYHA III. – IV. nebo jiné onemocnění s rizikem tkáňové hypoxie.
- metformin by měl být vysazen 1 – 2 dny před chirurgickým výkonem nebo podáním jodové kontrastní látky a zpět nasazen až po ověření, že nedošlo ke zhoršení renálních funkcí.
Deriváty sulfonylurey – mechanismem funkce je inhibice ATP senzitivního K+ kanálu s následnou stimulací sekrece inzulínu. Snižují zejména postprandiální glykémii, ale neovlivňují inzulinovou rezistenci. Vhodné jsou nyní zejména gliklazid (DIAPREL MR) nebo glimepirid (AMARYL). Nejčastějším nežádoucím účinkem je hypoglykémie a mírný vzestup hmotnosti. Kontraindikací podání je závažná renální insuficience, výjimku tvoří gliquidon (GLURENORM), který je možné podat ve všech stádiích renální insuficience, nicméně i zde je vhodnější použít např. linagliptin a/nebo inzulín. Mají menší vliv na KVR než metformin (studie CAROLINA, vliv linagliptinu a derivátů sulfonylurey na KVR je podobný).
Glinidy – stimulátory sekrece inzulínu s kratším poločasem, musí se proto podávat 3x denně, sekrece inzulínu je tak fyziologičtější a jsou méně časté hypoglykémie než u derivátů sulfonylurey. V ČR je k dispozici repaglinid. Nemá vliv na KV riziko (studie NAVIGATOR I).
Inhibitory alfa-glukosidázy – okrajová záležitost v léčbě DM, působí snížení vstřebávání cukrů díky inhibice štěpení cukrů ve střevě a tak i snížení postprandiální glykémie. Hlavním NÚ je GIT intolerance. Nesnižuje KVR (studie ACE). V ČR je dostupná akarbóza.
Glitazony – snižují inzulínovou rezistenci díky aktivaci nukleárních receptorů PPAR-γ. Na plný efekt léčby je třeba počkat 3 – 6 měsíců. Nežádoucím účinkem je retence tekutin a s tím související srdeční selhání a zvýšený počet fraktur u postmenopauzálních žen. KI je proto srdeční selhání. Dle studie PROactive bylo zlepšení kardiovaskulární prognózy nesignifikantní, naopak byl vyšší výskyt srdečního selhání.
Inkretiny – glukagon-like-peptide-1 (GLP-1) je syntetizován v enteroendokrinních L-buňkách, které jsou roztroušeny po celé délce tenkého i tlustého střeva (nejvíce v ileu a ve tlustém střevě). Jeho prekurzorem je biologicky neaktivní peptid proglukagon, který je štěpen konvertázami, na kratší úseky, které mohou působit jako aktivní hormony. Důležitá je prohormonkonvertáza PC1/3, která štěpí proglukagon na oxyntomodulin, intervening peptide-1, GLP-2 a právě GLP-1 (aby mohla buňka produkovat hormon GLP-1, musí tedy exprimovat zároveň gen pro proglukagon a PC1/3). Vazba GLP-1 na receptor stimuluje adenylylcyklázu. V pankreatu stimuluje GLP-1 uvolnění inzulínu, zvyšuje masu beta buněk a brání jejich apoptóze, stimuluje sekreci somatostatinu a inhibuje sekreci glukagonu. V játrech inhibuje glukoneogenezi a brání vzniku steatózy. V tuku inhibuje lipogenezi a stimuluje naopak lipolýzu. GLP-1 je inaktivován dipeptidyl-peptidázou (DPP4). Aktivní poločas GLP-1 je 1 – 2 minuty.
Používají se v kombinaci s metforminem a deriváty sulfonylurey/glitazony/glifloziny, pokud není dosaženo uspokojivé kompenzace, v monoterapii při nesnášenlivosti metforminu a dále v kombinaci s dlouhodobě působícím inzulínem. Není riziko hypoglykémie.
CAVE Podmínkou jejich účinku je zachovalá sekrece inzulínu (nesmí být nízký C peptid).
- gliptiny – perorální antidiabetika, které inhibují DPP4 a zvyšují tak koncentraci endogenního GLP-1. Žádný z gliptinů nebyl spojen se snížením KV rizika. Látky:
- sitagliptin (JANUVIA, + metformin JANUMET)
- linagliptin (TRAJENTA, + metformin JENTADUETO), dle studie CAROLINA je stejná bezpečnost ve srovnání s glimepiridem
- alogliptin (VIPIDIA, + metformin VIPDOMET)
- vildagliptin (GALVUS, + metfortmin EUCREAS)
- saxagliptin (ONGLYZA, + metformin KOMBOGLYZA) – CAVE tento je kontraindikován při srdečním selhání (studie SAVOR-TIMI 53)
- agonisté receptoru GLP-1 – podávány s.c., vedou k výraznějšímu úbytku hmotnosti, jsou proto vhodné pro pacienty s obezitou. Jednotlivé léky lze rozdělit na:
- prandiální – zlepšují postprandiální glykémii:
- exenatid (BYETTA)
- lixisenatid (LYXUMIA, + inzulín glargin SULIQUA)
- non-prandiální – zlepšují glykémii na lačno:
- exenatid LAR (BYDUREON)
- liraglutid (VICTOSA, + inzulin degludec XULTOPHY). Snížení KV rizika o 13 % (studie LEADER).
- dulaglutid (TRULICITY, 1x týdně). Snížení KV rizika o 1,4 % (studie REWIND).
- semaglutid (OZEMPIC, 1x týdně). Snížení KV rizika o 26 % (studie SUSTAIN-6, zejména o 39 % snížení rizika CMP).
- prandiální – zlepšují postprandiální glykémii:
Glifloziny – inhibují reabsorpci glukózy SGLT-2 transportérem v proximálním tubulu ledvin. Vzácnou komplikací je euglykemická ketoacidóza. Vzniká při interkurentním onemocněním se zvýšením potřeby inzulínu, kdy gliflozin zamezí rozvoji hyperglykémie, ale již ne ketogeneze, která může být déle nediagnostikována (euglykémie může zmást). Logickým důsledkem léčby je glykosurie, která vede ke zvýšení rizika urogenitálních infekcí (nutné pít dostatek vody). Látky:
- empagliflozin (JARDIANCE, + metformin SYNJARDY. Snížení celkového KV rizika o 14 % a dokonce snížení KV (celkové) mortality o 38 % (32 %) a u pacientů se srdečním selháním snížení rizika hospitalizace o 35 % (studie EMPA-REG OUTCOME).
- canagliflozin (INVOKANA, + metformin VOKANAMET). Při follow-up 3,1 roku došlo k významnému snížení tříbodové MACE o 14 %, ale nezměnil KV ani celkovou mortalitu (studie CANVAS a CANVAS-R). Dále studie CREDENCE prokázala nefroprotektivní účinek a opět zlepšení KV rizika.
- dapagliflozin (FORXIGA, + metformin XIGDUO). Nedošlo k výraznému snížení KV rizika, ale došlo k nižšímu kombinovanému endpointu (úmrtí z KV příčin/hospitalizace pro srdeční selhání) o 0,9 %.
Glifloziny i GLP-1 agonisté jsou v současnosti preskripčně omezeny. Přípravky jsou pojišťovnou hrazeny v případě, že po 3 měsících léčby metforminem v maximální tolerované dávce je HbA1c > 60 mmol/l. Pokud po 6 měsících léčby nedojde ke zlepšení kompenzace vyjádřené poklesem HbA1c > 7 % (u gliflozinů + poklesu tělesné hmotnosti o nejméně 2 %), není přípravek dále hrazen.
Inzulín
Inzulín je jediný způsob léčby u DM I. typu a obvyklý způsob léčby u DM II. typu při selhání perorálních preparátů. Při stanovení potřeby inzulínu je třeba vycházet z faktu, že endogenní sekrece inzulínu u 70 kg člověka je 40 IU/den (20 IU bazální sekrece + 20 IU sekrece vyvolaná příjmem potravy). CAVE U DM I. typu lze potřebnou dávku inzulínu vypočítat z předchozího, u DM II. typu je potřeba vzít v potaz obtížně predikovatelnou hodnotu inzulínové rezistence (dávka bývá většinou určena empiricky). Léčba inzulínem neovlivňuje KV riziko. Typy inzulínů (nástup účinku / maximum účinku / trvání účinku):
- krátkodobý humánní inzulín (HUMULIN R, ACTRAPID) – 30 min / 1,5 hodiny / 8 hodin. Užíván k hrazení postprandiální sekrece inzulínu. Účinek je delší než u analog, k prevenci hypoglykémie je proto často nutná i svačinka a před spaním druhá večeře. Podávají se 30 minut před jídlem.
- krátkodobý analog (NOVORAPID, HUMALOG, APIDRA, FIASP) – 10 min / 1 hodina / 4 hodiny, tedy rychlejší nástup a kratší trvání než u humánních inzulínů. Podávají se 10 minut před jídlem a nebývají potřeba svačiny ani druhé večeře.
- dlouhodobý humánní inzulín (HUMULIN N, INSULATARD) – 1,5 hodiny / 8 hodin / 14 hodin. NPH je zkratka Neutral Protamine Hagedorn, což je modifikace, která zpomaluje uvolňování z podkožní tkáně. CAVE Nelze je podávat intravenózně! Jedna denní dávka nepokryje bazální potřebu po celý den, velká část pacientů je přesto dobře kompenzovaná na 3 x denně krátkodobém inzulínu a NPH na noc.
- dlouhodobý analog (LEVEMIR, LANTUS, ABASAGLAR, TOUJEOU, TRESIBA). Většinou stačí jedna dávka denně. Látky:
- inzulin glargin – 1,5 hodiny / 14 hodin / 24 hodin
- inzulín determir – 1,5 hodiny / 6 hodin / 24 hodin
- inzulín degludec – 1,5 hodiny / pro pomalé uvolňování není peak / 42 hodin
- premixované inzulíny (HUMULIN M3 – 30 % krátkodobý inzulín + 70 % dlouhodobý inzulín, NOVOMIX 30 – 30 % krátkodobý analog + 70 % dlouhodobý analog)
- premixovaná kombinace bazálního inzulínu a GLP-1 analoga – liragludit + inzulín degludec = XULTOPHY, lixisenatid + inzulín glargin = SULIQUA)
Analoga jsou nyní hrazena z veřejného pojištění až jako léky druhé volby, kdy léčba humánními inzulíny nevedla k uspokojivé kompenzaci vyjádřené hladinou HbA1c > 60 mmol/mol.
Režimy aplikace inzulínu – inzulín je aplikován pomocí stříkaček nebo inzulínových per. Režimy lze dělit na:
- konvenční režimy (inzulín podáván maximálně 2x denně). Vhodný pouze k terapii DM II. typu. Formy:
- dlouhodobý inzulín 1x denně – ke snížení hyperglykémie na lačno. Možné použití humánního inzulínu nebo lépe analoga. Obvykle začínáme nízkou dávkou (cca 10 IU denně), kterou postupně po 3 dnech o 2 – 4 IU zvyšujeme s cílem dosažení ranní glykémie 4 – 7 mmol/l (u starších lze tolerovat vyšší hodnoty). Při neúspěchu je vhodné použití premixovaných inzulinů nebo intenzifikovaného režimu.
- premixovaný inzulín 2x denně (před snídaní a večeří) – ovlivňuje hyperglykémii na lačno i postprandiální, naopak dochází k vyššímu vzestupu hmotnosti s častějšími hypoglykémiemi. Celkově se obvykle nepřekračuje dávka 40 IU denně, pokud nepostačuje, je lépe pacienta převést na intenzifikovaný režim.
- intenzifikované režimy (inzulín podáván nejméně 3x denně nebo kontinuálně). Vhodný k léčbě DM II. typu a je jedinou možností léčby DM I. typu. Zcela zásadní je edukace pacienta.
- systém bazál-bolus – 1 – 2x denně dlouhodobý inzulín a krátkodobý inzulín 3x denně v bolusu před jídlem. Ranní dávka dlouhodobého inzulínu se podává spolu s krátkodobým před jídlem, večerní analog se podává s večerním krátkodobý inzulínem (může být podán ale i ráno), v případě NPH formy humánního inzulínu je aplikace těsně před spaním.
- Krátkodobé humánní inzulíny mají delší účinek a částečně tak nahrazují i bazální sekreci, proto by ho mělo být v intenzifikovaném režimu 50 – 65 % a dlouhodobého 35 – 50 %.
- Krátkodobá analoga jsou opravdu krátkodobá, proto pokrývají výlučně postprandiální potřebu inzulínu a jejich podíl by proto měl být 30 – 50 %, u dlouhodobé ho pak 50 – 70 %.
- inzulínové pumpy – nejvyspělejší forma aplikace, kdy je inzulín podáván kontinuálně do podkoží v kombinaci s bolusy před hlavními jídly.
- systém bazál-bolus – 1 – 2x denně dlouhodobý inzulín a krátkodobý inzulín 3x denně v bolusu před jídlem. Ranní dávka dlouhodobého inzulínu se podává spolu s krátkodobým před jídlem, večerní analog se podává s večerním krátkodobý inzulínem (může být podán ale i ráno), v případě NPH formy humánního inzulínu je aplikace těsně před spaním.
- intravenózní aplikace inzulínu – pouze za hospitalizace při urgentních situacích. Výjimečně jako malý bolus a většinou naředěn v dávkovači na koncentraci 1 IU/1 ml FR.
Diabetes mellitus I. typu
Definice – autoimunitní onemocnění, při kterém dochází k postupné destrukci beta buněk pankreatu. Postihuje 5 % všech diabetiků.
Etiologie a patogeneze – lymfocytární infiltrace Langerhansových ostrůvků autoimunitním zánětem má za následek postupný pokles beta buněk se vznikem absolutního nedostatku inzulínu až vymizení jeho sekrece. Hlavním genetickým předpokladem vzniku DM I. typu je přítomnost HLA-DRB1*03 (DR3), HLA-DRB1*04 (DR4) a DQB1*03:02 (DQ8), spouštěcí mechanismus není znám, předpokládá se, že jím může být virová infekce, bílkovina kravského mléka, toxické látky nebo psychický stres. Pacienti s DM I. typu jsou ohrožení i vznikem dalších autoimunit, např. Hashimotovou thyreoiditidou, Graves-Basedowovou nemocí, celikakií, perniciózní anémií nebo juvenilní revmatoidní artritidou apod. K manifestaci diabetu dochází až při ztrátě 80 – 90 % všech beta buněk, protože zde existuje poměrně výrazná funkční rezerva.
Klinický obraz – choroba většinou vzniká u mladých, dosud zdravých jedinců s krátkou anamnézou (řádově týdny). Mezi typické příznaky patří žízeň, polydipsie a polyurie (díky glykosurii s osmotickou diurézou). V této chvíli je již ztracena většina beta buněk a je nutné pacienta začít léčit inzulínem. Po zahájení terapie se přechodně zlepšuje funkce zbývajících beta buněk, protože klesá jejich zatížení (období remise), nicméně jejich autoimunitní destrukce pokračuje a toto období trvající maximálně jeden rok je vystřídáno úplným vymizením endogenní sekrece inzulínu. Typy DM I. typu:
- typický typ – častější, začíná v dětství nebo adolescenci a rychle progreduje do terminální destrukce všech beta buněk s rizikem vzniku ketoacidózy.
- LADA (latent autoimmune diabetes in adults) – má pomalejší průběh i progresi a vyskytuje se až v dospělosti. Tímto se může podobat DM II. typu, za který je často zaměňován a mylně takto léčen. V rozlišení může napomoci pozitivita autoprotilátek a nízká hladina C-peptidu, ale ani toto není 100 %.
Diagnostika – průkaz hyperglykémie (viz výše) (v typickém případě u mladého štíhlého diabetika). Dále laboratorní i klinické známky dehydratace, hyperlipidémie (změnou metabolismu, po kompenzaci mizí). V moči je výrazná glykosurie a často i ketonurie. Při podezření na DM II. typu (CAVE nelze uvažovat pouze věk, protože i u mladých je běžná již tak významná obezita, že vede k periferní inzulínové resistenci) je třeba zhodnotit habitus, rodinnou anamnézu, hladinu C-peptidu a přítomnost autoprotilátek. Při jasné pozitivní rodinné anamnéze a vzniku DM do 30 let věku je třeba myslet i na MODY s jeho definitivním potvrzením genetickým vyšetřením.
Farmakoterapie – základem je substituce inzulínu (vždy intenzifikovaným režimem) a dodržování příjmu glukózy tak, aby co nejvíce odpovídala substituci inzulínem. Pacient by měl vždy být edukován ohledně režimu, diety apod. a zvládat techniku selfmonitoringu.
Pokud není pacient v závažném stavu, je léčbu vždy nutné zahájit nižšími dávkami, vzhledem k předpokladu nastolení období remise (viz výše) s rizikem vzniku hypoglykémie a další korekce je nutná dle glykemických profilů (při vyšší lačné glykémii je vhodné upravit bazální inzulín, při vyšší postprandiální glykémii pak krátkodobý inzulín), které by měly být optimálně rozšířené (před jídlem, 2 hodiny po jídle, ve 22 hodin a ve 3 hodiny v noci). Počáteční cílové hodnoty nemusí být striktní, ale stačí 6 – 10 mmol/l s následující postupnou titrací (zejména v ambulantním režimu, kdy jsou rizika vyplývající z hypoglykémie vyšší). Korekce dávky by měla být postupná, většinou ne více než o 1 – 2 IU krátkodobého inzulínu a 2 – 4 IU dlouhodobého inzulínu. Pokud dojde ke zvýšení glykémií odpoledne a pacient aplikuje NPH ve 22:00, je vhodná aplikace NPH i ráno. Zvláštní situace:
- při infekčním onemocnění by se měla zvýšit dávka inzulínu o 10 – 30 % (bazálního i krátkodobého). Při infekci spojené s průjmem a zvracením je nutné popíjení sladkých tekutin a intenzivní měření spojené s častější aplikací krátkodobého inzulínu (á 3 – 6 hodin) se snížením popř. úplným vysazením krátkodobého inzulínu. CAVE Nikdy nelze inzulín úplně vynechat pro riziko vzniku ketoacidózy. Pacient by si měl monitorovat i ketony (v moči pomocí vizuálních proužků, např. Diaphan, Ketophan, v krvi pomoci některých glukometrů např. Freestyle Optium nebo Optium Xceed se speciálními proužky, např. βKetone). Při opakované pozitivitě je nutná hospitalizace s infúzní léčbou a i.v. podáváním inzulínu).
- jednorázový vzestup glykémie při stresu lze vyřešit podáním 1 – 4 IU inzulínu i.v.
- před otěhotněním je vhodná těsnější kontrola diabetu s cílovým HbA1c < 40 mmol/mol a častější kontroly s přísnějším dodržením diety. Dávky inzulínu většinou není potřeba výrazněji měnit.
Poslední dobou se upřednostňuje i FDI (flexibilní dávkování inzulínu), kdy před každým jídlem známe glykémii, množství sacharidů v následujícím jídle a plánovanou pohybovou aktivitu a na základě těchto znalostí si edukovaný pacient sám určí a aplikuje potřebou dávku inzulínu (pomoci mohou i různé bolusové kalkulátory (např. zde:https://www.mdapp.co/insulin-dosage-calculator-473/).
Edukace – pacientovi je nutné vysvětlit zásady aplikace inzulínu a a naučit jej samostatně upravovat dávkování inzulínu s ohledem na aktuální glykémii. Hezky shrnuto zde: https://www.medicinapropraxi.cz/pdfs/med/2017/02/09.pdf
Dietní opatření – u DM I. typu jde o regulaci příjmu sacharidů tak, aby substituce inzulínu co nejpřesněji pokryla jejich příjem (pacienti tedy mohou jíst běžnou stravu, ale musí si hlídat její množství). Je nutné regulovat příjem volných sacharidů (čokoláda, cukr, zákusky, med apod.) a hlídat příjem komplexních sacharidů (moučné výrobky, brambory, rýže). Ke zjednodušení se množství cukru v jídle vyjadřuje pomocí výměnných jednotek (1 výměnná jednotka = 10 g sacharidů). Sacharidy musí pokrýt množství energie, pro ženy je obvykle dostačující 225 g, pro muže 275 – 325 g sacharidů denně.
Fyzická aktivita – nutná součást terapie, ale zároveň přináší nutnost upravit dávku inzulínu. Intenzivní cvičení je kontraindikováno při proliferativní diabetické retinopatii, nefropatii nebo neuropatii. Také je nutné zvážit vhodnost rizikových sportů (potápění, seskoky s padákem), zejména u jedinců s tendencí k hypoglykémiím. Výhodnější je dynamická zátěž než izometrické cvičení a spíše dlouhodobější méně intenzivní než krátkodobá s maximálním úsilím. Vždy je nutné upravit inzulínový režim:
- před plánovaným cvičením je nutné snížit dávku krátkodobého inzulínu o 30 – 50 %, někdy i více a cvičení je optimální zahájit 1 – 2 hodiny po jídle.
- glykémii je nutné zkontrolovat před cvičení, v jeho průběhu i jednu hodinu po jeho ukončení (hypoglykémie se může dostavit až dlouho po ukončení cvičení, toto platí zejména u trénovaných jedinců). Pokud se glykémie blíží 4 mmol/l nebo je nižší, je nutné cvičení přerušit a postupovat jako při léčbě hypoglykémie.
- při glykémii > 16 mmol/l je vhodné zkorigovat hyperglykémii malou dávkou krátkodobého inzulínu, event. zkontrolovat ketolátky a začít cvičit až později.
Transplantace pankreatu – izolovaná transplantace pankreatu je spíše raritní, obvykle v kombinaci s transplantací ledvin. Lze transplantovat pouze Langerhansovy ostrůvky i celý pankreas. Následovat musí celoživotní imunosuprese.
Sledování pacienta – kontrola je vhodná obvykle jednou za 3 měsíce, pacient by měl být vždy zvážen, změřen mu TK a zkontrolována selfmonitorace glykémií (z moderních přístrojů lze stáhnout do počítače). Vždy bychom se pacienta měli zeptat na hypoglykémie a zvážit vybavení pacienta Glukagon kitem. U dlouhodobých diabetiku by měl následovat screening komplikací (vyšetření DKK, zvážit vyšetření očního pozadí a hladinu renálních funkcí a přítomnost mikroalbuminurie/proteinurie). Dále diabetici I. typu jsou náchylní k ostatním autoimunitním onemocněním, zejména štítné žlázy (TSH by mělo být stanoveno 1x ročně, při dyspeptických obtížích a hubnutí je vhodné vyloučení celiakie).
Diabetes mellitus II. typu
Definice a etiopatogeneze – hyperglykémie vznikající na základě relativního a následně i absolutního nedostatku inzulínu. Postihuje 5 % všech diabetiků. Hlavní příčinou je snížení citlivosti jater, svaloviny a tuku na inzulín, což zpočátku vede ke kompenzatorní hyperinzulinémii s následným vyčerpáním beta buněk a vznikem absolutního nedostatku inzulínu. DM II. typu je běžnou složkou metabolického syndromu, jehož součástí je navíc obezita, dyslipidémie, hypertenze, obezita, hyperurikémie a často i mírná elevace aminotransferáz při NAFLD. Určitě se spolupodílí i genetická složka, protože přítomnost DM II. typu u rodičů zvyšuje pravděpodobnost vzniku choroby i u dítěte.
Klinický obraz – na rozdíl od DM I. typu je průběh často oligosymptomatický (neurčitá únava, mírná žízeň a častější močení) nebo asymptomatický a choroba se běžně projeví až vznikem diabetických komplikací. DM II. typu je progredující onemocnění (funkce beta buněk i pankreatu se s časem zhoršuje) postupně s nutností medikace několika perorálními diabetiky a následným převodem na léčbu inzulínem. I přes snahu o maximální léčbu je běžná progrese mikro- i makrovaskulárních komplikací. Zásadní je ovšem 2 – 3 násobné zvýšení KV rizika.

Diagnostika – kritéria se neliší od DM jiné etiologie. Z diferenciálně diagnostického hlediska je nutné odlišit:
- LADA – převážně štíhlí pacienti, bez výraznější inzulínové rezistence s nízkou hladinou C peptidu a častou pozitivitou autoprotilátek.
- MODY – viz níže
- sekundární DM – zejména při chronické pankreatitidě nebo opakovaných akutních pankreatitidách. Obvykle štíhlí jedinci s anamnézou pankreatopatie.
Terapie – u každého pacienta by měl být stanoven individuální léčebný plán. Složky:
Dieta – cílem diety není pouze omezit sacharidy, ale zejména redukovat hmotnost. je nutné omezit tuky a jednoduché cukry. Podobně nevhodné jsou DIA potraviny (sice místo jednoduchých cukrů obsahují sladidla, ale energetickou hodnotu mají stejnou nebo vyšší) nebo 100 % džusy. Naopak vhodné je bílé maso (drůbež, ryby) s redukcí příloh, uzeniny jsou nevhodné s výjimkou bílé šunky. Zároveň je prospěšné omezení soli. Pacient by měl konzumovat cca 5 menších jídel denně. Ve zkratce je vhodná tzv. středomořská dieta: https://www.bezhladoveni.cz/stredomorska-dieta/
Další opatření – fyzická aktivita byla popsána výše, zcela zásadní je zanechání kouření. Pomoci může i psychosociální a behaviorální terapie (zejména s ohledem na compliance a dodržování režimu), zcela zásadní je dobrá edukace.
Farmakoterapie – měla by být zahájena ihned stanovení diagnózy diabetu:
- monoterapie perorálními antidiabetiky – při středním KV riziku je léčbou volby metformin, při vysokém/velmi vysokém KV riziku jsou indikovány GLP-1 agonisté nebo glifloziny (dle GL, problémem je jejich preskripční omezení). Ostatní léky jsou indikovány až při intoleranci nebo nedostatečnosti metforminu. Při převaze inzulinorezistence (zejména vysoká glykémie na lačno lze použít pioglitazon), při nízké sekreci inzulínu (vysoká postprandiální glykémie lze použít derivát sulfonylurey, popř. gliptin).
- monoterapie inzulínem – měla by být zahájena u zjevně inzulín-deficitního pacienta (bez významné nadváhy, hyperglykémie > 15 mmol/l, kdy jsou již deriváty sulfonylurey/gliptiny neúčinné…není již co stimulovat k sekreci).
- kombinovaná terapie perorální antidiabetika + inzulín je indikována v případě, kdy nelze perorální léčbou dosáhnout požadované kompenzace. Základem terapie by vždy měl být metformin, optimálně v kombinaci s inkretiny nebo glifloziny, zejména u pacientů se zvýšeným KV rizikem (vhodnější než deriváty sulfonylurey), při prokázané inzulinorezistenci je ke zvážení pioglitazon. Velkou chybou je váhat se zahájením terapie inzulínem při nedostatečné kompenzaci diabetu. Při inzulinoterapii obvykle začínáme konvenčním režimem a až při nedostatečné kompenzaci přecházíme k intenzifikovanému. Vždy je potřeba pamatovat na inzulinorezistenci, která může výrazně zvýšit potřebu inzulínu. Lze užít dlouhodobý inzulín 1x denně, premixovaný inzulín 2x denně nebo intenzifikované režimy (viz výše).
Antiobezitika a bariatrická chirurgie – indikována u obézních pacientů (BMI > 35), kdy u jinak velice obtížně kompenzovatelných pacientů může zlepšit kompenzaci.
Pacienti by měli být sledování nejméně dvakrát ročně. Kontrola je podobná jako u DM I. typu, důraz je nutné zejména klást na primární a sekundární prevenci aterosklerózy, kde platí dle GL následující zásady:
- fyzická aktivita nejméně 150 minut týdně
- léčba hypertenze – cílový TK je 120 – 130/70 – 80 mm Hg, u starších lidí sTK 130-139 mm Hg. Lékem volby jsou ACE inhibitory, při jejich nesnášenlivosti sartany, iniciálně v kombinaci s blokátorem kalciových kanálů (BKK) a/nebo diuretikem. Důležitá je redukce soli < 5,8 g, dostatek ovoce a zeleniny a středomořská dieta. U pacientů je nutná selfmonitorace. TK sami o sobě snižují i GLP-1 agonisté a glifloziny.
- kontrola glykémií – cílová kompenzace diabetu vyjádřená hladinou je < 53 mmol/mol, přičemž její zlepšení o každých 7,5 mmol/mol HbA1c sníží riziko infarktu myokardu o 15 % (ale bez vlivu na celkovou mortalitu i incidence CMP).
- léčby dyslipidémie – u jedinců ve středním/vysokém/velmi vysokém KV riziku je cílová hladina LDL cholesterolu < 2,6/1,8/1,4 mmol/l, přičemž redukce jeho hladiny o každý 1 mmol/l dosažená statinem byla spojena s poklesem celkové mortality o 9 % a zlepšení KVR o 21 %, ale na druhou stranu se u nediabetiků zvýší riziko vzniku diabetes mellitus o 10 % (toto riziko ale za benefit, které statiny přináší, stojí).
- Pokud není přítomna mikroalbuminurie nebo vaskulární poškození, je rozumné odložit terapii statiny do 30 let věku (u žen, které se nechrání při styku a chtějí otěhotnět po celé fertilní období). Pokud není u diabetiků dosaženo cílové hladiny LDL (téměř nikdy) a jsou splněny výše uvedené podmínky, je indikován statin. Pokud k dosažení cílového LDL nestačí statin v maximální tolerované dávce je indikováno přidání ezetimibu, pokud není dosaženo cíle ani při této kombinaci, je indikován PCSK9 inhibitor (studie ODDYSEY DM-INSULIN, FOURIER, ODDYSEY OUTCOMES). Při vysoké hladině triacylgylcerolů (> 2,3 mmol/l) a zejména v kombinaci s nízkou hladinou HDL jsou indikovány fibráty, které vedou k redukci nefatálních infarktů myokardu, bez vlivu na celkovou úmrtnost.
- preventivní použití kyseliny acetylsalicylové (ASA) lze zvážit u pacientů ve vysokém/velmi vysokém KV riziku (u středního rizika se nedoporučuje), vždy s kombinaci s inhibitory protonové pumpy.
- vždy je potřeba přestat kouřit.
- zásadní je i kontrola hyperglykémie, kdy dobrá kontrola vedla ke snížení KVR o 10 – 20 % dle různých studií (UKPDS, ACCORD, ADVANCE, DIGAMI 1 a 2).
- u pacientů ve vysokém/velmi vysokém riziku je indikováno přednostní použití SGLT2 inhibitorů (empagliflozin – nejvíce důkazů, canagliflozin, dapagliflozin) a GLP-1 agonistů (liraglutid – nejvíce důkazů, semaglutid, dulaglutid), u středního/nízkého rizika metformin. Pioglitazon ani saxagliptin jsou nevhodné u pacientů se srdečním selháním. Naopak, metformin je dle GL bezpečný u všech (!?) stádií srdečního selhání při GF > 0,5 ml/s.
- indikace beta blokátorů odpovídá nediabetikům, přičemž nebivolol nebo carvedilol mohou snižovat inzulinorezistenci.
- při revaskularizaci u diabetika platí, že čím závažnější postižení, tím je vhodnější CABG oproti PCI (PCI ke zvážení pouze u lehkého postižení LM se SYNTAX skóre 0 – 22 a u nemoci jedné nebo dvou tepen, hraničně u lehkého postižení tří tepen do SYNTAX 0 – 22, jinak je PCI kontraindikována).
- management fibrilace síní, onemocnění aorty i periferních tepen je stejný jako u nediabetiků.
Gestační diabetes mellitus
Gestační diabetes mellitus (GDM) je porucha metabolismu glukózy, která se objeví po 20. týdnu gravidity, popř. zjevný DM, který splňuje méně přísná normální kritéria DM. Vzniká díky zvýšení inzulínové rezistence (v těhotenství fyziologická, chrání matku i dítě před hypoglykémií při zvýšených nárocích na glukózu), která vzniká u predisponovaných žen, které nejsou schopny adekvátně zvýšit hladinu inzulínu (proto jde o rizikový faktor vzniku DM II. typu v pozdějším věku). Postihuje 15 % těhotných žen (nejčastějšími rizikovými faktory jsou věk > 25 let, nadváha, DM II. typu v rodině, předchozí porod plodu > 4 kg, syndrom polycystických ovárií) a takto postižené ženy mají větší riziko preeklampsie/eklampsie a rozvoje DM II. typu v pozdější době. Hyperglykémie matky působí hyperinzulinismus plodu, který vede k hypertrofii plodu s jeho funkční nezralostí (ikterus, nezralost plic, hypoglykémie) a častějším komplikací při porodu. Takto postižené děti mají v dospělosti vyšší riziko DM II. typu, kardiovaskulárních chorob i poruchy pozornosti a hyperreaktivity v adolescenci. Screening probíhá u každé těhotné (mimo osobu s prokázaným DM před otěhotněním) a je dvoufázový:
- ve 14 t.g. se stanoví glykémie na lačno – GDM je stanoven při opakovaném zjištění glykémie 5,1 – 6,9 mmol/l, při glykémii 7,0 a výše jde o zjevný DM.
- ve 24. – 28. t.g. se provádí oGTT(tříbodový). GDM je stanoven při glykémii na lačno/po 1 hodině/po 2 hodinách > 5,1/10.0/8,5 mmol.
Cíle léčby jsou glykémie na lačno < 5,3 mmol/l, 1 hodinu po jídle < 7,8 mmol/l a HbA1c < 40 mmol/l. Základem je omezení cukrů na cca 200 g/den (zejména rychle vstřebatelných jednoduchých cukrů) a přiměřená fyzická aktivita, pokud nejsou cíle splněny je indikován metformin, popřípadě inzulín. Po porodu je vhodné kojení dítěte, což snižuje riziko jeho pozdější nadváhy. Za 6 – 12 měsíců po porodu je indikováno zopakování oGTT a další sledování matky cca 1x ročně, protože je 50 % riziko rozvoje DM II. typu v pozdějších letech.
Akutní komplikace diabetu
Hypoglykemie
Pokles glykémie < 3,8 mmol/l s aktivací kontraregulačních hormonů (< 3,8 mmol/l glukagon, < 3,5 mmol/l katecholaminy, < 3,1 mmol/l růstový hormon, < 2,8 mmol/l kortizol). Příznaky hypoglykémie:
- adrenergní – tachykardie, palpitace, třes, nervozita, úzkost, strach.
- cholinergní – pocení a hlad.
- neuroglykopenické kvantitativní a kvalitativní poruchy vědomí – porucha soustředění, zmatenost, bolest hlavy, křeče, bezvědomí apod.
Nejčastější příčinou vzniku hypoglykémie u diabetiků je nepoměr mezi dávkou inzulínu nebo stimulátorů jeho sekrece a přijatou potravou. Další příčinou je požití většího množství alkoholu, který snižuje glukoneogenezi a výrazná fyzická aktivita (CAVE Nejen bezprostředně po aktivitě, ale i s několikahodinovým zpožděním). Při lehčí hypoglykémii požije pacient menší množství sacharidů (např. 2 dcl sladkého džusu, sladký čaj), při bezvědomí není možné podávat nic per os pro nebezpečí aspirace, léčbou je podání Glukagonu i.m nebo s.c. nebo i.v. podání glukózy. Po 15 minutách po podání cukrů je nutné zkontrolovat glykémii, při přetrvávání hypoglykémie zopakovat postup a přeměřit se po dalších 30 minutách. V případě hypoglykemického kómatu je indikováno podání i.v. bolusu glukózy s jejím kontinuálním podáváním dle glykémií.
CAVE Deriváty sulfonylurey mají účinek 2 – 3 dny, proto při jejich předávkování i takto dlouho přetrvává tendence k hypoglykémii.
Diabetické hyperosmolární hyperglykemické kóma
Závažný stav s těžkou hyperglykémií a hyperosmolalitou plazmy bez ketoacidózy, nejčastěji u starších pacientů s DM II. typu. Při nedostatku inzulínu se zvyšuje glykogenolýza a glukoneogeneze se zhoršením periferní utilizace glukózy. Dochází k hyperglykémii a glykosurií s osmotickou diurézou. Vzniklá hyperglykémie a dehydratace dává vznik výrazné hyperosmolalitě s narůstajícím pocitem žízně až hypotenzí s poruchou vědomí až kómatem. Laboratorně lze prokázat těžkou hyperglykémii a hyperosmolaritu s dehydratací a zhoršením renálních funkcí. Léčba musí probíhat na JIP. Základem je rehydratace (dle natrémie 0,45 % nebo 0,9 % roztok NaCl) s kontinuálním podáváním inzulínu s úpravou dávkování dle glykémie. Pokles glykémie by měl být pomalý (2 – 4 mmol/l), aby byl pomalý i pokles osmolality. Při podání inzulínu dochází i k redistribuci K+, které je nutné hradit. Při glykémii 15 mmol/l lze začít roztok NaCl kombinovat s 5 % glukózou. Součástí terapie je udržování vitálních funkcí, prevence trombembolie při dehydrataci a terapie infekcí. Prognóza bývá nepříznivá, protože pacienti jsou často vyššího věku a trpí metabolickým syndromem.
Diabetická ketoacidóza
Závažný stav s hyperglykémií, ketonémií a metabolickou acidózou, který je častější u DM I. typu (může se ale vyskytnout i u DM II. typu). Při absolutním nedostatku inzulínu se zvyšuje lipolýza i hladina volných mastných kyselin, které jsou substrátem ke tvorbě ketonů (acetoacetát, beta-hydroxybutyrát, aceton). Mezi vyvolávající faktory může patřit i interkurentní onemocnění, onemocnění GIT nebo cerebrovaskulární a kardiovaskulárná příhody. V počínající fázi mohou být pouze známky dehydratace při hyperglykémii s glykosurií, následně se objevuje nauzea, zvracení až porucha vědomí. Typické je hluboké Kussmaulovo dýchání a z dechu je možné cítit aceton.
Hyperglykémie nebývá tak vysoká jako při hyperosmolárním kómatu (ketoacidóza může vzniknout již při 15 mmol/l), dále je typická high-AG metabolická acidóza a ketonémie. Zvýšená může být hladina amylázy, triacylglycerolů a celkového cholesterolu.
Základem léčby je rehydratace (500 – 1500 ml/hodinu s úpravou dle dalšího vývoje, CAVE při srdečním selhání), při hyponatrémii substituce 10 % NaCl). Zásadní složkou terapie je kontinuální podávání inzulínu v dávce 0,1 IU/kg/hodinu (ředění 50 IU inzulínu + FR do 50 ml, 1ml = 1 IU) s kontrolou glykémií á 1 hodinu. Pokles glykémie by měl být pomalý (2 – 4 mmol/l), aby byl pomalý i pokles osmolality (v opačném případě je zejména u dětí riziko vzniku edému mozku). Při glykémii 15 mmol/l lze začít roztok NaCl kombinovat s 5 % glukózou. Při korekci acidózy a podávání inzulínu je mohutná redistribuce intracelulárně s nutností podávání draslíku ve formě 7,5 % KCl. Prognóza ketoacidotického kómatu bývá příznivá, zejména protože jde o mladší a celkově méně nemocné diabetiky I. typu).
Pozdní komplikace diabetu
Jde zejména o mikro- a makrovaskulární komplikace, které jsou úzce závislé na úrovni kompenzace DM a jsou v podstatě zásadní složkou v patofyziologickém řetězci rozvoje aterosklerózy (spolu s hypertenzí, dyslipidémií apod.). Kromě setrvalé hyperglykémie se na vzniku komplikací podílí i glykemická variabilita (kolísání glykémie během dne). Komplikace lze dělit na:
- makrovaskulární – v první fázi jde o endoteliální dysfunkci (omezení vazodilatace arterií) s následnou akcelerací aterosklerózy. Tento proces je významně urychlován chronickou hyperglykémií i glykemickou variabilitou a jeho bezprostřední příčinou je zvýšený oxidační stres a neenzymová glykace s postupnou změnou strultury i enzymatické výbavy cévní stěny.
- mikrovaskulární – jsou na úrovní kapilár, pre- a postkapilár. Snižuje se počet pericytů v cévní stěně a zvýšení apoptózy endoteliálních buněk s rozvojem tkáňové hypoxie s následnou proliferací extracelulární matrix (mezangia u diabetické nefropatie) nebo novotvorbě cév (u proliferativní retinopatie). Ztlušťuje se bazální membrána a se glykuje kolagen cévní stěny, který se hůře odbourává. Zároveň se zvyšuje její permeabilita pro plazmatické proteiny i ostatní složky.
Mikrovaskulární komplikace diabetu
U DM I. typu jsou mikrovaskulární komplikace během prvních 5 – 10 let trvání choroby vzácné (choroba je odhalena již zpočátku svého vzniku), naopak, u DM II. typu jsou mikrovaskulární příznaky přítomny již při záchytu choroby, protože často probíhá dlouho neodhaleně a skrytě.
Diabetické onemocnění ledvin
Blíže viz http://mame-radi-internu.cz/jednotlive-obory-vnitrniho-lekarstvi/vi-nefrologie/308-glomerulopatie/
Diabetická retinopatie
Jedna z nejčastějších příčin slepoty v rozvinutých zemích. U DM I. typu se vyskytuje u 70 % pacientů (proliferativní u 25 %), u DM II. typu ve 40 % (při léčbě inzulínem je podobná jako u DM I. typu). Mezi hlavní mechanismy vzniku patří oxidační stres, neenzymová glykace, aktivace polyolové cesty a proteinkinázy C a následně VEGF, který je zásadním faktorem novotvorby cév. V úvodu je dlouhé preklinické stádium, které je bez strukturálních změn na očním pozadí, následuje neproliferativní stádium, kdy dochází k cévním abnormalitám a mikroaneuryzmatům s možností krvácení do sítnice. Dochází ke zvýšení permeability cév se vznikem perivaskulárních lipidových depozit. Následuje proliferativní stádium, při kterém vznikají nové cév, které jsou méně kvalitní, sítnice ischemizuje a fibrotizuje a trakce této neovaskularizované tkáně může vést k trakčnímu odchlípení sítnice. V případě postižení makuly dochází ke ztrátě zraku. Základní prevencí a léčbou neproliferativní fáze je dobrá kompenzace diabetu a pravidelná kontrola očního pozadí. Léčbou proliferativní fáze je laserová fotokoagulace sítnice, při nedostatečném efektu je nutná vitrektomie. Slibná je biologická léčba, zejména inhibitory VEGF (např. ranibizumab).
Diabetická neuropatie
Postihuje cca 60 % jedinců s diabetem. Neenzymová glykace a oxidační stres přímo poškozují nervy, toto zhoršuje dále ischemie nervu způsobená mikroangiopatií vasa nervorum. Dle projevů rozlišujeme formy:
- autonomní polyneuropatie – postihuje cca 30 % pacientů s DM a projevuje se velice různorodě:
- GIT – porucha vyprazdňování žaludku má za následek nevolnost a těžko u žaludku po jídle, snížení/zvýšení pohyblivost střev se vznikem zácpy/průjmu.
- kardiovaskulární – tachykardie, hypotenze, zejména ortostatická, erektilní dysfunkce
- snížené pocení na dolní polovině a zvýšené na horní polovině těla
- symetrická senzitivně-motorická polyneuropatie – bolesti a parestezie nebo naopak hypestezie (snížení citlivosti na bolest, teplo, chlad a vibrace) postihující nejčastěji distální části dolních končetin (tzv. ponožkovitá lokalizace) a to zejména v klidu a teple (typicky v noci a posteli).
- asymetrická polyneuropatie – postižení jednoho nebo několika málo nervů:
- úžinové syndromy – např. syndrom karpálního tunelu
- postižení okohybných nervů (např. n. oculomotorius)
- thorakoabdominální a pelvické neuropatie
- diabetická amyotrofie – neuropatie postihující psoaty, pánevní svalový pletenec a kvadriceps. Typická je atrofie těchto svalů a neschopnost chůze do schodů. Příčina je nejasná, choroba může spontánně regredovat během několika měsíců až let.

CAVE Pacienti vůbec nemusí cítit infarkt myokardu. ICHS se u nich neprojevuje stenokardiemi, ale např. progresí dušnosti.
Diagnostika – klinické příznaky, definitivní diagnózu dá EMG. Screeningovým testem je test monofilamentem, testování dotyku ostrým nebo tupým předmětem nebo test hlubokého čití pomocí ladičky.
Terapie – zásadní je dlouhodobá dobrá kompenzace diabetu. Pokud je přítomna hyperglykémie, může její rychlá kompenzace naopak vyprovokovat zhoršení neuropatie, proto je potřeba glykémii kompenzovat postupně. Medikamentózně lze použít gabapentin, pregabalin a duloxetin, někdy se doporučuje kyselina thioktová, jejíž účinek je ale sporný. Kauzální léčba není známa.
Syndrom diabetické nohy
Postižení tkání dolní končetiny od kotníku dolů s tvorbou defektů, deformit, osteomyelitidy nebo Charcotovy osteoartropatie. Příčinou je neuropatie a ischemie končetiny s tkáňovou hypoxií a nasedající infekcí. Snížení inervace vede k tvorbě mikrotraumat, které si pacient ani neuvědomuje s následnou poruchou hojení díky špatné výživě tkáně. Výsledkem může být likvidace struktury skeletu postižené nohy (Charcotova osteoartropatie). Hlavní prevencí je dobrá kontrola glykémie. Pacienti si musí pečovat o nohy a vyvarovat se poranění nohou, které je při jejich vzniku nutné důsledně ošetřit a dohojit. Dále je nutné šetrné odstraňování otlaků, ochrana před nadměrným chladem nebo teplem a nošení vhodné obuvi. Při vzniku infekce je nutná okamžitá léčba antibiotiky. Při rozsáhlejší gangréně a osteomyelitidě je často nutná amputace s rizikem zhoršeného hojení.
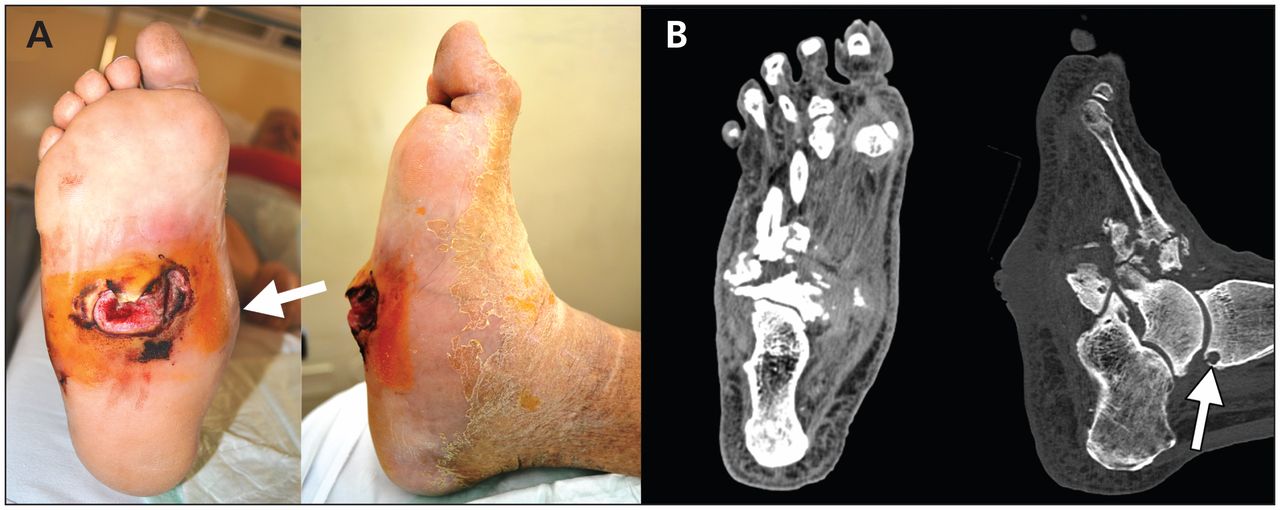
Makrovaskulární komplikace diabetu
V podstatě jde o akceleraci aterosklerózy, přičemž kardiovaskulární riziko je u diabetiků 2 – 4x vyšší než u zdravé populace. Na kardiovaskulární komplikace zemře 75 % pacientů s DM II. typu a 35 % pacientů s DM I. typu.
Léčba diabetu v praxi
Měření glykémií
Hlavním parametrem metabolismu glukózy je ranní glykémie na lačno. Glykémie z žilní plazmy je obvykle o 15 – 20 % vyšší než z kapilární krve. Termíny:
- glykémie na lačno – glykémie po nejméně 8 hodinovém lačnění
- glykémie před jídly – před snídaní, obědem a večeří
- postprandiální glykémie – glykémie 2 hodiny po snídaní, obědu a večeři
- glykémie před spaním – ve 22 hodin
- glykemický profil – před snídaní, obědem a večeří, 2 hodiny po snídani, obědu a večeři a ve 22 hodin (7 měření)
- velký glykemický profil – glykemický profil + ve 3 hodiny v noci (8 měření)
- ranní glykémie na lačno je ukazatelem bazální sekrece inzulínu, popř. inzulínové rezistence a akcelerované glukoneogeneze v noci. Při léčbě inzulínem by zvýšená ranní glykemie měla být signálem ke zvýšení dlouhodobého inzulínu. CAVE Zvýšená glykémie ráno na lačno může být i důsledek aktivace kontraregulačních enzymů při noční hypoglykémii!!! K došetření zvýšené ranní glykémie na lačno je tedy vhodné stanovit noční glykémii ve 3:00.
- glykémie před jídly je (podobně jako ranní glykémie) ukazatelem bazální sekrece inzulínu. U diabetiků na intenzifikovaném režimu slouží k posouzení adekvátnosti dlouhodobého inzulínu a doladění dávky krátkodobého inzulínu před jídlem.
- postprandiální glykémie – slouží k posouzení schopnosti organismu uvolnit inzulín po příjmu potravy, proto je nutné znát i glykémii před jídlem. U diabetiků na intenzifikovaném režimu slouží k posouzení adekvátnosti dávky krátkodobého inzulínu před jídlem.
Obecně, pacienti na inzulínu by si měli ihned stanovit glykémii při jakémkoliv nevysvětlitelném fyzickém nebo psychickém problému.
Diabetes mellitus a chirurgický výkon
Před chirurgickým výkonem by pacient měl být co nejlépe kompenzován, ale zhoršená kompenzace není sama o sobě důvodem k odmítnutí operace. Pokud je operace plánovaná, není vhodné krátce před výkonem měnit terapii DM (jak léky, tak jejich dávky). Při akutním výkonu je vhodné se i krátce před výkonem snažit o kompenzaci (vždy pomocí intenzifikovaného režimu, event. pomocí kontinuálního podávání inzulínu). Pokles glykémie by neměl být rychlejší než 2 – 4 mmol/hodinu, za dobrou hladinu lze považovat glykémie < 10 mmol/l.
CAVE Pacienti s DM I. typu (ale i inzulín deficitním DM II. typu) nikdy nesmí zůstat zcela bez inzulínu pro riziko vzniku ketoacidózy.
Před operací je vhodné na dva dny vysadit metformin a inzulín ponechat do posledního dne před výkonem. V den výkonu zůstává pacient na lačno, neužívá ostatní perorální antidiabetika a je mu podáno 500 ml 10 % glukózy s 10 – 12 IU rychle působícího inzulínu. Množství inzulínu lze upravit podle aktuální glykémie a typu diabetu. Při DM II. typu a inzulínové rezistenci lze podat 16 IU, při DM I. typu 6 – 10 IU, pro riziko vzniku hypoglykémie perioperačně spíše ale méně než více (s podáním se pokračuje i během výkonu). Do obnovení perorálního příjmu je vhodné první tři dny podávat 150 – 200 g glukózy s inzulínem obvykle doplněné 500 – 1000 ml krystaloidů. Pokud trvá omezení per os příjmu > 3 dny je vhodné zahájení nutriční podpory.
Za hospitalizace je častou chybou rozepisovat inzulín na základě aktuální glykémie. Vždy je potřeba se podívat na kompenzaci během předchozích několika dnů a reakci pacienta na dané dávky inzulínu a až podle toho stanovit jeho dávky. Další chybou je úprava dlouhodobého inzulínu na základě glykémie ve 22 hodin nebo dokonce jeho vynechání při normální glykémii.
Diabetes mellitus a alkohol
Alkohol je významným zdrojem energie, což je nevýhodné zejména u DM II. typu. Z metabolického hlediska alkohol potlačuje glukoneogenezi v játrech se snížením glykémie, což je nebezpečné zejména při současném užívání derivátů sulfonylurey nebo inzulínu. U DM I. typu navíc hrozí vynechání inzulínu v ebrietě s rizikem ketoacidózy nebo laktátové acidózy při současném užívání metforminu. Platí, že diabetik by nikdy neměl konzumovat alkohol na lačno a nikdy by při tom neměl být sám.