Akutní virové hepatitidy jsou systémové infekce, které dominantně postihují játra. Mimo HBV (DNA) jsou všichni jejich původci RNA viry. Přestože jsou na molekulární a antigenní úrovni odlišné, působí podobné klinické příznaky, které sahají od inaparentního průběhu po fulminantní akutní selhání jater nebo chronické onemocnění, které progreduje do cirhózy a je komplikováno hepatocelulárním karcinomem (HBV, HCV, HDV).
Zdá se, že žádný z virů hepatitidy nepůsobí na hepatocyty přímo cytopaticky, poškození je způsobeno imunitním systémem.
Patologie – společnou morfologickou lézí všech typů virových hepatitid jsou panlobulární infiltrace mononukleáry (hlavně malými lymfocyty, ale i plazmocyty a eozinofily), buněčné nekrózy, balónovité degenerace, acidofilní degenerace (obsahuje apoptotická neboli Councilmanova tělíska), hyperplazie Kupfferových buněk, různý stupeň cholestázy, dále jsou patrny regenerativní změny hepatocytů (četná mitotická aktivita, mnohojaderné buňky, pseudoacinární a rosetové formace). U akutní hepatitidy jsou někdy přítomny těžké změny nazývané přemosťující nekrózy, které se táhnou mezi lalůčky a vznikají smrtí jaterních buněk s kolapsem retikulinových vláken. Vlastní přemostění je tvořeno kondenzovaným retikulinem, zánětlivým detritem a degenerovanými hepatocyty. Přítomnost této léze je nepříznivým prognostickým znamením u subakutní hepatitidy (během několika týdnů nebo měsíců pacienti umírají nebo progredují do těžké chronické hepatitidy nebo cirhózy), nemá však prognostický význam u akutní hepatitidy. U pacientů, kteří zemřeli na fulminantní akutní hepatitidu, lze někdy sekčně nalézt malá, scvrklá játra měkké konzistence. Mikroskopicky je přítomna masivní nekróza většiny hepatocytů s rozsáhlým kolapsem retikulinu.
Klinický obraz – klinický obraz akutní virové hepatitidy se rozvíjí po inkubační době:
- HAV 15 – 45 dní (průměrně 4 týdny)
- HBV, HDV: 30 – 180 dní (průměrně 8 – 12 týdnů)
- HCV: 15 – 160 dní (průměrně 7 týdnů)
- HEV: 14 – 60 dní (průměrně 5 – 6 týdnů)
- Prodromální stádium předchází ikterické stádium o 1 – 2 týdny a je velmi variabilní. Úvodem bývá nauzea, zvracení, anorexie, malátnost, artralgie, myalgie, bolesti hlavy, světloplachost, faryngitida, kašel a rýma. Dále bývají přítomny změny čichu a chuti. U hepatitidy A a E (častěji než u B a C) jsou přítomny i mírné horečky 38 – 39 st C. Tmavá moč a světlá stolice se objevují 1 – 5 dní před nástupem ikteru.
- Při ikterickém stádiu se snižuje intenzita prodromálních příznaků, u některých pacientů dochází k mírnému snížení hmotnosti (2,5 – 5 kg). Objevuje se hepatomegalie s citlivostí v pravém horním kvadrantu. U některých pacientů se objevuje cholestáza, což bývá spojeno s extrahepatální obstrukcí. U 10 – 20 % pacientů se objevuje splenomegalie a cervikální adenopatie. Zřídka se objevují pavoučkovité névy, které mizí v průběhu rekonvalescence. U velké části virových hepatitid nedochází ke vzniku ikteru.
- Postikterická fáze rekonvalescence je variabilní (2 – 12 týdnů) a trvá déle u akutní hepatitidy B a C. Při rekonvalescenci mizí prodromální příznaky, ale může přetrvávat hepatomegalie a elevace jaterních testů. Kompletní zotavení lze očekávat za 1 – 2 měsíce po infekci hepatitidou A a E a 3 – 4 měsíce po infekci hepatitidou B a C, která nepřechází do chronicity (do chronicity nepřechází 95 – 99 % případů hepatitidy B, ale jen 15 % případů hepatitidy C).
Diagnostika
- AST, ALT – předchází vznik ikteru, jejich hladina nekoreluje přesně s mírou poškození hepatocytů. Bývají zvýšeny i u anikterických forem. ALP bývá vzácně jen mírně zvýšené.
- bilirubin – ikterus se objevuje při vzestupu bilirubinu ˃ 43 μmol/l, většinou dosahuje hodnot 85 – 340 μmol/l. Hodnoty nad 340 μmol/l event. přetrvávání ikteru do pozdních stádií bývají spojeny s těžším průběhem choroby.
- hladina nekonjugovaného a konjugovaného bilirubinu bývá vyrovnaná.
- u některých pacientů může ikterus zhoršovat ještě přítomná hemolýza (srpkovitá anémie, deficit glukóza- 6- fosfát dehydrogenázy). V těchto případech byla zaznamenána i hladina více než 513 μmol/l aniž by byla spojena s horší prognózou.
- hypoglykémie – z důvodu nevolnosti, zvracení s nedostatečným příjmem sacharidů a snížením jaterních rezerv glykogenu. Vyskytuje se u těžkých hepatitid.
- krevní obraz – úvodem je neutropenie a lymfopenie, poté relativní lymfocytóza. V akutní fázi jsou běžné atypické lymfocyty.
- protrombinový čas – prodloužení INR znamená zhoršení syntetické schopnosti, rozsáhlé nekrózy a zhoršení prognózy.
- albumin – většinou normální (dlouhý poločas).
- imunoglobuliny – mírná elevace bývá během akutní fáze u 1/3 pacientů (IgG a IgM , IgM během častěji u hepatitidy A).
- ostatní markery
- v akutní fázi mohou být přítomny v nízkém titru SMA, ANA, RF.
- u hepatitidy C a D mohou být přítomny anti-LKM (jsou odlišné od sebe navzájem i od anti-LKM, které jsou přítomné u autoimunitní hepatitidy II. typu).
U některých pacientů byla zaznamenána jen mírná a přechodná steatorea, podobně jako přechodná mikroskopická hematurie a minimální proteinurie.
Jaterní biopsie je u pacientů s akutní hepatitidou jen zřídka potřeba. Naopak je indikována při podezření na chronickou formu onemocnění.
Při podezření na akutní virovou hepatitidu by měl pacient podstoupit screeningově čtyři sérologické testy – IgM anti-HAV, HBsAg, IgM anti-HBc, anti-HCV.
Interpretace:
| Testy při podezření na akutní hepatitidu | ||||
| HBsAg | IgM anti-HAV | IgM anti-HBc | Anti-HCV | Interpretace |
| + | – | + | – | akutní hepatitida B |
| + | – | – | – | chronická hepatitida B |
| + | + | – | – | akutní hepatitida A nasedající na terén chronické hepatitidy B |
| + | + | + | – | akutní hepatitidy A + B |
| – | + | – | – | akutní hepatitida A |
| – | + | + | – | akutní hepatitida A + B (HBsAg pod rozlišovací schopností metody) |
| – | – | + | – | akutní hepatitida B (HBsAg pod rozlišovací schopností metody) |
| – | – | – | + | akutní hepatitida C |
Při podezření na chronickou virovou hepatitidu by měl pacient podstoupit dva sérologické testy – HBsAg, anti-HCV.
- HBV – při stanovení pozitivity HBsAg se stanovuje HBeAg a anti-HBe k určení infekčnosti pacienta. HBV DNA zde potvrzuje jednak pozitivitu HBeAg a jelikož je citlivější, je vhodná k monitoraci účinku antivirové terapie.
- HDV – anti-HDV je vhodné provést u pacientů s hepatitidou B s těžkou, fulminantní formou, se závažným chronickým průběhem a při akutní exacerbaci chronické hepatitidy B (zejména po návratu ze zemí, kde je HDV endemicky rozšířená).
- HCV – anti-HCV a HCV RNA slouží k potvrzení diagnózy chronické hepatitidy C.
Komplikace – nejobávanější komplikací virových hepatitid je fulminantní hepatitida s masivní nekrózou jater. Vyskytuje se zejména u hepatitidy B + D i u E, jen vzácně u hepatitidy A (zejména u starších pacientů s chronickým postižením jater). Pacienti obvykle přichází se známkami jaterní encefalopatie, která rychle progreduje do kómatu. Játra jsou obvykle malá a protrombinový čas je nadměrně prodloužen. Kombinace zmenšujících se jater, s klinickým obrazem kvalitativní a kvantitativní poruchy vědomí, ascitem a otoky znamená, že dochází k akutnímu selhání jater. Běžný je následně edém mozku, krvácení do GIT, sepse, respirační selhání, šokový stav a selhání ledvin. Mortalita je mimořádně vysoká (˃ 80 % u pacientů v kómatu). Pokud pacienti přežijí, může dojít ke kompletní restituci stavu. Život zachraňující může být transplantace jater. Hepatitida B představuje ˃ 50 % fulminantních případů virové hepatitidy, zejména pokud je spojena s infekcí HDV, hepatitida C je jen málokdy příčinou fulminantního průběhu, hepatitida E mívá fulminantní průběh v 1 – 2 % případů, ale až ve 20 % u těhotných žen.
Další obávanou komplikací je vznik hepatocelulárního karcinomu. Nejvyšší riziko je u pacientů se vznikem infekce v časném dětství, zejména u lidí s vysokými hodnotami HBeAg a HBV DNA (replikací viru). Riziko se zvyšuje i u pacientů s hepatitidou, zejména ve stádiu cirhózy, většinou po více než 30 letech trvání choroby.
Mezi vzácné komplikace virových hepatitid patří akutní pankreatitida, myokarditida, atypická pneumonie, aplastická anémie, transverzální myelitida a periferní neuropatie. Vzácně může být akutní hepatitida spouštěčem autoimunitní hepatitidy (zejména poakutní hepatitidě A, B, C).
Diferenciální diagnostika – klinický obraz akutní hepatitidy mohou napodobovat:
- infekce – cytomegalovirus, herpes simplex, coxsackievirus a toxoplasmóza může způsobit elevaci transamináz, vzácně i bilirubinu. Obecně jakákoliv virová infekce může být provázena elevací transamináz, z ostatních leptospiróza, kandidóza, brucelóza a pneumocystóza.
- alkohol – při alkoholové hepatitidě nebývají aminotransferázy tak elevované a bývají přítomna i ostatní stigmata alkoholismu.
- postižení žlučových cest – jelikož se při akutní hepatitidě může vyskytovat bolestivost v pravém horním kvadrantu břicha, nevolnost, zvracení, horečka, ikterus je často zaměňována za akutní cholecystitidu, obstrukci vývodných žlučových cest nebo ascendentní cholangoitidu. Před plánovanou operací je nutné hepatitidu vyloučit, protože pacienti s akutní hepatitidou špatně tolerují chirurgický zákrok.
- starší pacienti – u starších pacientů obstrukce vývodných cest litiázou nebo karcinom pankreatu.
- kardiovaskulární poruchy dále – jaterní kongesce při pravostranném srdečním selhání, Budd Chiariho syndromu, okluze v oblasti v. cava inferior nebo hypoperfúze jater při syndromu nízkého srdečního výdeje při levostranném srdečním selhání.
- ostatní – akutní hepatitidu může také napodobovat akutní steatóza jater, cholestáza v těhotenství, preeklampsie a HELLP syndrom, velmi vzácně metastázy do jater, Wilsonova choroba, deficit α1 antitrypsinu, nealkoholická steatóza a steatohepatitida.
Terapie akutní hepatitidy – mimo těžce probíhající infekce není většinou potřeba hospitalizace.
Ambulantně je vhodné:
- omezit fyzickou aktivitu.
- příjem dostatečně kalorické stravy (pacienti nejlépe tolerují stravu dopoledne).
- vyhnout se lékům, které mohou mít jako vedlejší účinek cholestázu a které jsou metabolizovány v játrech.
- při pruritu je vhodný cholestyramin.
- vyloučit terapii glukokortikoidy (i při těžkém průběhu), protože zvyšují riziko přechodu do chronické fáze (zejména u akutní hepatitidy B).
Hospitalizovaní pacienti mohou být propuštění na základě klinickému zlepšení, poklesu hladiny transamináz a bilirubinu v séru a normalizaci protrombinového času. Mírná elevace transamináz by neměla bránit dimisi. V případě fulminantní hepatitidy je nutná celková podpora pacienta (tekutiny, krevní oběh a dýchání, kontrola krvácení, korekce hypoglykémie a léčba dalších komplikací). Mělo by dojít k restrikci celkového množství přijatých bílkovin a perorální podání laktulózy nebo neomycinu (sterilizace střeva). Je vhodné profylaktické krytí antibiotiky. Jediným řešením je často transplantace jater. Jako neúčinné se ukázalo podávání glukokortikoidů, plasmaferéza, perfúze prasečími játry a hemoperfúze.
Preventivní opatření
- izolace pacientů (vlastní pokoj a vlastní sprcha) je nyní nutná jen u:
- pacientů s hepatitidou A a E s průjmem.
- pacientů s hepatitidou B s nekontrolovatelných krvácením (s nebo bez hepatitidy D).
- všech pacientů s hepatitidou C.
- u pacientů s hepatitidou A a E by měl kladen důraz na hygienu.
- u pacientů s hepatitidou B zase na opatrnost při kontaktu s krví.
Hepatitida A
Epidemiologie – přenos je téměř výhradně fekálně – orální cestou a je podporován špatnou hygienou. Kontaminované mohou být potraviny (mléko, mražené maliny a jahody, zelené cibulky z Mexika, korýše) i voda. Časté je šíření intrafamiliární, intrainstitucionální nebo cestou z endemických oblastí.
Incidence HAV stoupá s rostoucím věkem a klesajícím socioekonomickým statutem. V mírném pásmu jsou epidemie hepatitidy A ve vlnách každých 5 -20 roků. Nejčastěji se vyskytuje v pozdním podzimu a na začátku zimy. Ve vyspělých zemích incidence hepatitidy A klesá, v rozvojových zemích se člověk hepatitidou A nakazí téměř vždy v dětství. Choroba má těžší průběh u dospělých pacientů, než u dětí.
V USA mělo v roce 1970 40 % populace přítomnou pozitivitu anti-HAV, aniž by většina z nich měla někdy klinické symptomy. Od té doby ale postupně incidence klesá. Očkování dětí v endemických oblastech snížilo meziročně incidenci výskytu nových případů hepatitidy A o více než 70 %. Díky tomuto poklesu jsou častější těžké formy choroby, protože pacienti nemají přítomné anti-HAV protilátky. Mezi ohrožené skupiny (zde by se měla provést vakcinace) patří: vojenský personál, osoby s cyklickou manifestací hepatitidy A (např. domorodci v Aljašce), zaměstnanci denních stacionářů, ošetřovatelé primátů, cestovatelé do endemických oblastí, laboratorní pracovníci, kteří pracují se vzorky stolice a pacienti s chronickým onemocněním jater.
Etiologie – HAV je neobalený, 27 nm veliký, RNA virus z rodu Hepatovirus a rodiny pikornavirů.
Je rezistentní vůči teplu, kyselinám a éteru. K inaktivaci je třeba 1 min vaření, desinfekce formaldehydem nebo chlórem a UV záření. Virion obsahuje čtyři polypeptidové kapsidy (VP 1-4), které vznikají posttranslačním štěpením proteinu (kódován genem o 7500 nukleotidů). I přes přítomnost až 20 % variability genomu a rozeznávání čtyř různých genotypů, jde o jediný sérotyp.
Replikace je omezena na játra, ale během pozdní inkubační a akutní preikterické fáze je virus přítomen i ve žluči, stolici a krvi. Přes perzistenci viru v játrech se po objevení ikteru snižuje vylučování viru stolicí, virémie i infekčnost. U hepatitidy A je HAV antigen přítomen v cytoplazmě.
Diagnostika – protilátky anti HAV:
- IgM – v séru detekovatelné v průběhu akutního onemocnění (zvýšení aminotransferáz a fekální vylučování HAV), přetrvávají po dobu několika měsíců, zřídka 6 – 12 měsíců.
- IgG – v rekonvalescenci, přetrvávají na neurčito a jsou protektivní (pacienti jsou poté imunní vůči reinfekci).
Komplikace
- elevace transamináz někdy přetrvává několik týdnů, výjimečně až jeden rok.
- u malé části pacientů s akutní hepatitidou A dochází několik týdnů až měsíců po počátečním zlepšení stavu k recidivě onemocnění.
- neobvyklou variantou je cholestatická forma hepatitidy A, která se vyznačuje cholestatickým typem ikteru a pruritem.
- fulminantní průběh je u hepatitidy A vzácný, zejména u starších pacientů s chronickým postižením jater.
- přes výskyt těchto komplikací nepřestupuje hepatitida A nikdy do chronického stádia.
Prognóza – všichni pacienti s akutní hepatitidou A se uzdraví bez následků.
Prevence – k dispozici jsou jak preparáty pro pasivní, tak pro aktivní imunizaci.
Pasivní imunizace – vhodná před expozicí nebo časně po expozici HAV. Pro postexpoziční profylaxi (po expozici intimní – domácnost, sex) se používá 0,02 ml/kg podaných tak brzo po expozici, jak je to možné (prospěšné může být ale i až po 2 týdnech). Podstoupit pasivní imunizaci se rovněž doporučuje cestovatelům do rozvojových zemí a endemických oblastí, k vykrytí doby než začne být účinná aktivní imunizace. Při cestě trvající < 3 měsíce je vhodné podat dávku 0,02 ml/kg, pro delší cesty 0,06 ml/kg každé 4 – 6 měsíců. Imunizace není nutná u neintimních kontaktů (kancelář, škola, nemocnice) a u lidí, kteří jsou anti-HAV pozitivní.Podání imunoglobulinů je bezpečné – všechny přípravky musí být derivovány z inaktivního virů a nesmí v nich být přítomna virová RNA (konfirmace PCR).
Aktivní imunizace – užívají se formaldehydem inaktivované vakcíny vyrobené z kmenů HAV oslabené v tkáňových kulturách. Jsou vhodné od jednoho roku života a začínají být protektivní již za 4 týdny od podání a ochrana by měla trvat minimálně 20 let.
Kromě rizikových skupin (viz výše) by měli podstoupit vakcinaci i pacienti s chronickou hepatitidou B a C (riziko rozvoje fulminantní hepatitidy při superinfekci HAV). Z toho důvodu by měli být přeočkování i rizikové skupiny pro hepatitidy B a C – homosexuální muži, narkomani, osoby s poruchami srážlivosti (vyžadující časté podávání koagulačních faktorů) apod. U nás je registrována vakcína HAVRIX a dále je k dispozici i vakcína TWINRIX proti HAV i HBV.
Hepatitida B
Epidemiologie – celkově je na světě ˃ 250 – 290 miliónů lidí HBsAg pozitivních, incidence díky očkování klesá, dle poslední plošné studie v ČR byla 0,56 % (2021), menší studie prováděná ve dvou krajích v roce 2013 prokázala prevalenci 0,064 %. Incidence ve vyspělých zemích je 0,1 – 0,5 % (USA, západní Evropa), ale až 5 – 10 % na Dálném Východě a v subsaharské Africe. Riziko stoupá s rostoucím věkem a snižující se socioekonomickou úrovní. Věk infikovaných záleží i na regionu
- Dálný Východ, Afrika – nemoc novorozenců a malých dětí (cyklus udržován matkou a neonatálním šířením), nemoc vetšinou přejde do chronicity.
- Severní Amerika, Západní Evropa – nemoc mladých dospělých (souvisí s prvním sexuálním kontaktem, event. nástupem do rizikové práce). Tyto závislosti jsou ovšem ovlivňovány migrací. Zavedení očkovací politiky včetně vakcíny proti hepatitidě B v roce 1980 vedlo k 90 % poklesu četnosti nových infekcí HBV.
Nejohroženější jsou pacienti s Downovým syndromem, lepromatózní formou lepry, leukémií, Hodginovou chorobou, polyarteritis nodosa, pacienti s chronickým selháním ledvin na hemodialýze, i.v. narkomani, partneři akutně infikovaných pacientů, promiskuitní osoby (zejména homosexuální muži), zdravotníci, osoby, které vyžadují opakované transfuze krve event. jiné krevní deriváty (hemofilici), obyvatelé institucí pro mentálně postižené, vězni a v menším rozsahu i rodinní příslušníci chronicky infikovaných osob. Od 70. let 20. století se dělá screening na HBsAg u dárců krve. Vzhledem k přísným virologickým kontrolám je v současnosti riziko nákazy při transfuzi cca 1 : 300000).
Přenos – dominuje parenterální přenos. HBsAg byl zjištěn téměř v každé tělní tekutině infikovaných osob. Při parenterální expozici pokusným zvířatům bylo jako nejvíce infekční zjištěno sérum, poté sliny a sperma. Vysoce nebezpečný je vaginální i anální sexuální styk. Přes výskyt ve slinách se perorální přenos nevyskytuje.
V rozvojových zemích je častý perinatální přenos (Dálný Východ), navíc těsný kontakt mezi batolaty je považován za hlavní faktor v udržování vysoké četnosti HBV infekce v populaci (subsaharská Afrika). Ve vyspělých zemích (Severní Amerika, západní Evropa) je perinatální přenos vzácný. Při perinatálním přenosu je 10 % infekcí získáno v děloze, zbytek během porodu. Riziko infekce novorozence stoupá s infekciozitou (HBeAg pozitivita) matky. K přenosu na novorozence dochází u 90 % HBeAg pozitivních, ale jen u 10 – 15 % HBeAg negativních matek. Ve většině případů je infekce novorozence klinicky asymptomatická, ale cca 90 % zůstane infikovaných chronicky.
Etiologie – HBV je DNA virus s kompaktní genomovou strukturou, z rodiny živočišných virů hepadnavirů (hepatotropní DNA viry) a je klasifikován jako hepadnavirus 1. Podobné viry infikují některé druhy svišťů, veverek a Pekingských kachen. HBV DNA (3200 bp) kóduje čtyři sady virových produktů s komplexní strukturou, které jsou kódovány čtyřmi překrývajícími se geny – S, C, P a X, které proto mohou kódovat větší množství různých proteinů.
Druhy HBV částic:
- Nejčastější jsou částice 22 nm veliké, které jsou přítomny ve sférické formě nebo jako dlouhá filamenta (tyto jsou antigenně shodné s HBsAg a předpokládá se, že jde o jeho nadbytečně syntetizovanou formu). Koncentrace HBsAg může v séru dosáhnout až 0,5g/l a množství virových partikulí až 1015/l.
- 42 nm partikule s dvouvrstvým obalem, kterých je 100 – 1000 x méně než předchozích forem (jde o intaktní HBV virion). Kompletní 42 nm virion obsahuje i 27 nm nukleokapsidové jádro, jehož proteiny jsou kódovány proteinem C. Antigen, který je exprimován na povrchu nukleokapsidového jádra se nazývá HBcAg a protilátka proti němu se nazývá anti-HBc. HBeAg je rozpustný, nukleokapsidový protein, který je také produktem stejného genu C (je ale imunologicky odlišný proti HBcAg). Gen P je největší z HBV genů a kóduje DNA polymerázu i reverzní transkriptázu.
Byla identifikována řada izoforem HBsAg – všechny mají společný jeden reaktivní antigen a, mimo to existují ještě izoformově specifické antigeny (d, y, w, r-). Existuje osm podtypů a osm genotypů hepatitidy B (A-H), které se liší zejména geograficky – A (a,d,w) a D (a,y,w) v USA, B (a,d,w) a C (a,d,r) v Asii. Klinický průběh je většinou stejný, ale zdá se, že u genotypu A pacienti dosahují snadněji sérokonverze HBsAg (jak spontánní, tak jako odpověď na antivirovou terapii), genotyp B je spojen s mírnějším průběhem a nižším rizikem hepatocelulárního karcinomu, u genotypu C je riziko vyšší než u předchozího. Před genem S jsou umístěny pre-S geny, které kódují pre-S genové produkty, včetně receptorů na povrchu HBV pro lidský sérový albumin a membránové proteiny hepatocytů. Pre-S oblast se rozděluje na pre-S1 a pre-S2. V závislosti na místě zahájení translace vznikají tři potenciální produkty genu pro HBsAg: S gen – HBsAg (major protein), S oblast + přilehlé oblasti pre-S2 – middle protein, S oblast + pre-S1 + preS2 – large protein. Kompletní 42 nm jsou ve srovnání s menšími kulovitými nebo filamentózními partikulemi obohaceny o large proteiny. V průběhu infekce HBV mohou být detekovatelné protilátky proti pre-S proteinům a doba pre-S antigenémie se shoduje s dobou replikace viru.Gen C má dva iniciační kodony: precore region a core region. Jestliže translace začíná v precore region, vzniká HBeAg, který má signální peptid, který se váže na hladké endoplazmatické retikulum a poté je HBeAg vylučován do krevního oběhu. Jestliže translace začíná v core region, vzniká HBcAg, který nemá signální peptid, není vylučován, ale shromažďuje se v nukleokapsidovém jádru, kde váže a inkorporuje RNA, a které v konečném důsledku obsahuje i HBV DNA. V nukleokapsidovém jádře se nachází i DNA polymeráza, která zajišťuje replikaci a opravy DNA. Po kompletizaci virových proteinů se zastavuje syntéza nekompletního plus vlákna, což je zodpovědné za různě velké jednovláknové úseky DNA. HBcAg zůstává v hepatocytech, kde je snadno detekovatelné imunohistochemickým barvením a je exportován až po enkapsidaci DNA do obalu s HBsAg. Produkovaný protein nukleokapsidy, HBeAg je spolehlivý marker replikace a relativní infekčnosti. Gen X kóduje malý, nonpartikulární protein HBxAg, který je schopen transaktivace transkripce virového i buněčného genu. Toto je dosaženo uvolněním kalciových iontů (pravděpodobně z mitochondrií), které aktivuje signální cesty, která vede ke stimulaci reverzní transkripce a replikace HBV DNA. Proto exprese HBxAg a anti-HBx je spojena s těžkou chronickou hepatitidou a vysokým rizikem hepatocelulárního karcinomu. Tato transaktivace může zvýšit i replikaci jiných virů (např. HIV). Zapojení genů pro lidský interferon a pro MHC I. třídy vysvětluje větší citlivost infikovaných HBV hepatocytů k cytotoxickým T buňkám a vyšší indukci apoptózy.
HBsAg pozitivita v séru, spolu s pozitivitou HBeAg ukazuje na vysoce infekční stav, spolu s přítomností virionů HBV a detekovatelnou HBV DNA, při negativitě HBeAg a přítomnosti anti-HBe je stav mnohem méně nakažlivý. Např. HBeAg pozitivní matky nakazí ve ˃ 90 % peripartálně své potomky, zatímco při HBsAg a anti-HBe pozitivitě jen v 10 – 15 %. HBeAg se objevuje časně v průběhu akutní hepatitidy, jeho vymizení může být předzvěstí zlepšení stavu. Perzistence HBeAg v séru po 3 měsících terapie má prediktivní význam v rozvoji chronické infekce, dlouhodobé přetrvávání je spojeno s probíhající replikací viru, infekčností a zánětlivým poškození jater.
Patogeneze – lze říct, že za poškození jater může zejména imunitní reakce a nikoliv pouze virus hepatitidy B (cytotoxické T lymfocyty specificky rozpoznávají antigeny HBV na povrchu infikovaného hepatocytu, zejména HBcAg a HBsAg a následně je likvidují. Předtím se ještě zapojují nespecifické složky imunity – při akutní hepatitidě B dochází k odstranění více než 90 % HBV DNA ještě před maximální infiltrací jater T – lymfocyty a nástupem biochemických a klinických příznaků).Na druhou stranu, pouze imunitní systém může eliminovat virus, při imunosupresi infekce téměř vždy přechází do chronicity.
Přirozené fáze hepatitidy B – akutní hepatitida bývá benigní a končí ve většině případů spontánním uzdravením, nicméně v 0,1 – 1 % přechází do chronicity (zejména u imunosuprimovaných pacientů a dětí), která je definována jako infekce probíhající > 6 měsíců. Má typicky několik fází:
I. HBeAg pozitivní chronická HBV infekce – tato fáze je nejčastější při infekci získané během narození od matky (časté na dálném Východě). Dochází k v výrazné replikaci viru, vysoké pozitivitě HBV DNA, ale na druhou stranu normální aktivitou ALT a nízkou zánětlivou aktivitou v jaterní biopsii, ale již i v této fázi probíhají určité procesy karcinogeneze. Pacienti jsou vysoce infekční a téměř nikdy nedochází k sérokonverzi (HBeAg/antiHBe).
II. HBeAg pozitivní chronická hepatitida B – vyvíjí se po několika letech trvání fáze I (častější popř. vzniká rychleji při infekci získané v dospělosti. Pacienti jsou HBeAg pozitivní, mají vysokou virémii s vysokou hladinou HVB DNA a mají již zvýšené ALT s průkazem zánětlivě nekrotických změn v játrech. Většina pacientů projde následně serokonverzí HBeAg/antiHBe a přejde do HBeAG negativní infekce.
Histologický nález u chronické hepatitidy – velké hepatocyty s cytoplazmou matného skla (ground – glass), obsahující HBsAg. HBsAg je lokalizován v cytoplazmě a na plazmatické membráně infikovaných buněk. HBcAg je přítomen dominantně v jádře, ale může se příležitostně vyskytnout také v cytoplazmě nebo plazmatické membráně.
III. HBeAg negativní chronická HBV infekce – pacienti jsou HBsAg pozitivní, HBeAG negativní a antiHBe pozitivní (došlo u nich k sérokonverzi), hladina HBV DNA je nízká nebo nedetekovatelná (došlo ke snížení nebo zastavení replikace viru). Riziko vzniku cirhózy nebo karcinomu je velice nízké. Vývoj může být různý, pacienti mohou progredovat do chronické hepatitidy B nebo může dojít ke ztrátě HBsAg a/nebo sérokonverzi (HBsAg/antiHBs).
IV. HBeAg negativní chronická hepatitida B – může navazovat na fázi II, pacienti jsou HBsAg pozitivní, HBeAg negativní a antiHBe pozitivní se perzistující středně až výrazně zvýšenou hladinou HBV DNA a zvýšenou aktivitou ALT. HBeAg negativita je dána většinou mutací (HBeAg minus varianta) a nic neříká u úrovni replikace. V této fázi je spontánní remise vzácná.
V. HBsAg negativní fáze – po ztrátě HBsAg může nízká replikace přetrvávat. HBsAg je negativní, protilátky antiHBc jsou pozitivní, anti-HBs mohou, ale nemusí být detekovatelné, HBV DNA bývá nízká nebo častěji nedetekovatelná (histologicky v játrech je ale většinou pozitivní). Riziko vzniku cirhózy z tohoto stádia je nízké, pokud ale již k cirhóze došlo, je nutná celoživotní surveillance (sono jater á 6 měsíců).
- glomerulonefritida s nefrotickým syndromem – v glomerulární bazální membráně lze nalézt depozita HBsAg, imunoglobulinu a C3 složky komplementu.
- polyarteritis nodosa ˂ 1 % pacientů s chronickou hepatitidou B, ale 20 – 30 % pacientů s PAN jsou HBsAg pozitivní. Cévy malého a středního kalibru obsahují depozita HBsAg, imunoglobulinu a C3 složky komplementu.
- esenciální smíšená kryoglobulinémie – artritida + vaskulitida (palpovatelná purpura) + cirkulující kryoglobuliny více imunoglobulinových tříd v séru + někdy glomerulonefritida.
Klinický obraz – viz výše, v prodromálním stádiu akutní hepatitidy B může být přítomna artritida, exantém, angioedém, vzácně hematurie a proteinurie (5 – 10 % pacientů). Toto se vyskytuje ještě před nástupem ikteru a pacienti jsou často chybně odesíláni k revmatologovi. Už v tomto stádiu bývá přítomna pozitivita HBsAg a elevace ALT a AST. U dětí se může hepatitida B manifestovat jako Gianotti – Crostiho syndrom – anikterická forma s nesvědícím papulárním exantémem v obličeji, hýždích a končetinách spolu s lymfadenopatií.
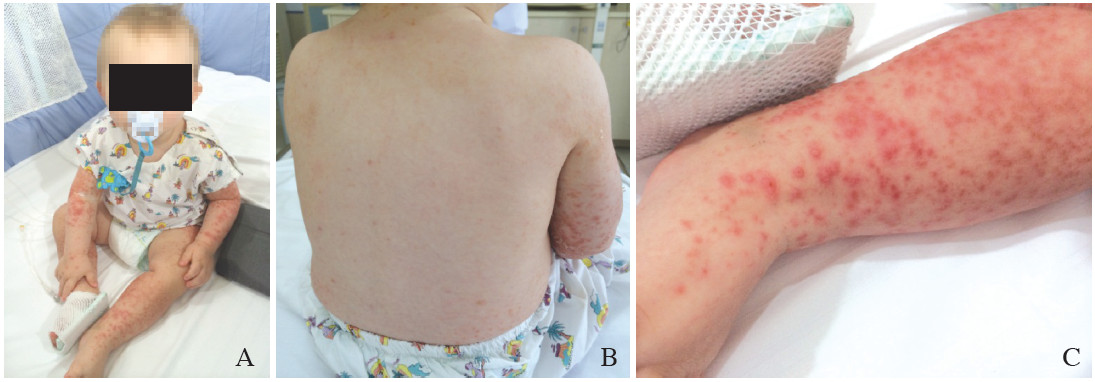
Za mimojaterní manifestaci HBV jsou patogeneticky zodpovědné imunokomplexy. Nespecifické chřipkové prodromální příznaky jsou spojeny s ukládáním imunokomplexů HBsAg-antiHBs do stěny krevních cév, což vede k aktivaci a poklesu sérové hladiny komplementu. Orgánová manifestace u pacientů s chronickou HBV:

Diagnostika
- HBsAg – pozitivní za 2 – 3 měsíce (rozmezí 1 – 12 týdnů), mizí za 1 – 2 měsíce po nástupu ikteru a zřídka trvá déle než 6 měsíců.
- anti-HBs – objevují se po vymizení HBsAg, zůstávají detekovatelné po neurčito dlouhou dobu poté, mají protektivní účinek, z toho důvodu je zjištění míry ochrany proti HBV infekci založeno na stanovení titru anti-HBs protilátek.
- zvýšení ALT, AST – za 2 – 6 týdnů po objevení HBsAg, je detekovatelné během celého ikterického a symptomatického období hepatitidy B.
- HBcAg – intracelulárně uložený, jelikož neobalené nukleokapsidy necirkulují volně v séru, není HBcAg v séru detekovatelný.
- anti-HBc – za 1 – 2 týdny po objevení HBsAg a předchází anti-HBs o týdny až měsíce.
- HBeAg – krátce po HBsAg (pokud nejde o e-minus mutantu). Signalizuje vysokou úroveň virové replikace, přítomnost cirkulujících intaktních virionů a detekovatelnou HBV DNA. Při spontánně odeznívající HBV infekci přestává být HBeAg detekovatelný v séru krátce po dosažení peaku sérových aminotransferáz.
- anti-HBe – znamenají výrazné snížení infekciozity.
Jelikož existuje určitá variabilita, může se příležitostně objevit „diagnostické okno“, tzn. vymizí HBsAg, ale ještě nejsou v séru detekovatelné anti-HBs. Toto okno může trvat několik týdnů a jediným důkazem současné nebo nedávno prodělané infekce je přítomnost protilátek anti-HBc.
U chronické infekce HBV zůstává HBsAg pozitivní déle než 6 měsíců, anti-HBc je především třídy IgG a anti-HBs je buď nezjistitelné, nebo je jen ve velice nízkém titru (ne neutralizační).
Atypické stavy:
I. U některých osob, které prodělaly HBV infekci již dávno, může vymizet anti-HBs dříve než anti-HBc, proto tento stav
- Nemusí znamenat aktivní replikaci viru ale jen stav po dávné infekci HBV.
- Velice vzácně může znamenat low-level akutní hepatitidu s HBsAg pod hranicí citlivosti laboratorní metody. V tomto může být nápomocno rozlišení třídy anti-HBc: IgM anti-HbC převládají během prvních šesti měsíců po akutní infekci, IgG anti-HBc převládají v pozdější době.
- Znamená ojediněle zkříženou reakci neboli falešnou pozitivitu.
II. U pacientů s akutní hepatitidou je zřídka (1 – 5 %) hladina HBsAg pod rozlišovací schopností metody. V tomto případě postačuje ke stanovení diagnózy akutní hepatitidy B pozitivita IgM anti-HBc. Podobně může být u low level chronické hepatitidy B přítomna pouze izolovaná elevace IgG anti-HBc.
Obecně platí, že u osob, které se zotavily z hepatitidy B, trvale přetrvává anti-HBs a anti-HBc.
III. Občas má 10 – 20 % pacientů s chronickou hepatitidou B v séru zjistitelný nízký titr nizkoafinních anti-HBs protilátek, které jsou zaměřeny proti jinému podtypu determinant než u pacientů s klasickou HBsAg pozitivitou a nemají klinický význam. Tito pacienti s HBsAg pozitivitou a přítomností ne neutralizačních anti-HBs jsou považováni za nositele chronické hepatitidy B.
Během časné fáze chronické infekce může být pozitivní HBV DNA, jak v séru, tak v jádrech hepatocytů, kde je přítomna ve volné i epizomální formě. Tato replikační fáze je charakterizována maximální infekčností i poškozením jater, kdy HBeAg je kvalitativním a HBV DNA kvantitativním ukazatelem replikace a v séru se vyskytuji všechny tři formy virionů. Během doby (u 10 % pacientů ročně) přechází do nereplikační fáze a dochází k sérokonverzi HBeAg pozitivity na anti-HBe pozitivitu. Ve většině případů je tato sérokonverze spojena s přechodným zvýšením transamináz (imituje akutní hepatitidu), která je způsobena zvýšenou, buněčně zprostředkovanou, likvidací virem infikovaných hepatocytů. V nereplikační fázi chronické infekce, kdy je HBV DNA prokazatelná jen v jádrech hepatocytů, je tendence k její integraci do genomu hostitele. V této fázi jsou přítomny v séru jen 22 nm a 27 nm partikule, nikoliv intaktní viriony a dochází k ústupu jaterního postižení. Tito pacienti jsou označování jako nosiči inaktivního HBV. Označení „nereplikační fáze“ je zavádějící, protože i zde může být prokazatelná virová replikace v řádu 103 virionů (vysoce citlivými metodami, např. PCR), ale poškození jater a infekčnost je zanedbatelná. Toto je klinicky a patofyziologicky velmi významné, protože občas může docházet k exacerbaci replikační fáze s opětovnou pozitivitou HBeAg a HBV DNA, někdy i IgM anti-HBc a bohužel i poškozením jater. Vzhledem k tomu, že dochází k pozitivitě i IgM anti-HBc, nelze pouze na základě této pozitivity rozlišit akutní, de novo vzniklou, nebo chronickou, exacerbovanou, infekci HBV (respektive toto nemusí být spolehlivé). V tomto případě je neocenitelná detailní anamnéza.
Typické laboratorní nálezy u divokého typu chronické hepatitidy B – HBeAg a HBV DNA jsou detekovatelné během replikační fáze chronické infekce, která je spojena s infekcí a poškozením jater. Sérokonverze z replikační fáze na fázi nereplikační se objevuje s četnosti 10 % za rok a může začínat přechodným zvýšením ALT (podobné akutní hepatitidě). Během ní klesá infekčnost a poškození jater. Při HBeAg minus chronické hepatitidě (mutace v precore oblasti HBV genomu) chybí při replikační fázi HBeAg.
K diagnóze postačuje zjištění HBsAg v séru, při hladině pod rozlišovací hladinou těchto metod postačuje k diagnostice anti-HBc IgM. Velikost titru nekoreluje se závažností onemocnění, naopak je nejvyšší u imunosuprimovaných pacientů, nižší u pacientů s chronickou hepatopatií a nejnižší u akutních fulminantních hepatitid. To je důkazem, že stupeň poškození jaterních buněk a klinický průběh souvisí spíš se změnou aktivity imunitního systému než celkovým množstvím cirkulujícího HBsAg.
U pacientů, kteří mají neznámou délku infekce (náhodné zjištění HBsAg pozitivity u dárců krve) může pomoci v rozhodování o délce infekce přítomnost IgM anti-HBc (nedávná choroba) nebo IgG anti-HBc (choroba trvající delší dobu). Izolovaná pozitivita IgG anti-HBc může také znamenat prodělanou infekci v dávné minulosti.
Anti-HBs je při HBsAg pozitivitě pacienta jen vzácně detekovatelná, nicméně 10 – 20 % pacientů s chronickou HBV infekcí může mít nízký titr protilátek anti-HBs, které nejsou namířeny proti společné determinantě, ale proti heterotypickému subtypu determinanty (např. proti y). Toto ve většině případu není známkou infekce dvěma různými HBV subtypy a přítomnost těchto protilátek není předzvěstí hrozící opětovné HBsAg pozitivity (nemá klinický význam). Objevení se anti-HBs je známkou efektivity očkování.
HBV DNA a HBeAg jsou markery replikace, přičemž HBV DNA je mnohem citlivější. Zdá se, že existuje korelace mezi replikací viru (HBV DNA v séru) a stupněm poškození jater. U chronické hepatitidy B je při vysokém titru HBV DNA vyšší riziko jaterního selhání, cirhózy a hepatocelulárního karcinomu.
Komplikace
- hepatitida B představuje ˃ 50 % fulminantních průběhů virové hepatitidy, zejména pokud je spojena s infekcí HDV
- přechod do chronické hepatitidy se všemi důsledky a riziky.
- vysoké riziko vzniku hepatocelulárního karcinomu, zejména u pacientů se vznikem cirhózy.
Terapie – hlavními cíli terapie je navození dlouhodobé suprese hladiny HBV DNA, dosažení sérokonverze HBeAg/anti-HBe, normalizace ALT (biochemická odpověď), ideálně sérokonverze HBsAg/anti-HBs.
K zahájení terapie jsou indikováni:
- 1. Všichni pacienti s hepatitidou B bez (bez ohledu na pozitivitu HBeAg), kteří mají hladinu HBV DNA > 2000 IU/ml, ALT nad horní hranici normy a/nebo minimálně středně významný zánětlivě-nekrotický proces při biopsii.
- 2. Pacienti s cirhózou a jakoukoliv hladinou HBV DNA v séru.
- 3. S HBV DNA > 20000 IU/ml a ALT > 2x horní limit normy, tedy není třeba biopsie.
- 4. … při rodinném výskytu cirhózy karcinomu jater nebo extrahepatální manifestace nemusí být splněna kritéria.
…ostatní pacienty je třeba monitorovat (ALT á 3 měsíce, HV DNA á 6 – 12 měsíců). V současnosti jsou k dispozici dvě strategie terapie:
- pegylovaný interferon alfa (PEG-IFN) – nevýhodou je nepříznivý bezpečnostní profil.
- nukleotidovými analogy (NA):
- lamivudin (LAM)
- adefovir dipivoxil (ADV)
- entecavir (ETV)
- tenofovir disoproxil fumarát (TDF)
- tenofovir alafenamid (TAF) – v ČR nedostupné
- telbivudin (TBV) – v ČR nedostupné
Optimální (v případě pacientů s dekompenzovanou jaterní cirhózou, po transplantaci jater, s extrahepatální manifestací nebo závažnou exacerbací jedinou) možností je terapie NU s vysokou genetickou bariérou pro vznik rezistence je ETV, TDF a TAF, tedy entacavir a tenofovir. Všechny pacienty je nutné pravidelně sledovat. Po vymizení HBsAg a sérokonverzi HBsAg/anti-HBs je možné léčbu ukončit. Při vzniku mutant HBV je nutné postupovat individuálně dle vzniklé mutace.
Detaily již přesahují rozsah tohoto sdělení a jsou dostupné online zde: https://www.ces-hep.cz/file/580/doporuceny-postup-chs-hbv-2017.pdf
Profylaxe – očkování je vhodné u:
- Očkování proti HBV je součástí povinného očkování hexavakcínou – záškrt, tetanus, černý kašel, dětská obrna, virová hepatitida B, haemophilus influenzae b. 1. dávka ve 2 měsících, 2. dávka ve 4 měsících, 3. dávka v 1 roce.
- dětí HBsAg pozitivních matek (zahájení do 24 hodin od porodu), zde je vhodná i pasivní imunizace (12 – 24 hodin po porodu).
- pacientů na hemodialýze.
- zdravotníku a jedinců s profesionálně daným zvýšeným rizikem infekce
- Postexpozičně (po poranění jehlou, po pohlavním styku s HBsAg pozitivním jedincem), co nejdříve, optimálně do 7 dnů.
- jedinců žijících s HBsAg pozitivním jedincem v jedné domácnosti.
- osob s rizikovým sexuálním chováním, i.v. narkomanů.
Hepatitida D
Epidemiologie – hepatitida D je široce rozšířena po světě a zvyšuje se s endemickým výskytem hepatitidy B:
- Okolí Středozemního moře (jižní Evropa, severní Afrika, Blízký Východ). Přenos je zde zejména sexuálním kontaktem.
- V neendemických oblastech (USA, severní Evropa) je přenos nejčastěji krví (zejména i.v. narkomani) a krevními produkty. Toto vše je ovlivňováno migrací obyvatelstva, která je příležitostně zodpovědná za vypuknutí ohniskových infekcí těžké hepatitidy (např. odlehlé vesnice Jižní Ameriky, ale i městská centra USA).
Od konce 90. let prevalence HDV infekce postupně klesá. V USA je 0,11 % (dle NHANES 2011 – 2016), výrazně vyšší je u hemofiliků a i.v. narkomanů. V České republice je obecně velice nízká.
Etiologie – HDV je defektní, 35 – 37 nm RNA virus, je jediným členem rodu Deltavirus. Koinfikuje a potřebuje při replikaci a expresi pomocnou funkci HBV (nebo jiného hepadnaviru). Delta jádro je obaleno vnějším obalem z HBsAg, který není odlišný od jiné HBsAg. Jediným známým proteinem, který HDV produkuje je HDAg. HDAg se váže přímo na RNA polymerázu II a tímto přímo stimuluje transkripci.
Genomem je malé (1700 nukleotidů), jednovláknové, cirkulární vlákno RNA, které není homologní s HBV DNA (mimo malých oblastí genů pro polymerázu) a má typ replikace shodný spíše s rostlinnými viroidy. HDV RNA obsahuje mnoho oblastí interní komplementarity, proto se může sklopit a párovat sama se sebou a tímto tvořit neobvyklé, velice stabilní podlouhlé struktury, které obsahují velmi stabilní ribozymy, které mohou štěpit sami sebe. Pro svoji replikaci potřebuje HDV hostitelskou RNA polymerázu II (via RNA řízenou RNA syntézu, transkripcí genomické RNA do komplementární (plus vlákno), antigenomické RNA). Antigenomická RNA naopak slouží jako vzor pro následnou genomovou RNA syntézu. HDAg existuje ve dvou formách: 1. malé – 195 aminokyselin, které hraje roli v replikaci HDV RNA, 2. velké – 214 aminokyselin, suprimuje replikaci a je důležité v internalizaci antigenů do virionu. Přestože je ke kompletizaci HDV virionů a způsobení poškození jater potřeba HBV, k intracelulární replikaci HDV RNA může docházet bez asistence HBV. Byla také zjištěna genomová heterogenita HDV RNA, což ale nemá žádný patofyziologický ani klinický význam – 7 genotypů, nejčastější je genotyp 1.
Patologie – u hepatitidy D se někdy objevuje mikrokapénková steatóza, HDAg je přítomen v jádře infikovaných hepatocytů.
Klinický obraz – HDV může pacienta s HBV koinfikovat nebo superinfikovat osobu s již přítomnou infekcí HBV. Vzhledem k potřebě HBV je doba infekce HDV limitována na trvání infekce HBV. Při chronické hepatitidě B se může HDV replikovat neomezeně dlouho a hepatitida D se také může stát chronickou. V takovém případě se superinfekce HDV může jevit jako akutní exacerbace hepatitidy s klinickým zhoršením stavu – situace je v tomto případě horší.
Diagnostika
- anti-HDV – objevují se během akutní HDV infekce a po 30 – 40 dnech od objevení symptomů. Při sérokonverzi HBsAg a negativitě HDAg jsou anti-HDV jen zřídka detekovatelné a to jen v nízkém titru. Během chronické infekce jsou přítomné anti-HDV ve vysokém titru a to jak v třídě IgG, tak IgM.
- HDVAg je přítomen v jádrech hepatocytů, nicméně jej lze příležitostně nalézt i v séru.
- HDV RNA v séru jsou detekovatelné během replikace viru a jsou výrazem infekčnosti.
U pacienta s akutní hepatitidou a pozitivitou HBsAg a anti-HDV v séru lze rozhodnout o vztahu HBV a HDV dle druhu anti-HBc protilátek: přítomnost IgM anti-HBc je spolehlivým důkazem nedávné infekce a její absence spolehlivým ukazatelem infekce v dávné minulosti.
Při konfekci HBV a HDV bude pozitivita třídy IgM, zatímco při superinfekci akutní HDV na chronickou HBV bude přítomna třída IgG.
Komplikace – přestože akutní hepatitida D nezvyšuje pravděpodobnost přechodu hepatitidy B do chronicity, její nasednutí na chronickou hepatitidu B zhoršuje klinický průběh hepatitidy B. Má potenciál proměnit neaktivní nebo jen mírnou chronickou hepatitidu B do těžké chronické hepatitidy s progresí do cirhózy nebo přímo způsobit její fulminantní průběh.
Dále je u chronické hepatitidy D zvýšené riziko přechodu do cirhózy (roční riziko 4 %) a do hepatocelulárního karcinomu (roční riziko 2,8 %). I přes výše uvedené může u některých pacientů probíhat chronická hepatitida D indolentně nebo asymptomaticky.
Terapie – v případě mírně a středně závažně probíhající akutní hepatitidy není zahájení antivirové terapie u imunokompetentních pacientů indikováno (99 % se vyhojí spontánně). U těžce probíhajících akutních hepatitid se většina autorů nebrání použití antivirotik typu nukleosidových analog.
CAVE Je nutné se vyhnout použití glukokortikoidů, protože zvyšují riziko přechodu chronické fáze.
Prognóza – pacienti s koinfekcí hepatitidou B a D nemusí mít horší prognózu než pacienti se samotnou hepatitidou B. Dle posledních studií u prováděných i.v. narkomanů ale dosahovala mortalita až 5 %.
Pacienti se superinfekcí hepatitidy D na hepatitidu B mají zvýšenou mortalitu než pacienti se samotnou hepatitidou B, kdy byla v některých případech zaznamenána až 20 %.
Prevence – jedinou prevencí je očkování proti hepatitidě B. V současnosti neexistuje žádný očkovací přípravek proti hepatitidě D.
Hepatitida C
Epidemiologie – celkově je na světě infikováno 71 miliónů lidí. Dle studie z roku 2015 byla anti-HCV pozitivita prokázána u 1,67 %, HCV RNA pozitivita v séru u 0,93 % vyšetřených osob. Za reálnou se považuje prevalence HCV RNA cca 0,4 – 0,5 %.
Geografická distribuce hepatitidy C dle genotypu:
- USA – 70 % genotyp 1 (u černochů cca. 90 %), 30 % genotyp 2 a 3
- Egypt – genotyp 4
- Jižní Afrika – genotyp 5
- Hong Kong – genotyp 6
Přenos hepatitidy C – dominuje přenos parenterální – do roku 1992 zejména přenos krevními deriváty, od roku 1992 (zahájení rutinního testování dárců krve) i.v. aplikace drog, dále perinatální přenos (z HCV pozitivní matky na novorozence), tetování a piercing neprováděné za aseptických podmínek (zejména amatérsky), hemodialýza, sexuální přenos (častější mezi muži, kteří mají styk s muži a při HCV/HIV), před rokem 1992 přenos při transplantaci přenosem orgánů.
Etiologie – HCV je RNA virus (lineární, jednovláknové, 9600 nukleotidů). Je jediným zástupcem rodu Hepacivirus z rodiny Flavivirů.
Genom HCV obsahuje jediný gen, který kóduje virový polyprotein o velikosti 3000 aminokyselin, který je po translaci štěpen na 10 virových proteinů. 5´konec genomu je složen z netranslatovatelných oblastí (obsahují vstupní místo pro ribozomy), které sousedí s geny pro čtyři strukturální proteiny: 1. protein nukleokapsidy jádra – C, 2. dva obalové glykoproteiny – E1 a E2, 3. membránový protein – p7. Netranslatovatelná oblast a gen pro protein C jsou stejné u všech izoforem, povrchové proteiny E1, E2 a p7 jsou kódovány hypervariabilní oblastí a jsou různé u různých izoforem (čímž se může vyhnout imunitnímu systému). 3 ‚konec genomu obsahuje také netranslatovatelné oblasti a navíc geny pro šest nestrukturální (NS) proteinů (NS2, NS3, NS4A, NS4B, NS5A, a NS5B). NS2 cysteinproteáza štěpí NS3 z NS2, NS3-4A serin proteáza štěpí všechny následující proteiny z polyproteinu. NS proteiny důležité pro replikaci viru jsou NS3 helikáza, NS3-NS4A serin proteáza a NS5B RNA-dependentní RNA polymerázu. Jelikož se HCV nereplikuje přes DNA meziprodukt, není třeba integrace do genomu hostitelské buňky.
Virová replikace je velice vysoká (1012 virionů/den). HCV vstupuje do buňky přes receptor CD81 (hepatálně nespecifický) a tight-junction protein claudin-1. HCV má podobné sekreční pochody jako LDL a VLDL lipoproteiny, za které se také maskuje, což vysvětluje jejich schopnost vyhnout se imunitnímu systému.
Zatím bylo u HCV identifikováno šest hlavních genotypů a více než 50 jejich subtypů. Jednotlivé genotypy se od sebe liší v nukleotidových sekvencích o cca 30 %. Jednotlivé intragenotypické subtypy se nazývají quasispecies a jsou odlišné v nukleotidových sekvencích jen o několik procent. Tato rozmanitost je dána vysokým mutagenním potenciálem HCV, který může interferovat s účinkem humorální imunity. Některé genotypy jsou celosvětově rozšířené, některé se vyskytují regionálně, podobně jsou i rozdíly v citlivosti k antivirotikům. Nebyly ale potvrzeny rozdíly v patogenitě mezi jednotlivými genotypy.
Patogeneze – za poškození hepatocytů je odpovědna buňkami zprostředkovaná imunitní reakce, která je namířena proti antigenům nukleokapsidy, obalu a nestrukturálních proteinů. Míra této reakce ale nekoreluje se závažností jaterního poškození. Přítomná HCV infekce T lymfocytů pravděpodobně snižuje imunitní odpověď. CD4+ buňky mají podpůrnou roli, svými cytokiny stimulují CD8+ cytotoxické buňky. Tato reakce je silnější u akutně probíhající infekce než u chronické hepatitidy.
Některé HLA alely bývají spojovány s limitovanou formou hepatitidy C (např. C/C haplotyp IK28B genu). HCV interferuje s nespecifickým typem imunity blokádou účinku interferonu typu 1, naopak rozvoj infekce omezují NK buňky. Jelikož existuje velká řada quasispecies, není specifická imunita tak účinná. Zkřížená reaktivita mezi virovými antigeny (HCV NS3 a NS5A) a hostitelovými autoantigeny (cytochrom P450 2D6) vysvětlují souvislost mezi pacienty infikovanými HCV a podskupinou pacientů s autoimunitní hepatitidou protilátkami anti-LKM.
Patologie – u hepatitidy C je přítomen relativní nedostatek zánětu, aktivace buněk sinusoid, lymfoidní agregáty, vyšší přítomnost tuku (zejména u genotypu 3 – souvisí s fibrotizací), léze žlučových cest s nakupením žlučových epiteliálních buněk bez porušení bazální membrány. HCV antigeny jsou přítomny v cytoplazmě.
Průběh choroby – cca 2/3 pacientů (55–85 %), kteří se infikují virem hepatitidy C, není schopno přirozeným způsobem virus eliminovat a přechází do chronického stadia, 5 – 20 % z nich dojde během 20–25 let k rozvoji jaterní cirhózy, u kterých je 1 – 2 % roční riziko vzniku hepatocelulárního karcinomu.
Riziko progrese jaterního poškození je zvýšené zejména při přenosu infekce ve vyšším věku (riziko narůstá po 40.–45. roce věku), konzumace alkoholu ≥ 50 g denně, obezita a jaterní steatóza z jakéhokoliv jiného důvodu (zejména při diabetu mellitu 2. typu), koinfekce HCV/HBV a koinfekce HCV/HIV, vyšší stupeň jaterního postižení nežli portální fibróza (METAVIR ≥ 2) v okamžiku stanovení diagnózy HCV infekce (pomocí některé metody neinvazivního určení stádia jaterní fibrózy).
Chronická HCV infekce je rovněž asociována s celou řadou extrahepatálních manifestací. Nejdůležitějším stavem z této skupiny je smíšená kryoglobulinémie a imunokomplexová glomerulonefritida, které jsou indikací k okamžitému zahájení terapie.
Diagnostika
- anti-HCV – protilátky jsou markerem expozice pacienta s viru hepatitidy C. Protilátky anti-HCV nemají neutralizační efekt a nejsou nositelem imunity organismu.
- HCV RNA – nejcitlivější test probíhající infekce (PCR), prokazují přítomnost virové RNA v séru. Velikost titru nekoreluje se závažností choroby nebo prognózou, ale lze jej používat ke stanovení citlivost na léčbu antivirotiky.
Klasifikace infekce
Akutní HCV infekce – diagnostikována velmi vzácně pro častou absenci klinických příznaků v akutním stadiu
HCV infekce. Spolehlivě lze stanovit diagnózu akutní HCV infekce pouze tehdy, je-li dokumentována nedávná
sérokonverze na anti-HCV reaktivitu. Příčinou je skutečnost, že neexistuje sérologický marker akutní infekce
HCV. O akutní HCV infekci lze také hovořit v případech, kdy jsou klinické příznaky v souladu s obrazem akutní
hepatitidy. Jde především o zvýšení ALT > 10x horní hranice normy, přítomnost ikteru, nejsou známky chronického jaterního onemocnění nebo jiné možné příčiny akutní hepatitidy a je pozitivita anti-HCV a HCV RNA, nicméně během akutní fáze infekce byla popsána krátká období negativity sérové HCV RNA. Jedno negativní vyšetření sérové HCV RNA tedy diagnózu HCV infekce nevylučuje a také nemusí znamenat v konkrétním případě spontánní eliminaci viru. Stanovení HCV RNA je třeba opakovat v odstupu 12 a 24 týdnů od vzniku podezření.
Většina pacientů s akutní HCV infekcí je asymptomatická, pravděpodobnost přechodu do chronicity je
vysoká (50–90 %). Ikterický průběh, ženské pohlaví, mladý věk a polymorfismy genu IL28B jsou faktory spojené se spontánní eliminací HCV.
Chronická HCV infekce – pozitivní průkaz sérové HCV RNA a anti-HCV protilátek v přítomnosti biochemických nebo histologických známek chronické hepatitidy (event. neinvazivního průkazu fibrózy jater).
Typické laboratorní nálezy u HCV během akutní hepatitidy C, která progreduje do chronicity. HCV RNA je detekovatelná jako první, poté se objevují elevace ALT a anti-HCV
.
Reinfekce – může se objevit po spontánní eliminaci HCV nebo úspěšné protivirové léčbě. Definována jako znovu
vzniklá pozitivita sérové HCV RNA u osoby s negativní sérovou HCV RNA ve 12. nebo 24. týdnu po ukončení protivirové terapie.
Terapie – protivirovými látkami jsou, sofosbuvir, ledipasvir, velpatasvir, voxilaprevir, dasabuvir, ombitasvir, paritaprevir, grazoprevir, elbasvir, glekaprevir, pibrentasvir.
Od roku 2018 už v terapii hepatitidy C nemají místo ani interferon, ani ribavirin, preferovány jsou režimy spočívající v kombinaci perorálně podávaných přímo působících virostatik, s preferencí pangenotypových režimů (režimy s vysokou účinností proti všem genotypům HCV).
- Sofosbuvir (SOF) – inhibuje virovou RNA dependentní RNA polymerázy. Není metabolizován cytochromem, proto je méně náchylný k interakcím než jiná virostatika (KI je současná terapie amiodaronem).
- Fixní kombinace SOF + ledipasvir (LDV) – LDV je v nezměněné podobě vylučován žlučí, ledvinami je vyloučeno pouze 1 % celkového množství. Současné podání amiodaronu je striktně KI, nevhodné je podání spolu s rosuvastatinem, mezi rizikovou současnou medikaci lze zařadit digitalis, dabigatran, amlodipin, buprenorfin, carvedilol.
- Fixní kombinace sofosbuviru a velpatasviru (VEL) – VEL je inhibitorem lékového transportéru P-gp a BCRP a transportních molekul v bazolaterální membráně hepatocytu OATP1B1 a OATP1B3, dále je substrátem CYP2B6,
- CYP2C8 a CYP3A4 s pomalým metabolismem. Vylučuje se žlučí. Současné podání carbamazepinu, rifampicinu, fenobarbitalu, fenytoinu, amiodaronu a dabigatranu je KI.
- Fixní kombinace sofosbuviru, velpatasviru a voxilapreviru (VOX) – VOX je metabolizován pomocí CYP3A4 a je inhibitorem transportérů P-gp, BCRP, OATP1B1 a OATP1B3. Je vylučován do žluči, proto není tato kombinace doporučována u pacientů Child-Pugh B a C. Vzhledem k uvedenému je KI rosuvastatin, metotrexát, mitoxantron, imatinib, irinotecan, lapatinib, sulfasalazin, topotecan a dabigatran. Podobně jsou KI i induktory rifampicin, karbamazepin, fenobarbital a fenytoin. Dále není doporučena tato kombinace u že užívajících hormonální kontraceptiva obsahující ethinylestradiol, dále není doporučována u pacientů s HCV/HIV koinfekcí, kteří jsou léčení efavirenzem, etravirinem a nevirapinem a proteázovými inhibitory atazanavirem/ritonavirem a lopinavirem/ritonavirem.
- Fixní kombinace dasabuviru, ombitasviru, paritapreviru/ritonaviru (kombinace 3D) – dasabuvir (nenukleosiový NS5B inhibitor) je nenukleosidovým inhibitorem RdRp, produktu NS5B virového genomu. Není určen k podávání v monoterapii, striktně je třeba jej kombinovat s ostatními v této kombinaci. Dasabuvir je metabolizován systémem cytochromu, především pomocí CYP2C8 a CYP3A. Proto se při kombinaci dasabuviru s induktory těchto systémů očekává snížení jeho plazmatické koncentrace a snížení jeho protivirového účinku. Ombitasvir je inhibitorem NS5A proteázy, paritaprevir je inhibitorem NS3/4 proteázy viru. Ombitasvir i paritaprevir jsou metabolizovány přes složky cytochromu CYP3A. Další součást kombinace, ritonavir, není látkou s protivirovou účinností proti HCV. Je silným inhibitorem CYP3A. Jeho zařazení do 3D kombinace umožnilo snížení použité dávky paritapreviru. Otázkou je dostupnost této kombinace v ČR.
- Fixní kombinace grazopreviru (GZR) a elbasviru (EBR) – GZR i EBR jsou částečně metabolizovány CYP3A4, avšak metabolity nelze prokázat v plazmě. Eliminace metabolitů probíhá žlučí a stolicí, kombinace GZR/EBR je kontraindikována u pacientů s jaterní cirhózou funkční klasifikace Child-Pugh B a C. Vzhledem ke vztahu k CYP3A mohou induktory těchto proteinů (karbamazepin, bosentan, modafinil, fenytoin, efavirenz, etravirin atd.) snižovat a inhibitory CYP3A (cyklosporin, rifampicin) naopak zvyšovat plazmatické hladiny GZR/EBR a proto jsou kontraindikovány Při podání dalších farmak interferujících s CYP3A je třeba opatrnosti, jde např. o takrolimus, některé statiny, dabigatran).
- Fixní kombinace glekaprevir (GLE) a pibrentasvir (PIB) – hlavní cestou eliminace glekapreviru i pibrentasviru je biliární exkrece, jsou KI u pacientů s jaterní cirhózou Child-Pugh B a C. Z důvodu interakce je KI dabigatran, statiny mimo rosuvastatin, induktory CYP3A (rifampicin, karbamazepin, fenytoin). Hormonální antikoncepce obsahující ethinylestradiol je kontraindikována pro riziko vzestupu sérové aktivity ALT, antikoncepce obsahující progesteron je akceptovatelná. U pacientů s HCV/HIV koinfekcí je podání GLE/PIB kontraindikováno při léčbě atazanavirem a není doporučována jeho kombinace s dalšími režimy obsahujícími HIV proteázové inhibitory. Podobně není doporučována kombinace GLE/PIB s non-nukleosidovými inhibitory reverzní transkriptázy efavirenzem, etravirinem a nevirapinem. Všechny ostatní antiretrovirové léky lze s GLE/PIB kombinovat.
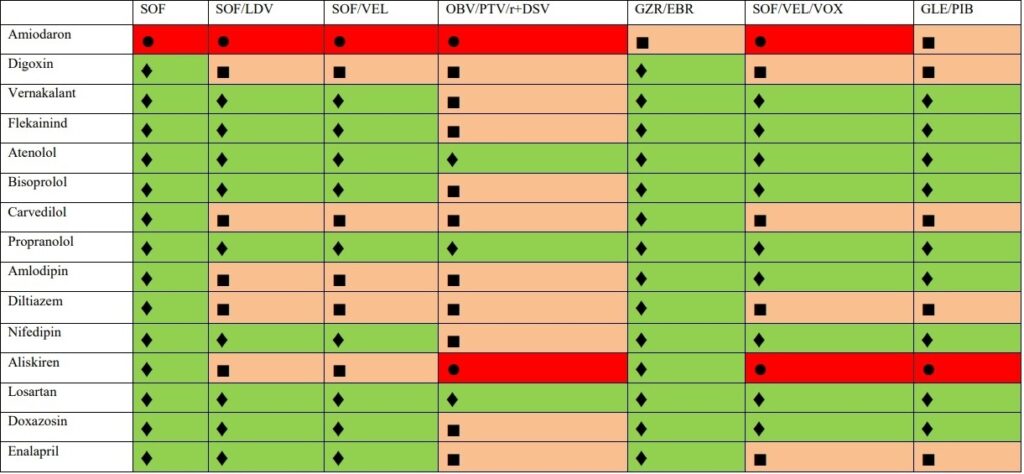
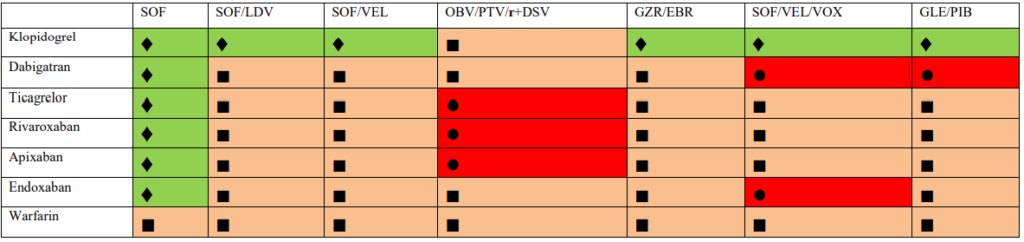
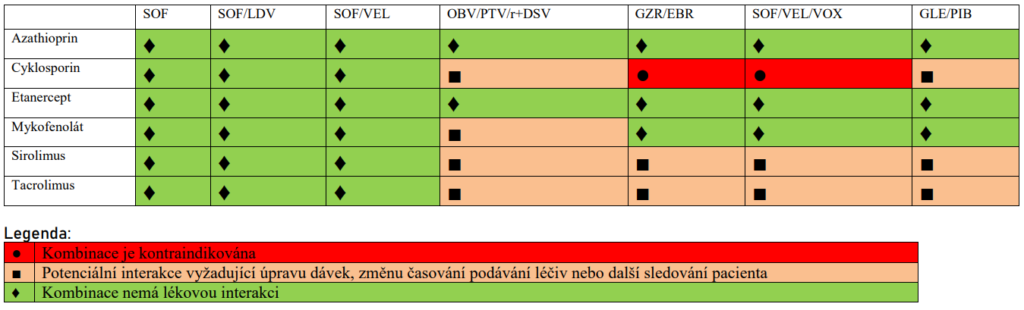
Detaily již přesahují rozsah tohoto sdělení a jsou dostupné online zde: https://www.ces-hep.cz/file/596/2018-guidelines-hcv-chssil-1.pdf.
Hepatitida E
Epidemiologie – celosvětová incidence hepatitidy E je nejméně 20 miliónů/rok (zejména v endemických oblastech – Indii, Asii, Africe a Střední Americe). Ve vyspělých státech je klinicky manifestní hepatitida E extrémně vzácná, ale zejména starší lidé mohou mít anamnestické protilátky. K perzistenci viru v prostředí napomáhají zvířecí rezervoáry (zejména prasata). K epidemiím dochází většinou po záplavách (monzunové období), ale vyskytují se i sporadické případy.
Virus byl nalezen ve stolici, žluči a játrech a je vylučován stolicí během pozdější inkubační doby. Imunitní odpověď se objevuje během virové infekce velice časně.
Etiologie – HEV je neobalený, 32 – 34 nm veliký fekálně – orálně přenosný virus, který je podobný HAV, ale vzhledem ke genetické odlišnosti je zařazen k hepevirům.
Genomem je jedno vlákno RNA o velikosti 7600 nukleotidů, které je složeno ze 3 genů: ORF1 – kóduje nestrukturální protein, nutný k virové replikaci, 2. ORF2 – kóduje hlavní nestrukturální protein (nukleokapsidový protein), 3. ORF3 – kóduje strukturální protein s nejasnou funkcí. Existují 4 druhy a 8 genotypů (heterogenita nukleotidů je 25 %), genotyp 1, 2 je nejvirulentnější, genotypy 3,4 jsou méně agresivní.
Klinický obraz – jako hepatitida A, ale průběh je těžší a je častější cholestáza.
CAVE Při infekci těhotných žen ve III. trimestru je mortalita až 20 %!
Diagnostika
- anti-HEV – jak třída IgM, tak IgG, po odeznění akutní infekce velice rychleji klesají, ale lze je najít v nízkém titru v séru i po 9 – 12 měsících. HEV antigen je přítomen v cytoplazmě.
- HEV RNA – lze prokázat na konci inkubační doby v krvi nebo stolici.
Komplikace
- hepatitida E mívá fulminantní průběh v 1 – 2 % případů, ale až ve 20 % u těhotných žen.
- hepatitida E nepřechází do chronického stádia.
Prognóza – v endemických oblastech hepatitidy E je mortalita 1 -2 %, u těhotných žen je to 10 – 20 %.
Prevence – látka k pasivní imunizaci (imunoglobulin) není v současné době k dispozici. V endemických oblastech je k dispozici vakcína proti hepatitidě E, v ČR zatím dostupná není.