Reprodukční systém je odpovědný za puberty a rozmnožování (opakovaný vývoj folikulu, ovulace a změny děložní sliznice připravující dělohu k uhnízdění vajíčka).
Vývoj ovarií a časný růst folikulů
- Ve 3. týdnu těhotenství lze již u plodu identifikovat první primordiální zárodečné buňky, které v 6 týdnů migrují do genitální lišty a od této chvíle se označují jako oogonie.
- V 8. týdnu těhotenství vstupují oogonie do profáze prvního meiotického dělení a stávají se z nich primární oocyty, které se následně obklopují jedinou vrstvou plochých buněk granulózy a vznikají z nich primordiální folikuly. Díky kombinace mitózy, meiózy a atrézie roste ve 20. týdnu těhotenství populace primordiálních folikulů až k 6 – 7 miliónům. Poté se jejich počet snižuje a v době porodu dosahuje jejich množství 1 – 2 miliónů. Až do ovulace přetrvávají oocyty v profázi prvního meiotického dělení.
- Tyto utlumené oocyty tvoří pool, ze kterého se během ovariálního cyklu vždy rekrutuje několik primordiálních oocytů, které rostou a dochází u nich k přechodu z plochých do kubických buněk granulózy a které se nazývají primární folikuly.
- Dále se tvoří zóna pellucida oocytu a kubické buňky granulózy tvoří již několik vrstev, toto stádium se označuje jako sekundární folikul.
- K výběru jednoho sekundárního folikulu z jejich poolu a jeho následné zrání je potřeba FSH. V tomto folikulu dochází k akumulaci tekutiny a mezi buňkami granulózy vzniká dutina (antrum) a odtud se nazývá jako antrální folikul. 5 – 7 dnů po začátku menzes je dominantní folikul již určen a zbývající folikuly z poolu degenerují a dochází u nich k atrézii.
- Dominantní folikul produkuje estradiol a inhibin (inhibují produkci FSH a tak i růst ostatních folikulů) a zvyšuje se u nich aktivita aromatázy. FSH zvyšuje počet LH receptorů na buňkách granulózy a nyní již Graafův folikul migruje na povrch vaječníku.
- Poté dochází k pulznímu zvýšení hladiny LH, který spouští ovulaci a následnou luteinizaci buněk théky a granulózy.
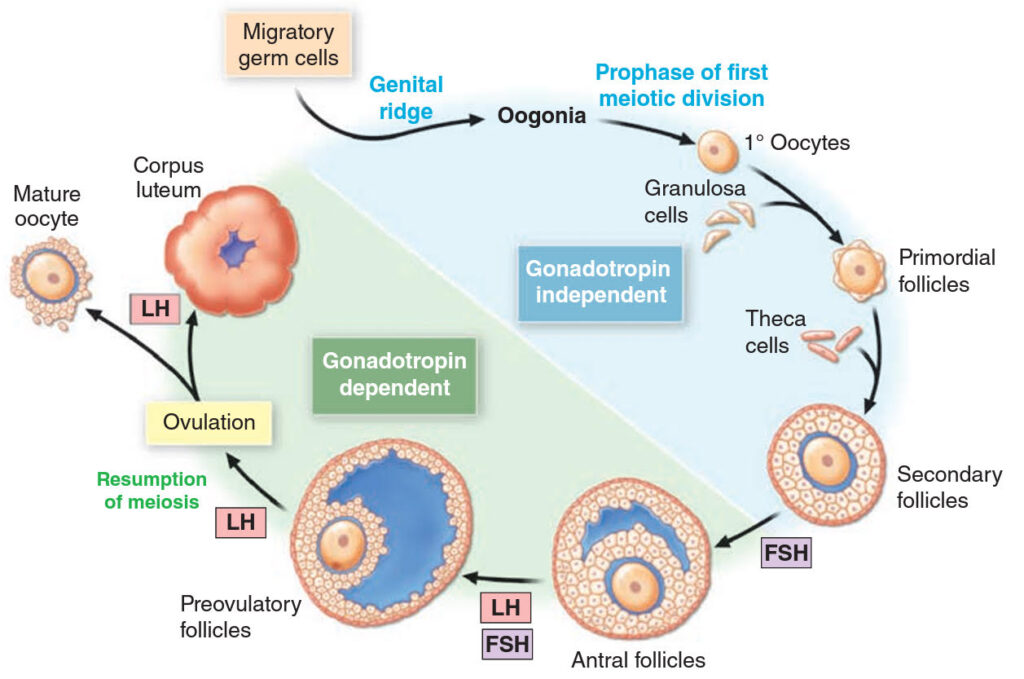
Regulace ovariálních funkcí
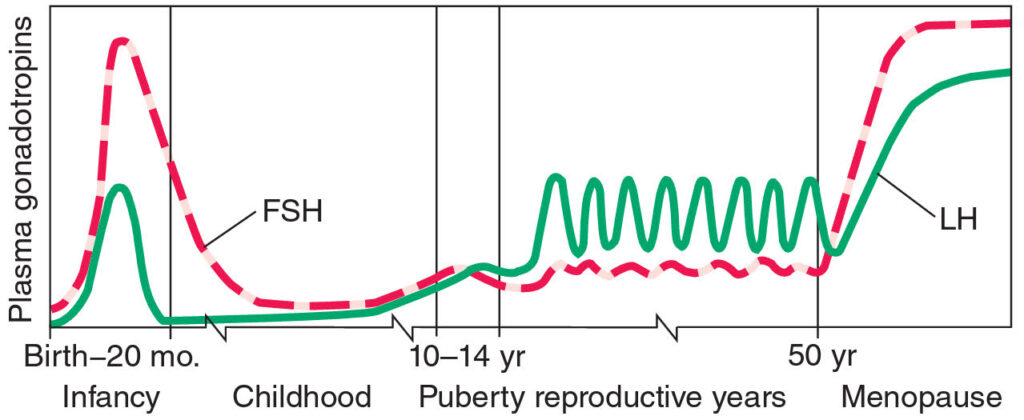
Neurony uvolňující GnRH původně vznikají v olfaktorické oblasti a následně migrují do hypothalamu, kde se na konci prvního trimestru napojují na hypothalamo-hypofyzární portální systém. GnRH je uvolňován v diskrétních pulzech každých cca 90 minut a v hypofýze stimuluje syntézu a sekreci FSH a LH (gonadotropní buňky zahrnují cca 10 % buněk hypofýzy).
Vysoké hladiny estradiolu a progesteronu produkovaných placentou během těhotenství potlačují hypothalamo-hypofyzární sekreci gonadotropinů plodu. Po porodu tento zdroj sekrece mizí a hladina gonadotropinů roste (FSH je u dívek výrazně vyšší než u chlapců, což vede k i k výrazně vyšší hladině estradiolu a inhibinu – tato situace ale ještě nekončí zráním folikulu a ovulací, k čemuž dochází až v pubertě). Ve 12 – 20 měsíci věku je hormonální osa až do puberty opět utlumena a je znovu nastartována pulsy GnRH. Podstata načasování zahájení puberty není úplně jasná, roli má pravděpodobně stimulátor sekrece GnRH kisspeptin-1.
Ovariální hormony
Ovariální buňky nedokážou své hormony skladovat a produkují je tak pouze jako odpověď na přítomnost FSH a LH během normálního cyklu. Ve vyvíjejícím se folikulu je k syntéze estrogenu nutná přísná integrace mezi buňkami théky a granulózy (FSH receptory se nachází pouze na buňkách granulózy, je zde vysoká koncentrace aromatázy a vzniká zde zejména estradiol během folikulární fáze cyklu, zatímco LH receptory se vyskytují pouze na buňkách théky a stimulují syntézu androstendionu a testosteronu). Buňky stromatu v přítomnosti androgenů proliferují (např. PCOS – syndrom polycystických ovárií), ale sami hormony neprodukují.
Estrogen – stimuluje vývoj vývodného systému prsu a připravuje reprodukční trakt na oplození (změny endometria, vaginální sliznice, ztenčení cervkálního hlenu a růst a kontraktilitu dělohy).
Progesteron – odpovědný za vývoj prsní žlázy a zvyšuje sekreční aktivitu estrogenem připravené sliznice, zvyšuje viskozitu cervikálního hlenu a inhibuje kontrakce dělohy. Dále zvyšuje bazální teplotu těla, která je tak užitečná i jako marker ovulace.
V cirkulaci je většina hormonů vázána na SHBG (sexual hormons binding globulin), progesteron se váže i na CBG (corticosteroid binding globulin). Oba hormony působí přes své receptory (estrogenový receptor α a β, resp. progesteronový receptor A a B).
Ovarium produkuje i další peptidy:
- inhibin (A a B) izolovaný z gonadální tekutiny selektivně inhibuje produkci FSH hypofýzou.
- aktivin (homodimer inhibinu) má opačnou funkci.
- AMH (nebo-li müllerian-inhibiting substance, vznikající v buňkách granulózy) je důležitý ve vývoji ovaria, protože navozuje degeneraci müleriánského systému u muže. Jeho hladina je zvýšená u PCOS díky nadbytku malých folikulů vyskytujících se u této choroby.
- relaxin je produkován buňkami théky v corpus luteum a je vysoce aktivní v děloze během implantace vajíčka. Jeho funkcí je decidualizace a vaskularizace endometria před implantací vajíčka. Získal svůj název díky své schopnosti potlačení kontraktility dělohy u prasat a hlodavců, nicméně, u člověka pravděpodobně nemá na relaxaci myometria žádný efekt.
Hormonální produkce během normálního menstruačního cyklu.
Produkce gonadotropinů výrazně závisí na amplitudě a frekvenci pulzů GnRH. Nízká frekvence a amplituda jednotlivých pulzů vede k produkci FSH (přítomnost aktivinu ji navíc zvyšuje, zatímco inhibinu snižuje), vysoká frekvence a amplituda zase stimuluje vznik LH. Sekreci GnRH naopak zpětnovazebně inhibuje estradiol a progesteron. Estradiol má tento efekt větší na FSH než LH (toto potlačení FSH má kritický vliv na vývoj a zrání jediného oocytru), naopak určitá hladina estradiolu na konci folikulární fáze je zásadní pro vznik pulzu LH, který indukuje ovulaci.
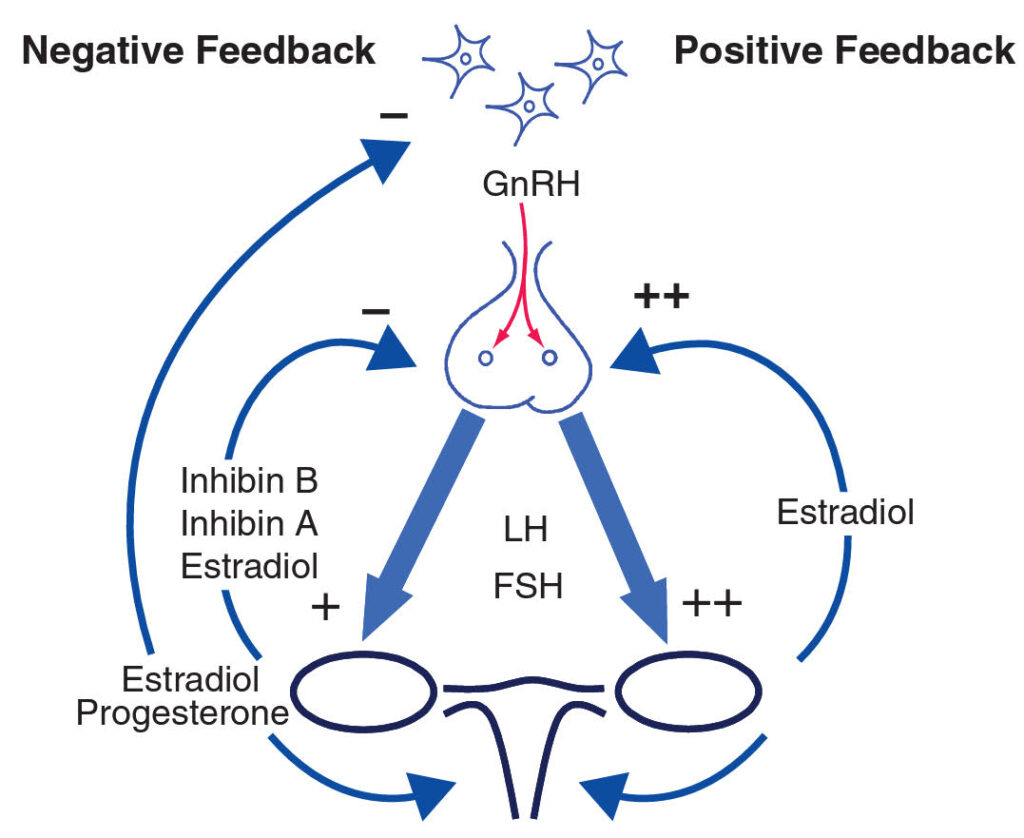
Folikulární fáze – na konci luteální fáze předchozího menstruačního cyklu dochází (díky ztrátě zpětnovazebné regulace gonadálními steroidy a pravděpodobně i inhibinem) k postupnému nárůstu FSH což vede k rekrutaci skupiny sekundárních folikulů s následnou konečnou volbou dominantního preovulačního folikulu. Na začátku folikulární fáze se zvyšuje i hladina inhibinu B s následnou proliferací zbylých buněk granulózy, který společně s inhibinem A a estradiolem potlačuje produkci FSH (selhání této suprese může vést k dozrávání více sekundárních folikulů). S dalším růstem dominantního folikulu se zvyšuje hladina inhibinu a estradiolu se zvýšením koncentrace LH receptorů. Růst hladiny estradiolu v této fázi vyvolá naopak pozitivní zpětnou vazbu se vznikem náhlého zvýšení hladiny LH a spuštěním ovulace.
Luteální fáze – z prasklého folikulu se formuje corpus luteum. Z luteinizovaných buněk granulózy vzniká inhibin A a progresteron, který pokračují v transformaci v androgeny s jejich aromatizací a vznikem estradiolu. Kombinovaná přítomnosti estrogenu a progesteronu je zásadní pro implantaci oplozeného vajíčka. Corpus luteum je udržováno aktivní pomocí LH, ale postupně k němu ztrácí citlivost, dochází k jeho involuci a zároveň končí hormonální podpora proliferace endometria. Vzniká vazokonstrikce endometriálních cév, ischémie, buněčná smrt a postupné odloučení endometria (menstruace).
V případě otěhotnění se na LH receptory corpus luteum váže hCG produkované trofoblastem a brání tak jeho involuci. Produkce pohlavních steroidních hormonů tak i nadále pokračuje až do 6 – 10 týdne gravidity, kdy hormonální produkci corpus luteum přebírá placenta.

Klinické posouzení ovariálních funkcí
Reprodukční cyklus ženy má průměrně 28 dnů (rozptyl 25 – 35 dnů je fyziologický). Délka luteální fáze je relativně konstantní (12 – 14 dnů), zatímco variabilitu působí interindividuálně různě dlouhá délka folikulární fáze. Délka menstruace je obvykle 4 – 6 dnů. Ve věku cca 35 let dochází k postupnému zkracování délky cyklu a s postupným věkem jsou častější anovulační cykly. U některých žen se objevuje mittelschmerz, (bolestivost v oblasti malé pánve vznikající rychlým rozpínáním dominantního folikulu během ovulace). Před menstruací, která následuje ovulační cyklus mají některé ženy pocit nadýmání, tuhost prsou a určitou nutnost přejídat se. Přítomnost ovulace lze odhadnout:
- hladinou progesteronu > 5 μg/l cca 7 dnů od očekávané následující menstruace.
- zvýšením tělesné teploty o > 0,24°C (progesteron zvyšuje tělesnou teplotu).
- hladinou LH v moči (podstatou testovacích proužků, jelikož ovulace nastává cca 36 hodin po pulzu LH a takto lze načasovat oplození vajíčka).
Puberta u žen
Začíná růstem axilárního a pubického ochlupení (adrenarche) jako důsledek produkce androgenů (zejména DHEA) díky dozrání zona reticularis nadledvin, dále růstem mléčné žlázy (thelarche). Průměrně cca po 2 letech od thelarche dochází k první menstruaci (menarche). Na začátku puberty zároveň stoupá i hladina GH se zrychlením lineárního růstu (maximum je cca 7 cm/rok, což je méně než u hochů), který je zastaven zánikem růstových štěrbin díky dlouhodobému vlivu estrogenů.
Předčasná puberta
Je definována jako přítomnost sekundárních pohlavních znaků před 8. rokem věku dívky. Příčiny:
- centrální příčiny – v 85 % idiopatická, způsobená předčasnou aktivací osy hypothalamus-hypofýza s následnou pulzatilní sekrecí LH a FSH. Příčinou mohou být tumory, infekce, malformace, traumata CNS apod. Základem terapie je podání dlouhodobých GnRH agonistů k zabránění předčasnému uzávěru růstových štěrbin a psychickým problémům spojeným s předčasnou pubertou.
- periferní příčiny – nezahrnuje aktivaci osy hypothalamus – hypofýza, typická je zvýšená hladina estradiolu spolu se sníženou hladinou hypofyzárních gonadotropinů. Příčinou může být:
- kongenitální adrenální hyperplázie
- tumory produkující estrogeny (nadledviny, ovaria) nebo hCG
- exogenní expozidce estrogenům nebo androgenům
- syndrom zvýšené funkce aromatázy
- McCune-Albrightův syndrom (fibrózní kostní dysplázie, kožní změny charakteru hyperpigmentaci nebo cafe-au-lait skvrn na jedné straně těla, různé hormonální nadprodukce).
Základem je léčba vyvolávající příčiny, omezený význam má použití inhibitorů aromatázy (inhibice vzniku estrogenů), inhibitorů steroidogeneze (ketokonazol) a blokátorů estrogenových receptorů (tamoxifen, toremifen, fulvestrant).
Opožděná puberta
Je definována jako absence sekundárních pohlavních znaků po 13. roce věku dívky. Příčiny:
- ovariální příčiny (25 – 40 %) – u této skupiny je hlavní příčinou Turnerův syndrom.
- systémová choroba – např. celiakie, chronická nefropatie, endokrinopatie apod.
- zvýšený stres, snížený energetický příjem (anorexie), nadměrná fyzická zátěž (vrcholový sport v dětství)
- kongenitální hypogonadotropní hypogonadismus při genetické mutaci některých klíčových genů.