Definice + epidemiologie
ČPFS 2019: Asthma bronchiale je heterogenní syndrom charakterizovaný chronickým zánětem a remodelací průdušek, spojený s jejich hyperreaktivitou a variabilní, reverzibilní obstrukcí. Celková prevalence v ČR 8 %, v dětské populaci 12 – 15 %. V dětství je peak incidence cca 3 roky, v dětství je 2x více postižených chlapců, než dívek, v dospělosti se rozdíly stírají.
CAVE Asthma bronchiale nelze chápat jako přesně definovanou jednotku, ale spíše jako syndrom s interindividuálně variabilní manifestací.
Etiologie
Nutné rozlišit rizikové faktory vzniku a spouštěcími faktory asthmatu. Obecně lze říct, že jde o kombinaci dědičných faktorů a negativních vlivů zevního prostředí:
I. Rizikové faktory
- Polygenní dědičnost (známo 100 různých genů, zejména 5. a 11. chromozom).
- Epigenetické mechanismy – metylace DNA a modifikace histonů je ovlivněna dietou, kouřením a znečištěním vdechovaného vzduchu.
- Dieta – rizikový je nedostatek antioxidantů (vitamín A, C, selen), hořčíku a omega-3 PUFA, nadbytek sodíku a omega-6 PUFA zvyšuje riziko asthma bronchiale.
- Atopie – hlavní rizikový faktor, který se vyskytuje > 80 % pacientů s asthmatem (provázeno alergickou rýmou nebo atopickým ekzémem).
- Obezita
- Expozice znečištěnému vzduchu a alergenům– je známo obrovské množství látek, které působí asthma (pyly, roztoči, zvířecí alergeny, houby, plísně, kvasinky, dále pšenice (pekaři, mlynáři), tabákový prach (výrobci cigaret), čajový prach (výrobci čaje), ptačí proteiny (chovatelé ptáků), karmín (kosmetika), hmyz (entomologové…), triethyltetraamin (letecký průmysl), akryláty, pryskyřice (klempíři), chloramin (pracovníci pivovaru), chlór (pracovníci chemičky nebo celulózky), formaldehyd (zdravotníci, laboranti), glutaraldehyd, latex (zdravotníci), PVC (výroba obalů), výpary z dieselovým motorů atd.
- Kouření (kuřáctví matky výrazně zvyšuje pravděpodobnost astmatu plodu, riziko astmatu také zvyšuje snížena kvalita vzduchu a vysoká koncentrace ozónu).
- Respirační infekce (pravděpodobně vyšší riziko při infekci RS virů u dětí, mykoplazmat a chlamydií, při expozici sporám plicní).
- Vzájemná provázanost s gastroezofageální refluxem (80% astmatiků má GERD).
- Vyšší riziko u nedonošených a krátkodobě kojených dětí.
- Hygienická hypotéza – nedostatek antigenních stimulů v raném dětství (alergeny, infekce) vede k predominanci Th2 buněk, které vedou k nadměrné produkci protilátek.
II. Triggery asthmatu
- Alergeny – inhalovaný alergen se váže na aktivovaný mastocyt a dojde k jeho degranulaci s indukcí bronchokonstrikce. Hlavními alergickými triggery jsou roztoči Dermatophagoides a další (prach, pyl, apod.).
- Virové infekce (např. RS virus, rhinoviry, koronavirus) vedou ke vzniku zánětu dýchacích cest, které jsou poté hyperreaktivní.
- Léky – např. beta blokátory, kyselina acetylsalicylová
- Chlad, hyperventilace, tělesná námaha, stres (častým triggerem jsou např. běžky). Námahou indukovanému asthmatu lze předcházet podáním beta2 sympatomimetik a antileukotrienů, optimálně pravidelnou léčbou IKS.
- Znečištění ovzduší jak enviromentálně, tak profesně (oxidy síry, dusíku, ozón, splodiny dieselových motorů).
- Hormonální vlivy – časté zhoršení u žen před menstruací.
- GERD – velké množství asthmatiků trpí zároveň GERD, spolupodílem je pravděpodobně dráždění vláken n. vagus v distálním jícnu s následnou bronchokonstrikcí.
Patofyziologie
Dochází ke chronickému zánětu malých dýchacích cest s jejich infiltrací aktivovanými eozinofily a T lymfocyty. Bronchoskopicky jsou dýchací cesty zarudlé, zúžené a edematózní, epitel je fragilní, vrstva hladké svaloviny i bazální membrána jsou ztluštělé (díky zvýšené expresi TGF-beta) a lumen bývá obturováno hlenovou zátkou s metaplazií pohárkových buněk. Na jejich povrchu se nachází aktivované mastocyty s navázanými IgE, které jsou aktivovány alergeny s následným uvolněním vazokonstrikčních látek (např. histamin, prostaglandin D2, leukotrieny). Dalšími buňkami, které se podílí na vzniku asthmatu jsou eozinofily. Epitel a makrofágy produkují díky zvýšené aktivitě NO syntázy NO, jehož množství ve vydechovaném vzduchu odpovídá míře eozinofilního zánětu. Toto vše vede k hyperreaktivitě dýchacích cest.
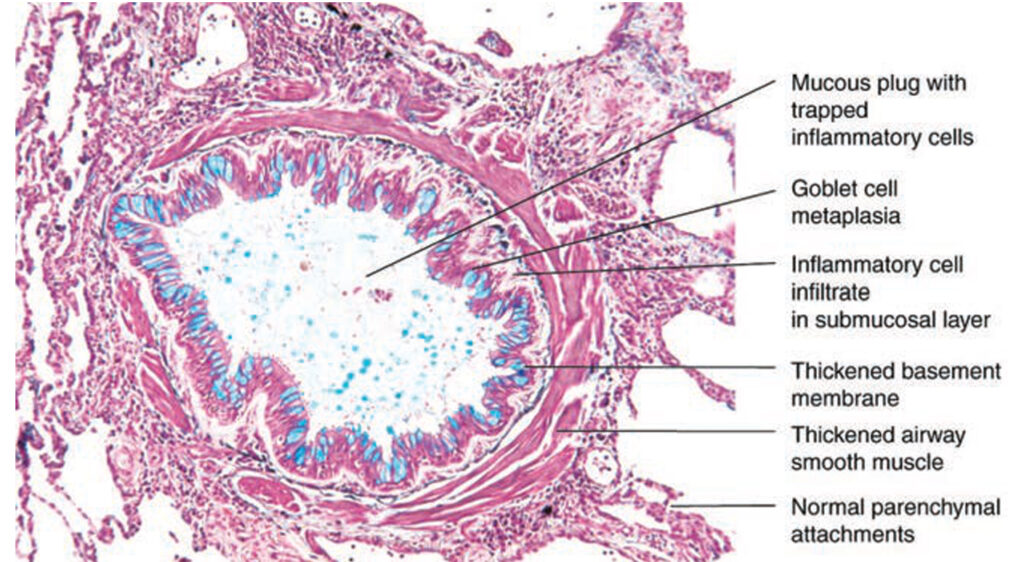
Chronický zánět je udržován aktivitou Th2 lymfocytů, které jsou zdrojem IL-4 (růstový faktor B-lymfocytů, který podporuje jejich transformaci na plazmocyty a izotypový přesmyk) a IL-5 (růstový faktor eozinofilů). Podněty, které působí asthma, jsou:
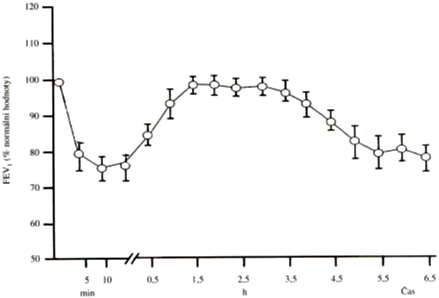
1. Alergická reakce I. typu (atopické astma) s dvoufázovou bronchokonstrikcí. Časná fáze (15 – 30 minut po expozici) je způsobena mediátory mastocytů (histamin, leukotrieny), které navodí zvýšení sekrece a kontrakci hladkých svalů, pozdní fáze (4 – 8 hodin po expozici) je způsobena mediátory neutrofilů a eozinofilů (bazický a kationický protein), které navodí alteraci epitelu.
2. Bronchiální hyperreaktivitou (neatopické astma), která je multifaktoriální:
- poškození epitelu bronchů vede ke zpřístupněním nervových zakončení k účinku dráždivých podnětů (záchvat tak může vyvolat i dýchání studeného vzduchu).
- sliznice obsahuje zvýšené množství zánětlivých buněk, které po aktivaci mohou uvolnit mediátory bronchokonstrikce (histamin, acetylcholin, LTC4, PGD2, PGF2).
- možná i nedostatek fyziologických bronchodilatačních substancí .
Funkční důsledky asthmatického záchvatu
- Dochází k inspirační poloze hrudníku s hyperinflací (↑ RV+FRC, TLC), dyspnoe s hypoxémií a postupné únavě dýchacích svalů. Vzhledem k přítomné hypoxii dochází k hyperventilaci s následnou mírnou hypokapnií, jejíž příčinou je nerovnoměrnost ventilace a perfúze. Všechny bronchy totiž nejsou obturovány najednou, ty obturované kladou odpor (bronchokonstrikce, edém sliznice s nadměrnou tvorbou hlenu) a jejich alveoly jsou tedy hypoventilované, s následnou hyperventilací alveolů nepostižených bronchiolů. Dochází k hypoxii (hyperventilace nepostižených alveolů nedokáže kompenzovat alveoly postižených bronchiolů) a zvýšení ventilačního úsilí.
- Během záchvatu klesá FEV1, PEF, FEF25-75 a často dochází k předčasnému uzávěru bronchiolů při zvýšeném nitrohrudním tlaku (způsobeném činností exspiračních svalů).
- Vzhledem k rozepnutí plic se může zvyšovat DCO.
- Při vyčerpání respiračních svalů klesá ventilace, dochází k hyperkapnii a respirační acidóze.
Klasifikace (lze dle více kritérií)
I. Podle úrovně klinické kontroly (je třeba si uvědomit, že asthma nelze vyléčit, lze jej pouze stabilizovat). Spočívá v hodnocení určitých znaků za poslední čtyři týdny:
- Denní příznaky (optimálně žádné nebo maximálně 2x týdně).
- Noční příznaky event. buzení dušností (optimálně žádné).
- Omezení aktivity (optimálně žádné).
- Potřeba úlevových léků (optimálně žádná nebo maximálně 2x týdně) .
- Spirometrie normální (cut off > 80 % náležité hodnoty).
Pokud jsou splněny všechny znaky, je asthma pod plnou kontrolou, při nesplnění 1 – 2 znaků je asthma pod částečnou kontrolou, při nesplnění 3 a více znaků je asthma pod nedostatečnou kontrolou.
II. Podle tíže lze asthma klasifikovat do 5 stupňů, kdy je potřeba zjistit, jak intenzivní léčba je nutná k udržení asthmatu pod kontrolou. Při dosažení dostatečné kontroly lze zkusit léčbu deeskalovat o stupeň dolů. Poslední (pátý) stupeň zahrnuje:
- obtížně léčitelné astma (OLA), jehož důvodem jsou nepoznané nebo nedostatečně léčené komorbidity, nízká adherence k léčbě, kouření…
- těžké refrakterní astma (TRA) je za situace, kdy není dosaženo dostatečné kontroly i přes optimální léčbu i compliance pacienta
Antiasthmatika lze rozdělit na:
Úlevová, která lze užít jen podle potřeby. Lékem první volby jsou RABA, aletrnativou RABA/SAMA, event. od 3. stupně i nízká dávka IKS. Pokud není asthma pod kontrolou, přidáváme postupně léčbu kontrolujícími antiastmatiky dle následujícího schématu:
- Stupeň 1 – bez nutnosti kontrolujícího antiasthmatika.
- Stupeň 2 – nízká dávka IKS, alternativou jsou antileukotrieny, event. kromony nebo teofyliny s prodlouženým účinkem.
- Stupeň 3 – nízká dávka IKS + (U)-LABA. Alternativou je střední/vysoká dávka IKS, nízká dávka IKS + antileukotrien nebo teofylin s prodlouženým účinkem.
- Stupeň 4 – viz stupeň 3 + jedno nebo více následujícího: střední nebo vysoká dávka IKS + (U)-LABA (event + U-LAMA), nízká dávka IKS + (U)-LABA + antileukotrien/teofylin.
- Stupeň 5 – viz stupeň 4 + perorální kortikoid/biologizcká terapie (anti-IgE, anti-IL-4/IL-5 nebo jejich receptory)/antimykotikum/bronchiální termoplastika.
III. Podle fenotypu (důležité k optimalizaci léčby:
- Eozinofilní, alergické – dominujícím příznakem je přítomnost významné alergie. Začíná většinou v mladším věku.
- Eozinofilní, nealergické – dominujícím příznakem je přítomnost výrazné eozinofilie, alergie nebývá významněji vyjádřena. Začíná obvykle ve středním věku.
- Non-eozinofilní, nealergické – není přítomna ani eozinofilie, ani alergie. Začíná většinou v dospělosti a bývá spojeno s nadváhou a ženským pohlavím.
Klinický obraz + diagnostika
Typické jsou opakované stavy dušnosti spojené s pískoty na hrudníku, pocit sevření nebo tíhy na hrudníku, dráždivý kašel (někdy může být dominujícím nebo jediným příznakem). Obtíže se častěji objevují v noci nebo po ránu. Příznaky jsou velmi dynamické, často s rychlým nástupem. Varovným příznakem je „tichá plíce“ (nic již nedýchá…). Fyzikálně je nález v klidovém stavu normální, jinak pískoty a vrzoty, prodloužené exspirium, vzácněji známky hyperinflace plic (hypersonorní poklep, oslabená bronchofonie), paradoxní puls, vtahování supraklavikulárních jamek, použití akcesorních dýchacích svalů (závažný stav, krajně vznik „tiché plíce“). RTG S+P bývá normální nebo se známkami hyperinflace.
Pro stanovení diagnózy je nutná anamnéza kompatibilní s asthmatem + typický průběh + reverzibilní bronchiální obstrukce dle spirometrie.
Vlastní diagnostický proces:
1. Průkaz vlastní nemoci vyšetřením přítomnosti, resp. bronchiální hyperreaktivity. K potvrzení diagnózy může přispět průkaz eozinofilního zánětu průduškové stěny, ačkoliv existují i případy non-eozinofilního astmatu.
Spirometrie – sledovaným parametrem je FEV1 a FEV1/VCmax(Tiffeneaův index), vždy je indikováno provést bronchodilatační test (pozitivní, když se po 400 μg salbutamolu FEV1 zlepší o > 12 % a zároveň 200 ml, > 15 %/ 400 ml je vysoce signifikantní). Bronchokonstrikční test je indikován, pokud se nepodaří prokázat obstrukce a nadále přetrvává podezření na astma. Test se provádí metacholinem. Bodypletysmografie a difúze při nejasnostech.
2. Průkaz příčin nemoci (tj. induktorů zánětu a spouštěčů bronchokonstrikce), spolu s určením event. komplikujících onemocnění a okolností.
- FENO (množství oxidu dusnatého ve vydechovaném vzduchu) k průkazu eozinofilního zánětu. Hodnoty < 25 ppb – eozinofilní asthma nepravděpodobné, > 50 ppb – vysoce pravděpodobné).
- Alergologické vyšetření (eozinofilie, IgE) vždy při prvním stanovení diagnózy nebo po ztrátě kontroly nad onemocněním z nejasných příčin.
- Průkaz komplikujících nemocí, nejčastěji alergická rinosinusitida, obezita a GERD.
3. Klasifikace nemoci – tj. tíže a fenotypu astmatu a úrovně jeho kontroly
Terapie
CAVE Primární je snaha o kontrolu asthmatu, nikoliv jeho vyléčení (nemožné!).
I. Nefarmakologická léčba – snaha o zamezení expozice spouštěčům asthmatu (vyhnutí kontaktu s tabákovým kouřem a lékům, potravinám, škodlivinám a alergenům, o kterých víme, že vyvolávají obtíže). Vhodné je zvážení alergenové imunoterapie.
II. Léčba komplikujících stavů:
- rinosinusitida – antihistaminika (neléčí astma – v případě koincidence s alergickou rýmou však mohou druhotně přinést příznivý efekt), intranazální glukokortikoidy, event. funkční chirurgické výkony (FESS), zvl. v případě polypózní formy
- obezita – již 5 – 10 % úbytek hmotnosti vede ke zlepšení kontroly nad asthmatem (největší efekt prokázán u bariatrických operací)
- GERD – režimová a dietní opatření, PPI, prokinetika, antacida/algináty
- námahou indukovaná bronchokonstrikce – důsledná kontrola nad asthmatem (IKS a/nebo antileukotrieny), SABA, antileukotrieny nebo kromony před zátěží (každodenní užívání SABA vede ke ztrátě jejich preventivního účinku), pravidelný trénink, pozvolné rozcvičení/zahřátí před plánovaným výkonem
- profesní příčina – důsledná eliminaci expozice (mouka, izokyanáty, exotická dřeva aj.), co nejdříve (!) odeslat hlášení na příslušné pracoviště nemocí z povolání (seznam pracovišť na http//:www.pracovni-lekarstvi.cz/strediska-nemoci-z-povolani.php)
- intolerance NSAID doporučit alternativní medikace:
- antipyretika: paracetamol je slabý COX-1 inhibitor (někteří nemocní s NSAID intolerancí jej také netolerují)
- analgetika: paracetamol + tramadol
- antiflogistika: coxiby (COX-1/COX-2 inhibitory – meloxikam, nimesuld nejsou doporučeny)
- antiagregancia: clopidogrel
Určitou možností jsou desenzibilace.
- v případě léčby beta blokátory je nejlépe jejich nahrazení jiným lékem, v případě jejich nutnosti vybrat co nejvíce kardioselektivní látku.
- očkování proti chřipce a COVID 19 je doporučeno pacientům se středně těžkým a těžkým asthmatem.
III. Farmakologická léčba – léky lze rozdělit na úlevová (bronchodilatancia, léčí příznaky a exacerbaci) a kontrolující (působí protizánětlivě a preventivně). Při nedostatečné kontrole je vždy nutné modifikovat léčbu (viz výše). Od ztráty kontroly nad asthmatem je zapotřebí odlišovat, pojem, který se částečně překrývá se starší terminologií astmatický záchvat, resp. akutní asthma. Exacerbace asthmatu je definována v odd. Tíže asthmatu. Exacerbace je většinou vyústěním déletrvající nedostatečné kontroly nad těžšími formami astmatu (často v důsledku zanedbávání protizánětlivé léčby nemocnými), může však propuknout i pacientů s lehčími formami astmatu, které byly dlouhodobě pod plnou kontrolou (zvláště při souběhu nepříznivých okolností, např. virový infekt + alergenová expozice + smogová situace). K monitoraci kontroly nad asthmatem ve většině klinických situací postačuje „selfmonitorace“ hodnoty FEV1 (FENO není doporučeno).
1. IKS – inhalační kortikosteroidy – v současnosti nejúčinnější kontrolující antiastmatika. Ekvipotentní dávky IKS:
| IKS (μg) | nízká dávka | střední dávka | vysoká dávka |
| beklometazon propionát | 200 – 500 | 500 – 1000 | 1000 – 2000 |
| budesonid | 200 – 400 | 400 – 800 | 800 – 1600 |
| ciklesonid | 80 – 160 | 160 – 320 | 320 – 1280 |
| flutikazon propionát | 100 – 250 | 250 – 500 | 500 – 1000 |
| mometazon furoát | 110 – 220 | ˃ 220 – 440 | ˃ 440 – 800 |
Dávka 400 μg budesonidu nebo jeho ekvipotence přináší kontrolu asthmatu u většiny pacientů. Přechod na vyšší dávky přináší jen malé zlepšení, tedy je místo zvýšení vhodné přidání rozšíření o lék z jiné řady (je ale jasná úměra mezi kontrolou astmatu mezi vysokými dávkami a prevencemi těžkých exacerbací u pacientů s těžkým astmatem).
NÚ: Místní – orofaryngeální kandidóza (prevencí je vyplachování úst), kašel. Systémové v závislosti na dávce (většinou při dávkách budesonidu nad 500 μg). Nejlepší profil má ciklesonid.
Léky: beklometazon dipropionát – ECOBEC, BECLOMET, beklometazon dipropionát – ECOBEC, BECLOMET, ciklesonid – ALVESCO, flutikazon propionát – SERETIDE (+ salmeterol)
2. Systémové kortikoidy – léčba p.o. kortikoidy je nutná u těžkého, resp. obtížně léčitelného asthmatu. Preferovány prednison, prednisolon, methylprednisolon (mají minimální mineralokortikoidní účinek, minimální riziko myopatie). Pokud je to možné, podáváno jednou denně ráno nebo obden.
3. Teofyliny – preferovány formy s prodlouženým účinkem. Mechanismem je inhibice fosfodiesterázy při koncentracích > 5 mg/l protizánětlivý účinek, > 10 mg/l bronchodilatace.
I: Zejména jako aditivní bronchodilatans na kontrolu středně těžkého až těžkého asthmatu. V monoterapii jako prostředek kontroly u lehkého perzistujícího asthmatu
NÚ: Intoxikace (> 15 mg/l) – nauzea, zvracení, tachykardie, arytmie, stimulace dechového centra. Dochází k relaxaci dolního jícnového svěrače (nevhodné u GERD).
Zpomalení metabolismu – horečky, těhotenství, jaterní onemocnění, selhání srdce. Interakce s cimetidinem, chinolony a makrolidy. Zrychlení metabolismu – děti, kuřáci.
Léky: EUPHYLLIN CR 100, 200, 300, 400 mg – začínáme s 200mg 1-0-1 (dále dle hladiny).
4. RABA – rychle působící inhalační β2 sympatomimetika
| nástup účinku | krátkodobý (SABA) | dlouhodobý (LABA) |
| rychlý – RABA | fenoterol | formoterol |
| salbutamol | ||
| terbutalin | ||
| pomalý | salmeterol |
Relaxují hladké svalstvo dýchacích cest, zlepšují mukociliární clearance, snižují vaskulární permeabilitu i uvolňování zánětlivých mediátorů z mastocytů a bazofilů. Prokázán vznik rezistence na bronchoprotektivní účinek, kterou lze inhibovat IKS (ideální kombinace). Ideální profylaxe námahového asthmatu. Doporučeno pro léčbu příznaků podle potřeby, jsou dobrým indikátorem kontroly astmatu.
NÚ: menší než u p.o. forem – kardiovaskulární stimulace, třes, hypokalémie
Léky fenoterol BEROTEC 100μg, + ipratropium bromid BERODUAL, BERODUAL inh 1ml + 4ml FR, salbutamol VENTOLIN 100μg, VENTOLIN 20ml/120mg (k inhalaci – 1 ml ventolinu+ 4ml FR), terbutalin BRICANYL, formoterol – FORADIL cps 12 μg (2x denně), + budesonid SYMBICORT 100/6, 200/6,l 400/12, salmeterol – SEREVENT disk 60 x 50 μg (2x denně), + flutikazon (SERETIDE DISKUS 50/100, 50/250, 50/500
5. Antileukotrieny – antagonisté receptoru pro cysteinylové leukotrieny 1 (montelukast, zafirlukast) nebo inhibitory 5-lipoxygenázy (zileuton – u nás nedostupný). Mají malý, ale variabilní bronchodilatační účinek, redukují příznaky, zlepšují plicní funkce a snižují množství exacerbací. Pokud nedojde ke zlepšení po 3 měsících užívání, není jejich další užívání indikováno. Jen malé nežádoucí účinky. Vhodné užití:
- nemohou nahradit IKS, ale působí aditivně u pacientů se středně těžkým a těžkým astmatem, ale adice je menší než u LABA.
- nejlepší u pacientů s aspirin nebo NSAID senzitivním asthmatem a
- námahou indukovaným asthmatem (zejména v dětství, kdy lze jako monoterapie).
Léky: montelukast SINGULAIR 10mg 0-0-1 – účinek nezávislý na dávce (bez interakcí).
6. Antihistaminika 2. generace – inhibiční účinek na alergickou odpověď, nemají primární úlohu u léčby asthmatu, ale mohou mít příznivý účinek zejména u atopiků.
Léky: desloratadin AERIUS 5mg, levocetirizin XYZAL 5mg
7. Biologická terapie – anti IgE, anti IL-4, anti IL-5/R, anti IL-13, anti TSLP (proti stromálnímu lymfopoetinu thymu) – centrová léčba u nejtěžších forem asthmatu.
8. Ipratropium bromid – patří mezi inhalační anticholinergika s krátkodobým účinkem, které blokují acetylcholinový účinek na M3 receptoru, což vede ke snížení bronchokonstrikce a snížení produkce hlenu. Nevýhodou je současná blokáda M2 receptoru Je přítomen pomalejší nástup účinku (45 minut) než β2SM a doba trvání je 6 – 8 hodin. Používají se aditivně k β2SM. NÚ: suchost v ústech, hořká chuť. Vysoké dávky působí obtíže u pacientů s benigní hyperplazií prostaty nebo obstrukcí hrdla močového měchýře.
Léky: ATROVENT, ATROVENT 1ml/250 μg 1ml atrovent + 4 ml FR, + fenoterol BERODUAL
9. Systémové kortikoidy – p.o. nebo parenterálně, pomalý nástup účinku (cca 5 hodin). Preferována p.o. léčba. V podávání se pokračuje 1 – 2 týdny po počáteční léčbě exacerbace (po takto krátké kůře není po vysazení deplece kortikoidů). I.v. se podávají u pacientů s těžkým asthmatem.
Léky: prednison PREDNISON 5, 20 mg, methylprednisolon MEDROL 16, 32 mg, SOLUMEDROL amp 40, 125, 250, 500, 1000 mg (stačí 80 mg), hydrokortizon HYDROCORTISON 100mg (stačí 300 – 400 mg).
10. Teofyliny s krátkým účinkem – méně účinný a pomalejší bronchodilatační účinek než β2SM. Kontroverzní úloha v léčbě asthmatu (nemusí přinést bronchodilataci, ale stimulují dýchání). Bez znalosti sérové hladiny by neměly být podávání i.v. pokud jsou podávány p.o.
Léky: aminofylin SYNTOPHYLLIN 240 mg (úvodem 3 mg/kg, poté udržovací dávka 0,6 mg/kg/h)
11. Parenterální β2 sympatomimetika – vyhrazeno pro těžké exacerbace asthmatu za hospitalizace.
Léky: terbutalin BRICANYL 0,5mg/ml s.c. 0,25 – 0,5 mg max 4 x denně, i.v. 0,25 – 0,5mg + 10ml FR/10min
Léčba akutního těžkého astmatu
- kyslík – tak aby SpO2 > 95%
- β2 sympatomimetika – nebulizátorem – salbutamol (VENTOLIN) – u kritického astmatu zpočátku až 2 x vyšší dávka než výše uvedené. Fenoterol má vyšší výskyt NÚ,. V kritických stavech i.v. terbutalin. Intratracheálně (pokud nelze zajistit i.v. přístup) salbutamol 100 – 300 μg.
- ipratropium bromid – inhalačně, u kritického astmatu zpočátku až 2x vyšší dávka než výše uvedené.
- kortikosteroidy – hydrokortizon- 200 mg (3 – 4 mg/kg) i.v. bolusově, poté 1000mg/24h kont. infúzí nebo 200mg á 6 hodin bolusově, methylprednisolon – 250 mg/24h (vyšší dávky nepřináší lepší efekt)
- teofyliny – aminofylin – úvodem 3 mg/kg, poté udržovací dávka 0,6mg/kg/h, hladiny teofylinu mezi 10 – 20mg/l
- UPV – obtížná intubace v kombinaci lokální anestezie + celkové anestezie (vzhledem k riziku uvolnění histaminu není vhodný morfin ani atrakurium). Nastavuje se relativně nízká minutová ventilace (< 70 ml/kg/min) při malých jednotlivých objemech (6 ml/kg) a frekvenci < 12/min, obvykle stačí 50% koncentrace kyslíku ve vdechované směsi. Vysoký PEEP (vzhledem k přítomnosti hyperinflace) není doporučován. Toto vede k respirační acidóze…nutná sedace, výjimečně myorelaxace.
Další opatření s nejednoznačným účinkem – adrenalin s.c. nebo i.v., magnesium i.v., helium.
Celkově je asthma bronchiale výborně zpracováno v doporučených postupech ČFPS zde: http://www.pneumologie.cz/guidelines/ v sekci bronchiální obstrukce.