Fyziologie kůry nadledvin
Kůra nadledvin produkuje tři druhy kortikosteroidů:
- syntéza mineralokortikoidů – vnější zona glomerulosa
- syntéza glukokortikoidů – prostřední zona fasciculata
- syntéza adrenálních androgenů – vnitřní zona reticularis
Glukokortikoidy a mineralokortikoidy působí přes specifický nukleární receptor, prekurzory adrenálních androgenů jsou konvertovány v gonádách a cílových buňkách v periferii na pohlavní hormony, které následně působí přes nukleární androgeny a estrogenové receptory. Porucha kůry nadledvin je charakterizována nadbytkem nebo nedostatkem v jedné nebo více řadách z těchto tří hlavních tříd kortikosteroidů z různých důvodů.
Anatomie a vývoj nadledvin – normální nadledviny mají hmotnost 6 – 11 gramů každá. Nacházejí se nad ledvinami a mají vlastní cévní zásobení, kdy arteriální krev proudí nejdříve pod kapsulu a poté meandruje přes zona glomerulosa (na povrchu), fasciculata (uprostřed) do zona reticularis (uvnitř) a poté do dřeně nadledvin. Pravá suprarenální žíla ústí přímo do vena cava inferior, levá do levé renální žíly. Nadledviny se derivují z urogenitální lišty a poté separují od gonád a ledvin zhruba v 6. týdnu gestace. V době sexuální diferenciace (7. – 9. týden těhotenství) začíná kůra nadledvin produkovat kortizol a prekurzor pohlavních hormonů DHEA.

Glukokortikoidy
Syntéza glukokortikoidů je pod zpětnovazebnou kontrolou hypothalamu a hypofýzy. Hypothalamus uvolňuje CRH (jako odpověď na endogenní nebo exogenní stres), který stimuluje štěpení POMC (proopimelanokortin) prohormon konvertázou (specifická pro hypofýzu) na ACTH, které je uvolňováno kortikotropními buňkami adenohypofýzy a následně působí jako hlavní regulátor syntézy nejen glukokortikoidů, ale má i krátkodobý efekt na mineralokortikoidy a adrenální androgeny.
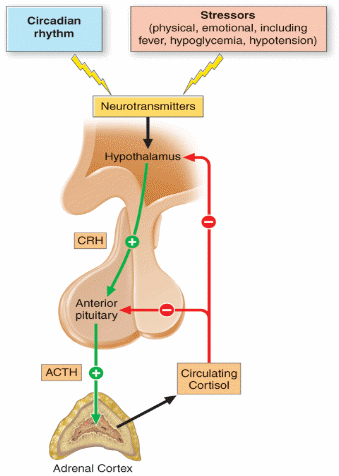
Zpětnovazebná kontrola syntézy glukokortikoidů osou hypothalamus – hypofýza – kůra nadledvin.
CRH – coritocotropin releasing hormone, ACTH – adrenokortikotropní hormon.
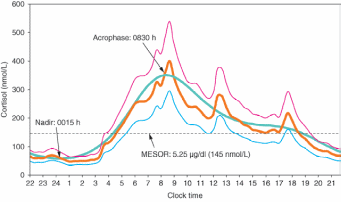
Uvolňování CRH podléhá cirkadiánnímu rytmu (řízeno je zejména nucleus suprachiasmaticus hypothalamu). M2CR (melanocortin 2 receptor), interaguje intracelulárně s MRAP (M2CR-accessory protein). Tento komplex je následně transportován na povrch buňky a na adrenokortikální buněčné membráně se na něj váže ACTH. Stimulace receptoru vede k aktivaci adenylát cyklázy se zvýšením produkce cAMP a aktivací proteinkinázy A. Následná fosforylace vede k zvýšení importu esterů cholesterolu, zvýšení aktivity hormon-senzitivní lipázy a zvýšení dostupnosti a fosforylace CREB (cAMP Response Element Binding), transkripčního faktoru, který umožňuje transkripci enzymu CYP11A1 (side chain cleavage enzyme). K syntéze všech steroidů je potřeba import cholesterolu do mitochondrií, který zajišťuje StAR (steroidogenic acute regulatory protein – transportuje cholesterol dovnitř mitochondrií). Většinu enzymů zapojených ve steroidogenezi tvoří cytochrom P450 (CYP), které jsou lokalizovány jak v mitochondriích (CYP11A1 – side chain cleavage enzyme. CYP11B1 – 11β hydroxyláza, CYP11B2 – aldosteron syntáza), tak v sarkoplazmatickém retikulu (CYP17A1 – 17α hydroxyláza, CYP21A2 – 21 hydroxyláza, CYP19A1 – aromatáza).
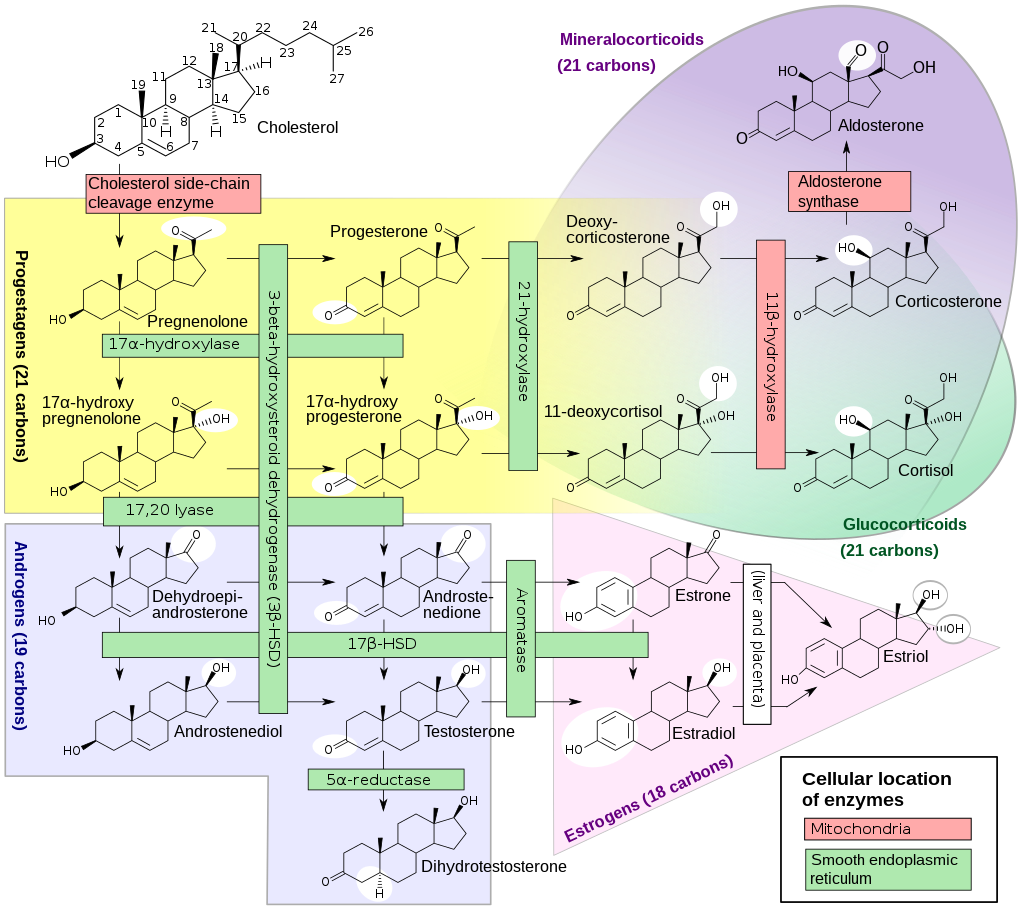
Z cholesterolu vzniká (pomocí cholesterol side chain cleavage enzyme, CYP11A1) pregnenolon. Pregnenolon se konvertuje na progesteron (pomocí 3β-hydroxysteroid dehydrogenázy 2), ze kterého vzniká 17-hydroxyprogesteron (pomocí α-hydroxyláza/17,20 lyázy, CYP17A1), ze kterého vzniká 11-deoxykortizol (pomocí 21-hydroxylázy, CYP21A2), ze kterého vzniká aktivní kortizol (pomocí 11-β hydroxylázy, CYP11B1), který se následně metabolizuje na kortizon (pomocí 11β-hydroxysteroid dehydrogenáza typ 1, HSD11B2).
Po uvolnění do cirkulace se většina kortizolu váže na CBG (cortizol-binding globulin), méně na albumin. Pouze nevázaná frakce (která je minoritní) je biologicky aktivní. Tento volný kortizol přímo vstupuje do buněk (bez nutnosti aktivního transportu). V cytosolu cílových buněk se kortizol váže na glukokortikoidový receptor. Ten se aktivuje s následným odštěpením heat shock proteinu od receptoru a dimerizací a přesunutím dimerů do jádra:
- homologní dimery (GR-GR) – v jádře aktivují GRE (glucocorticoid response elements) na DNA se zesílením transkripce genů souvisejících glukokortikoidy (GR transaktivace)
- heterologní dimery (GR – transkripčními faktory např. AP-1 nebo NF-κB) s následnou transrepresí proinflamatorních genů
Vzhledem k množství tkání, na které kortizol působí (tuk, játra, svalstvo, mozek…), vzniká z kortizonu (neaktivní) kortizol pomocí 11β-hydroxysteroid dehydrogenázy typ 1 (11βHSD1).
Ke své správné funkci potřebuje nikotinamid adenin dinukleotid fosfát v redukované formě (NADPH), který je poskytován enzymem hexoza-6-fosfát dehydrogenázou (H6PDH, lokalizován v lumen endoplazmatického retikula a konvertuje glukóza-6-fosfát na 6-fosfoglukonát, za současné syntézy NADPH z NADP+).
Diagnostika – základem diagnostiky osy hypothalamus – hypofýza – kůra nadledvin je fakt, že jednotlivé stupně jsou ovlivňovány negativní zpětnou vazbou. Testy:
Dexametazonový supresní test – při diagnostice Cushingova syndromu (dexametazon je účinný glukokortikoid, který potlačuje CRH a ACTH a díky tomu i endogenní kortizol)
- periferní forma – pokud je sekrece kortizolu autonomní (např. adenom nadledviny), ACTH je již suprimované a dexametazon má jen minimální efekt.
- centrální forma – pokud je sekrece kortizolu řízena vysokou hladinou ACTH (např. Cushingova choroba), je suprese dexametazonem v nízké dávce neúčinná, účinnou se stává až po aplikaci vysoké dávky.
- paraneoplastický Cushongův syndrom – při produkci ACTH tumorem nedochází k supresi kortizolu ani vysokou dávkou dexametazonu.
ACTH stimulační test – při diagnostice deficitu glukokortikoidů. ACTH obsahuje 39 aminokyselin, biologicky účinných je prvních 24, standardně se podává kosyntropin (řetězec ACTH 1 – 24) v dávce 0,25 mg i.m. nebo i.v. a poté se v čase 0, 30 a 60 minut odebírá krev na stanovení hladiny kortizolu. Norma je ˃ 200 μg/l nebo nárůst o ˃ 100 μg/l nad bazální hodnotu Bezpečnější verzí je podání nízké dávky kosyntropinu (1 μg i.v.) k zábraně hyperstimulace nadledvin.
Inzulinový toleranční test – při diagnostice deficitu glukokortikoidů. Podává se inzulín i.v. k indukci hypoglykémie, která je výrazným stimulem sekrece hypotalamického CRH s aktivací osy hypothalamus – hypofýza – kůra nadledvin. Podává se inzulin v dávce 0,1 U/kg (dávka by měla být nižší při současném hypopituitarismu) a poté se v čase 0, 30, 60 a 120 minut odebírá krev na stanovení hladiny glukózy, kortizolu a růstového hormonu (norma je ˃ 200 μg/l kortizolu a ˃ 5,1 μg/l růstového hormonu). Při dosažení symptomů hypoglykémie (většinou < 2,2 mmol/l) by měla být podána glukóza. Kontraindikace: ICHS, cerebrovaskulární choroba a epilepsie (zde by měl být proveden pouze kosyntropinový test).
Mineralokortikoidy
Syntéza mineralokortikoidů je regulována renin-angiotensin-aldosteronovým systémem (RAAS), který je zahájen uvolněním reninu z juxtaglomerulárních buněk ledvin, který stimuluje štěpení angiotensinogenu na angiotensin I v játrech. Angiotensin konvertující enzym (ACE) štěpí angiotensin I na angiotensin II, který se váže a tak i aktivuje receptor 1 pro angiotensin II (AT1 receptor), což vede ke zvýšení produkce aldosteronu a vazokonstrikci. Aldosteron působí zvýšenou retenci sodíku a exkreci draslíku, dále zvyšuje arteriální perfúzní tlak, který zpětnovazebně inhibuje uvolnění reninu.
CAVE Syntéza mineralokortikoidů je primárně pod kontrolou RAAS, proto ani při poškození hypothalamu nebo adenohypofýzy nedochází k potlačení jejich sekrece.
Při nadbytku mineralokortikoidů dochází zpětnovazebně k supresi sekrece reninu a naopak. Fyziologicky po intravenózním nebo perorálním podání sodíku následuje suprese sekrece aldosteronu. Při autonomní sekreci mineralokortikoidů tato suprese nenastane.
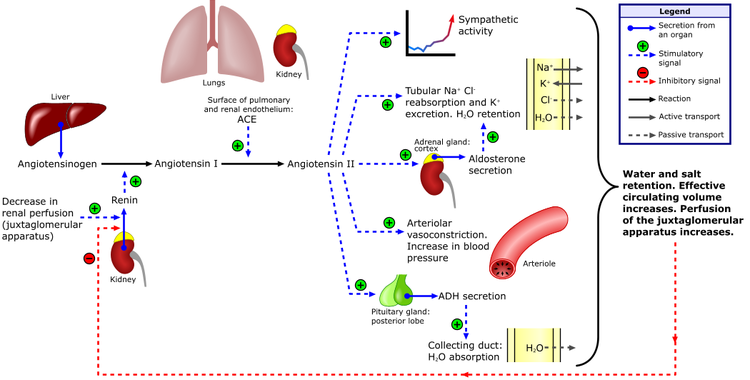
K syntéze mineralokortikoidů je potřeba progesteron, ze kterého vzniká deoxykortikosteron (pomocí 21-hydroxylázy, CYP21A2), ze kterého vzniká postupně kortikosteron, 18-hydroxykortikosteron a aldosteron (všechny tři kroky pomocí aldosteron syntázy, CYP11B2).
- Dexykortikosteron se také váže na mineralokortikoidní receptor. Při nedostatku 11β-hydroxylázy se deoxykortikosteron akumuluje a může způsobit nadbytek mineralokortikoidů.
- Kortikosteron vykazuje glukokortikoidní aktivitu (i když mnohem menší než kortizol). Proto u pacientů s deficitem 17-hydroxylázy vyšší hladina kortikosteronu (jako důsledek enzymatického bloku) částečně kompenzuje nedostatek kortizolu.
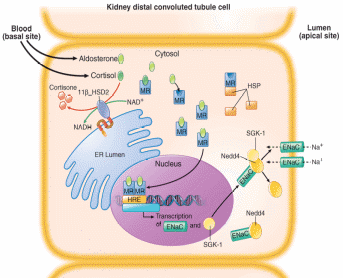
- Kortizol a aldosteron se váží na mineralokortikoidní receptor se stejnou afinitou, kortizol ale cirkuluje v 1000x vyšší koncentraci. Proto je pouze rapidní inaktivace kortizolu na kortizon (pomocí 11β-hydroxysteroid dehydrogenázy typu 2 – zejména v ledvinách, probíhá ale i v tlustém střevě, slinných žlázách i ostatních tkáních) prevencí hyperaktivace mineralokortikoidního receptoru kortizolem.
Aktivovaný mineralokortikoidní receptor zesiluje transkripci ENaC (epiteliální sodíkový kanál)
a koncentraci sérové kinázy indukované glukokortikoidy typu 1 (SGK-1). V cytosolu interaguje ENaC s Nedd4, což zabraňuje přehnané expresi ENaC na buněčném povrchu. Rezidua serinu, která jsou fosforylována SGK-1 redukují interakci mezi Nedd4 a ENaC a zvyšují expresi ENaC na povrchu buňky a tím i účinek mineralokortikoidů (retenci sodíku).
Adrenální androgeny
Syntéza adrenálních androgenů je glukokortikoidů je pod zpětnovazebnou kontrolou hypothalamu a hypofýzy. K syntéze adrenálních androgenů je potřeba pregnenolon, ze kterého vzniká 17-hydroxypregnenolon a následně dehydroepiandrosteron – DHEA (oba kroky pomocí 17α hydroxylázy/17,20 lyázy, CYP17A1). Většina DHEA se nadledvinách konvertuje na ester dehydrepiandrosteron-sulfát – DHEAS (pomocí sulfotransferázy, SULT2A1).
Choroby kůry nadledvin
Cushingův syndrom
Definice – soubor příznaků, který vzniká v důsledku nadbytku glukokortikoidů (ACTH dependentní, independentní nebo iatrogenní). Cushingova choroba – Cushingův syndrom v důsledku kortikotropního adenomu hypofýzy. Cushingův syndrom byl poprvé popsán Harvey Cushingem v roce 1912.
Epidemiologie – incidence neiatrogenního Cushingova syndromu je 1: 50 – 100 tisíc ročně. Primárně adrenální Cushingův syndrom (pouze 10 % všech případů) je častější u žen, Cushingova choroba je častější u žen (v dětském věku častěji postihuje chlapce), ektopická produkce je častější u mužů.
Etiologie
- 1. ACTH dependentní
- Cushingova choroba – v 90 % kortikotropní mikroadenom hypofýzy (< 1 cm v průměru), v 10 % makroadenom hypofýzy (˃ 1 cm v průměru). Většinou solitární nález, velice vzácně v rámci syndromu MEN 1.
- ektopicky vznikající – většinou karcinoid (nejčastěji plicní, ale i v thymu a pankreatu), malobuněčný karcinom plic, vzácně medulární karcinom štítné žlázy nebo feochromocytom.
- 2. ACTH independentní
- adenom nadledvin – nejčastěji
- karcinom nadledvin – vzácné, často veliké s produkcí více tříd kortikosteroidů
- AIMAH (ACTH – independent macronodular adrenal hyperplasia) – velmi vzácná ektopická exprese receptorů, které se obvykle v nadledvinách nevyskytují (LH, vasopresin, serotonin, interleukin-1, gastrický inhibiční peptid – příčina Cushingova syndromu, souvisejícího s jídlem). Aktivace těchto receptorů zvyšuje aktivitu proteinkinázy A (podobně jako fyziologicky při účinku ACTH) s následným zvýšením produkce kortizolu.
- PPNAD (primary pigmented nodular adrenal disease – mikro nebo makronodulární) je způsobena mutací regulační podjednotky PKA (PRKAR1A), jako součást Carneyho komplexu (AD dominantní): kožní příznaky (hyperlentiginosis) + nádory (srdeční a kožní myxomy, nádory ze Sertoliho buněk) + endokrinopatie (např. PPNAD).
- McCune – Albrightův syndrom – Cushingův syndrom + unilaterální cafe-au-lait skvrny + pubertas praecox + polyostotická fibrózní dysplazie, vzniká důsledkem hyperfunkční mutace v lokusu GNAS-1 (guanin nucleotide binding protein alpha stimulating activity polypeptide 1).
- iatrogenní – terapeutickým podáním glukokortikoidů



| Příčina Cushingova syndromu | Poměr muži : ženy | % |
| ACTH dependentní Cushingův syndrom | 90% | |
| Cushingova choroba (ACTH produkující adenom hypofýzy) | 4:1 | 75% |
| Ektopická produkce ACTH | 1:1 | 15% |
| ACTH independentní Cushingův syndrom | 4:1 | 10% |
| Adrenokortikální adenom | 5 – 10 % | |
| Adrenokortikální karcinom | 1% | |
| Vzácné příčiny (PPNAD, AIMAH, McCune – Albrightův syndrom) | ˂ 1 % |
Patofyziologie
- 1. Nadbytek glukokortikoidů mimo jiné překonává schopnost inaktivace kortizolu na kortizon (pomocí 11β-hydroxysteroid dehydrogenázy), je tím zvýšena i vystupňovaná mineralokortikoidní aktivita (diastolická hypertenze, hypokalémie a otoky).
- 2. Nadbytek glukokortikoidů inhibuje sekreci
- gonadotropinů se vznikem hypogonadismu a amenorhey.
- TSH se vznikem hypothyreoidismusy.
Klinický obraz – při ektopické sekreci ACTH (většinou tumor) nebo karcinomu nadledvin mohou příznaky vznikat velice rychle:
- Kardiální – zvýšené kardiovaskulární riziko a diastolická hypertenze.
- Metabolické – obezita, diabetes mellitus se zvýšenou inzulinorezistenci.
- Endokrinologické – hirsuitismus, hypothyreoidismus.
- Psychiatrické – úzkost, deprese.
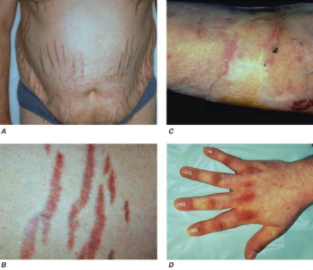
- Kožní – fragilita kůže s tendencí ke vzniku modřin, široké (˃ 1 cm) fialové kožní strie. Při ACTH dependentním Cushingově syndromu se objevují charakteristické hyperpigmentace (klouby, jizvy a oblasti exponované Slunci) pro zvýšenou hladinu melanin stimulujícího hormonui (součást proopiomelanokortinu), měsíčkovitý obličej.
- Skeletální – osteoporóza s vysokým rizikem fraktur (zejména obratlů).
- Svalové – proximální myopatie – obtížné postavení ze sedu na židli.
- Hematologické – hyperkoagulační stav s rizikem hluboké žilní trombózy a plicní embolie
| Orgánový systém | Klinické příznaky |
| Tělesný tuk | váhový přírůstek, centrální obezita, oválný obličej, býčí šíje (tuk v oblasti šíje) |
| Kůže | obličejová pletora, tenká a křehká kůže, tendence k modřinám, široké fialové strie, akné, hirsuitismus |
| Kost | osteoporóza (tendence k frakturám páteře), snížený růst u dětí |
| Svaly | slabost, proximální myopatie (atrofie gluteálních a stehenních svalů) |
| Kardiovaskulární systém | hypertenze, hypokalémie, edém, ateroskleróza |
| Metabolismus | diabetes mellitus, hyperlipidémie |
| Reprodukční systém | snížené libido, amenorea u žen (inhibice gonadotropinů) |
| Centrální nervový systém | dráždivost, emoční labilita, deprese, v těžkých případech paranoidní psychózy |
| Krev a imunitní systém | snížená obranyschopnost, leukocytóza, eosinopenie, hyperkoagulační stav |
Diagnostika
- 1. Vyslovení podezření na Cushingův syndrom
- 2. Vyloučení iatrogenního Cushingova syndromu
- 3. Potvrzení nadbytku glukokortikoidů
- 24 hodinový sběr moči na volný kortizol ve třech odlišných vzorcích
- LDDST (low-dose dexamethasone suppression test) – plazmatická hladina kortizolu ˃ 50 nmol/l v 8:00 po podání 1 mg dexamethazonu ve 23:00 předchozí den. Nutno vysadit induktory CYP3A4 (antiepileptika, rifampicin), které rychle inaktivují dexametazon a vysadit antikoncepční pilulky (zvyšují hladinu CBG a tak i celkového kortizolu může způsobit selhání suprese po podání dexametazonu. V případě pochybností je vhodné zopakovat testování po 4 – 6 týdnech po vysazení antikoncepce).
- 4. Zjištění hladiny ACTH
- snížená – hladina ACTH je zpětnovazebně suprimována vysokou hladinou kortizolu, který je syntetizován autonomně – ACTH independentní Cushingův syndrom. Indikováno:
- CT nadledvin
- normální nebo zvýšená – autonomní sekrece ACTH při ACTH dependentním Cushingově syndromu. Indikováno:
- MR hypofýzy (ve 40 % je výsledek falešně negativní, protože velikost adenomu je pod rozlišovací schopností přístroje). Typicky se kortikortropní adenomy hypofýzy v T1-vážených sekvencích nesytí gadoliniem.
- HDDST (high-dose dexamethasone suppression test) – suprese hladiny kortizolu o méně než 50 % po podávání 2 mg dexametazonu á 6 hodin po dobu 2 dnů. Při ektopické produkci ACTH (nádory) nedochází ani po vysokých dávkách glukokortikoidů k supresi hladiny (existují i výjimky), u kortikotropního adenomu hypofýzy vysoké dávky glukokortikoidů suprimují hladinu ACTH.
- IPSS (inferior petrosal sinus sampling – bilaterální katetrizace sinus petrosus inferioris), při které se zjišťuje hladina ACTH v krvi z obou petrózních sinů a z periferní krve. Před vyšetřením by neměl být užíván žádný inhibitor steroidogeneze. Poměr hladiny ACTH v centrální : periferní plasmě ˃ 2 bazálně a ˃ 3 po stimulaci CRH potvrzuje Cushingovu chorobu s vysokou senzitivitou.
- Při podezření na ektopický zdroj ACTH je indikována jeho identifikace (CT hrudníku a břicha k posouzení přítomnosti tumoru plic, thymu a pankreatu, MRI hrudníku indikováno při negativitě CT, kde karcinoid vykazuje zvýšený signál v T2-vážených sekvencích, oktreotidová scintigrafie – tumory produkující ACTH často exprimují somatostatinové receptory).
- snížená – hladina ACTH je zpětnovazebně suprimována vysokou hladinou kortizolu, který je syntetizován autonomně – ACTH independentní Cushingův syndrom. Indikováno:
Terapie – před chirurgickým výkonem musí být pacient kompenzován (těžká hypokalémie, hypertenze, akutní psychóza). Postupy:
- ACTH independentní Cushingův syndrom – indikováno chirurgické odstranění tumoru nadledviny.
- ACTH dependentní Cushingův syndrom
- Cushingova choroba – chirurgické odstranění adenomu hypofýzy (nejčastěji transsfenoidálním přístupem) s úvodní úspěšností 75 – 80 %. Po různé době ale dochází u řady pacientů k relapsu choroby s řadou možností další léčby (reoperace, radioterapie, stereotaktická radiochirurgie, bilaterální adrenalektomie) s nutným individuálním přístupem.
- ACTH produkující tumor – odstranění primárního tumoru, v případě, že nelze odstranit nebo identifikovat, je možná bilaterální adrenalektomie nebo farmakoterapie.
- Farmakoterapie indikováno při inoperabilitě nebo odmítnutí operace ze strany pacienta:
- metyrapon – inhibuje 11β-hydroxylázu (počáteční dávka 3x denně 500 mg, maximální dávka 6000 mg).
- ketokonazol – inhibuje časná stádia steroidogeneze (počáteční dávka 3x denně 200 mg, maximální dávka 1200 mg)
- mitotan – derivát insekticidu o,p´DDD s adrenolytickým efektem. Pro své nežádoucí účinky je nejčastěji užit k léčbě adrenokortikálního karcinomu.
- mifepriston – antagonista glukokortikoidního receptoru typu II, který se používá i jako abortivum.
Po úspěšném odstranění tumoru (produkujícího ACTH nebo kortizol) je ihned nutné zahájení substituce glukokortikoidů s postupnou detrakcí (navyknutí organismu na normální hladinu glukokortikoidů). V závislosti na délce a závažnosti poruchy je nutné podávat substituci měsíce až roky.
Prognóza – pokud není Cushingův syndrom léčen, má špatnou prognózu.
Choroby spojené s nadbytkem mineralokortikoidů
Epidemiologie – nadbytek mineralokortikoidů je zjištěn u 5 – 12 % pacientů s hypertenzí.
Etiologie
- 1. Primární hyperaldosteronismus – zvýšená produkce aldosteronu v zona glomerulosa:
- adrenokortikální adenom (Connův syndrom).
- bilaterální mikronodulární adrenální hyperplázie – častěji bilaterálně než unilaterálně.
- adrenokortikální karcinom – velmi vzácné, zejména u mladších pacientů a při velikosti tumoru ˃ 1 cm).
- 2. Ostatní příčiny
- GRA (glukokortikoidy odstranitelný hyperaldosteronismus), který je způsobený chimérickým genem (translokace sekvencí promotoru mezi CYP11B1 a CYP11B2) s postižením syntézy glukokortikoidů a mineralokortikoidů. Toto přesunuje CYP11B2 pod kontrolu ACTH receptoru (syntéza aldosteronu je tedy regulována ACTH a ne reninem). Je vysoké riziko časného výskytu hypertenze a cévních mozkových příhod. Suprese ACTH (podání glukokortikoidů) redukuje i syntézu aldosteronu, léčbou volby je tedy dexametazon.
- AME (syndrom zdánlivého nadbytku mineralokortikoidů) – deficit 11β-hydroxysteroid dehydrogenázy typu 2 s těžkou hypertenzí s hypokalémií v dětství, léčí se spironolaktonem. K inhibici 11β-HSD2 dochází i po požití nadměrného požití lékořice (zejména u pacientů s Cushingovým syndromem).
- zvýšená hladina deoxykortikosteronu
- nadměrná syntéza při adrenokortikálním karcinomu.
- kongenitální adrenální hyperplazie při deficitu 11β-hydroxylázy a 17α-hydroxylázy.
- mutace podjednotky β a γ ENaC – dochází k porušení interakce s Nedd4 s následným porušením internalizace a degradace ENaC. Konstitutivní aktivace ENaC je je autozomálně dominantně dědičná a nazývá se Liddleův syndrom.
Klinický obraz – zvýšenou aktivací ENaC:
- Metabolismus– zvýšená retence sodíku s expanzí extracelulárního prostoru (hypertenze), zvýšené vylučování draslíku (hypokalémie), zvýšené vylučování vodíku (metabolická alkalóza) s křečemi.
- Srdce – hypertenze a remodelace myokardu s nárůstem diastolické dysfunkce.
- Ledviny – přímé poškození glomerulů, sekundárně nefroskleróza při hypertenzi.
Podezření na nadbytek mineralokortikoidů je nutné mít u pacientů s hypertenzí a hypokalémií. Hladina sodíku bývá normální (vyrovnána zvýšenou retencí tekutin).Hypokalémie bývá precipitována nasazením thiazidů do medikace, protože do distálního tubulu proudí více sodíku, které proto vytváří vyšší gradient v tubulu s následným vyloučením vyššího množství draslíku.
Diagnostika primárního hyperaldosteronismu dle České společnosti pro hypertenzi 2015: (dostupné online: http://www.hypertension.cz/sqlcache/zelinka-38-ht-a-kv-prevence-2017.pdf)
- 1. Podezření na primární hyperaldosteronismus – při rezistentní hypertenzi, zejména při spontánní hypokalémií, v mládí a při průkazu expanze nadledvin.
- 2. Stanovení poměru aldosteron:renin v plazmě (je již odklon od plazmatické reninové aktivity). Cut off hodnota je 5,7 (ng/l/ng/dl) resp. 144 (ng/l/pmol/l).
- před odběrem je nutné vynechání přípravků obsahujících lékořici (pendrek, žvýkací tabák).
- optimální je vysazení spironolaktonu 6 týdnů, ostatních diuretik 4 týdny a ostatních léků (včetně NSAID) 2 týdny před provedením testu. Doxazosin a verapamil s RAAS neinterferují a je možné na ně pacienty převést. U žen je vhodné na dva cykly vysadit HAK a optimálně po ukončení menstruace. Kalémie je vhodné zkorigovat na 4 mmol/l i za cenu vyšších substitučních dávek draslíku.
- odběr se provádí na lačno ráno dopoledne vsedě (po 5–10 min sedu) po nejméně 60–90 min vertikalizace (sed, stoj, chůze). Vzorek je nutné transportovat při pokojové teplotě.
- u rizikových pacientů (po iktu, infarktu myokardu) je možné vysazení pouze diuretik a spironolaktonu, při dřívějším nasazení není nutné pacienta již dále vyšetřovat a je vhodné posoudit pouze efekt spironolaktonu. Podobně není nutné vysazovat spironolakton u pacientů vyššího věku.
![Faktory, které ovlivňují poměr (ARR) aldosteron/plazmatická reninová aktivita (PRA) nebo renin a mohou vést k falešně pozitivním a falešně negativním výsledkům.
Upraveno dle [21].](https://pl-master.mdcdn.cz/media/cache/media_object_image_large/media/image/1b2c1793ce7369a711407fc84724f2b2.png)
- 3. Konfirmační testy – při jasném podezření (hypertenze, hypokalémie, suprese reninu, plazmatický aldosteron > 20ng/dl) nejsou konfirmační testy nutné. Jejich principem je expanze plazmatického objemu, která by za fyziologického stavu měla potlačit produkci reninu, a tím vést ke snížení koncentrace aldosteronu. Toto u primárního hyperaldosteronismu chybí. Vždy by měla být normalizována hyperkalémie (riziko suprese hladiny aldosteronu s falešně negativním výsledkem).
- Test s fyziologickým roztokem – nejčastější test. Po 1 hodině vleže se odebere renin, aldosteron, poté se podá 2000 ml fyziologického roztoku během 4 hodin a následně se odběr zopakuje. Při koncentraci aldosteronu pod 5 ng/ dl po infuzi je primární hyperaldosteronismus nepravděpodobný, při koncentraci nad 10 ng/ dl je test pozitivní, hodnoty mezi 5 a 10 ng/ dl představují tzv. šedou zónu. Test by neměl být prováděn u pacientů s renální insuficiencí, srdečním selháním, těžkou hypokalemií. Alternativou je test perorální zátěží sodíkem (17,5 g NaCl denně po dobu 3 dnů).
- Fludrokortizonový test – nejcitlivější, nevýhodou je, že vyžaduje několikadenní hospitalizaci, má komplikovaný protokol, nezanedbatelné riziko hyperkalemie a výrazné elevace krevního tlaku.
- Kaptoprilový test – méně spolehlivý.
- při pozitivitě:
- 4. CT nadledvin s kontrastem – pokud pacient nesouhlasí s operací, tak zahájení léčby antagonisty mineralokortikoidního receptoru (spironolakton, eplerenon).
- 5. Separované odběry z nadledvinových žil – indikováno u kandidátů adrenalektomie, u kterých nebyla zjištěna žádná zjevná patologie na CT nadledvin nebo u pacientů u pacientů starších 40 let s jednostrannou lézí (vysoké riziko, že tato léze je hormonálně neaktivní incidentalom). Stanovuje se hladina aldosteronu ve v. cava inferior a pravé a levé nadledvinné žíle, dále kortizol (potvrzuje správné uložení katetru – gradient mezi hladinou kortizolu v nadledvinné žíle a v. cava inferior je > 3). Test je pozitivní při nálezu alespoň dvounásobného zvýšení hladiny oproti druhé straně.
- při unilaterální nadprodukci je indikovaná laparoskopická adrenalektomie.
- při bilaterální nadprodukci je indikováno zahájení léčby antagonisty mineralokortikoidního receptoru (spironolakton, eplerenon).
Terapie
- Chirurgický výkon – indikace – pacient ˂ 40 let s potvrzeným nadbytkem mineralokortikoidů a prokázanou jednostranná lézí, prokázaná jednostrannou zvýšená produkce mineralokortikoidů (dle selektivní katetrizace nadledvinových žil). Metodou volby je laparoskopická adrenalektomie.
- Farmakoterapie
- spironolakton – antagonista mineralokortikoidního receptoru. Počáteční dávka 12,5 – 50 mg/den, s možnou titrací až na 400 mg/den. Nežádoucí účinky – nepravidelnost menstruačního cyklu, snížené libido, gynekomastie. Mimo jiné se antagonisty mineralokortikoidního receptoru léčí AME.
- eplerenon – ještě senzitivnější antagonista mineralokortikoidního receptoru – počáteční dávka 25 mg 2x denně, s možnou titrací až na 200 mg/den.
- amilorid – blokátor sodíkového kanálu, vhodný u pacientů s Liddleovým syndromem. Dávka 5 – 10 mg 2x denně.
- dexametazon – u pacientů s GRA. Užívá se nejnižší možná dávka, která odstraní hypertenzi. Někdy je nutno přidat antagonistu aldosteronu.
Adrenální insuficience
Epidemiologie – prevalence 1:2000 (60 % centrální typ, 40 % periferní typ). Cca 1 % populace má adrenální insuficienci sekundárně při léčbě glukokortikoidy.
Etiologie
- I. Primární adrenální insuficience
- 1. Autoimunitní adrenalitida
- izolovaná forma (1/3 případů)
- součást autoimunitního polyglandulárního syndromu APS (2/3 případů)
- APS1- AR dědičná mutace AIRE genu. Triáda adrenální insuficience + primární hypoparathyreoidismus + chronická mukokutánní kandidóza (manifestuje se v dětství a předchází adrenální insuficienci o roky až desetiletí) a někdy lymfom nebo totální alopecie.
- APS2 – polygenní dědičnost s výraznou afinitou k HLA-DR3 (např. geny CTLA-4, PTPN22, CLEC16A). riáda adrenální insuficience + autoimunitní thyreoiditida + diabetes mellitus I. typu, někdy vitiligo, předčasné ovariální selhání nebo perniciózní anémie z nedostatku vitamínu B12.
- 2. X-dědičná adrenoleukodystrofie – incidence 1:20 tisíc, X-vázaná dědičnost (postiženi jsou zejména muži). Mutace X-ALD genu, který kóduje transportér peroxizomální membrány ABCD1, jehož porucha vede k akumulaci mastných kyselin o velmi dlouhém řetězci (> 24 C). Má tři klinické formy:
- mozková forma (50 %) – rychle progredující porucha bílé hmoty mozkové
- adrenomyeloneuropatie (35 %) – postižení myelinu centrálního a periferního nervového systému, které se projevuje v adolescenci.
- izolovaná adrenální insuficience (15 %)
- 3. Ostatní vzácné vrozené příčiny – mutace regulátorů steroidogeneze (DAX-1, SF-1), syntézy cholesterolu (DHCR7, StAR, CYP11A1) a adrenálních signálních cest ACTH (MC2R, MRAP).
- 4. Ostatní získané příčiny – infekce, krvácení, infiltrace, metastázy do nadledvin, tuberkulózní adrenalitida (častá v rozvojových zemích).
- 1. Autoimunitní adrenalitida
| Diagnóza | Gen | Příznaky |
| APS1 | AIRE | chronická mukokutánní kandidóza, hypoparathyreoidismus, adrenální insuficience, vzácně lymfom |
| APS2 | asociace s HLA-DR3, CTLA-4 | hypothyreoidismus, adrenální insuficience, diabetes mellitus I. typu, předčasné ovariální selhání, vitiligo, perniciózní anémie |
| Izolovaná autoimunitní adrenalitida | asociace s HLA-DR3, CTLA-4 | |
| Kongenitální adrenální hyperplázie | CYP21A2, CYP11B1, CYP17A1, HSD3B2, POR | |
| Kongenitální lipoidní adrenální hyperplazie | StAR, CYP11A1 | 46, XY DSD, selhání gonád |
| Kongenitální adrenální hyperplazie | NROB1 (DAX-1), NR5A1 (SF-1) | |
| Adrenoleukodystrofie | ||
| Adrenomyeloneuropatie | X-ALD | demyelinizace nervů |
| Familiární deficit glukokortikoidů | M2CR | insenzitivita nadledvin na ACTH díky mutace genu pro receptor MC2R nebo akcesorní protein MRAP |
| – FGD1 | MRAP | |
| – FGD2 | ? | |
| – FGD3 | AAAS | |
| – triple A syndrome | Achalazie + Alakrimie + Addisonismus | |
| Smith-Lemli-Opitz syndrom | SLOS | porucha syntézy cholesterolu s mentální retardací, poruchou růstu a kraniofaciální malformací |
| Kearns – Sayre syndrome | Delece mitochondriální DNA | progresivní externí oftalmoplegie, pigmentová degenerace sítnice, poruchy vedení vzruchu v srdci, hypogonadismus, hypoparathyreoidismus, diabetes mellitus I. typu |
| IMAGEs syndrome | ? | intrauterinní porucha růstu, dysplazie metafýz kostí, anomálie genitálu |
| Adrenální infekce | TBC, HIV, CMV, kryptokokóza, histoplazmóza, kokcidiomykóza | |
| Adrenální infiltrace | metastázy, lymfomy, sarkoidóza, amyloidóza, hemochromatóza | |
| Adrenální krvácení | Waterhouse – Friderichsenův syndrom, primární antifosfolipidový syndrom | |
| Polékové | mitotan, etomidát, ketokonazol, aminoglutethimid, arbirateron, trilostan, suramin, RU486 | |
| St.p. bilaterální adrenalektomii | např. terapie Cushingovy choroby nebo po bilaterální nefrektomii |
- II. Sekundární adrenální insuficience – postižena je osa hypothalamus – hypofýza – nadledviny.
- 1. Tumory hypofýzy a hypothalamu – vlastními tumory a následkem jejich léčby.
- 2. Hypofyzární apoplexie – prokrvácení infarzovaného adenomu nebo následkem přechodné perioperační hypoperfuze hypofýzy. Jako Sheehanův syndrom se označuje následek výrazné ztráty krve při porodu.
- 3. Izolovaný deficit ACTH – vzácně jako následek autoimunitního postižení nebo infiltrace hypofýzy.
- 4. Deficit POMC
- 5. Náhlé přerušení chronické léčby glukokortikoidy
| Diagnóza | Gen | Příznaky |
| Tumory hypofýzy (adenom, velice vzácně karcinom) | závisí na lokalitě a velikosti tumoru: bilaterální hemianopsie, hyperprolaktinémie, sekundární hypothyreoidismus, hypogonadismus, deficit růstového hormonu | |
| ostatní masy postihující hypothalamus nebo hypofýzu | kraniofaryngeom, meningeom, ependymom, metastázy | |
| Ozáření hypofýzy | většinou terapeutická radioterapie z onkologické indikace | |
| Autoimunitní hypofyzitida | často asociovaná s těhotenstvím, může se projevit panhypopituitarismem nebo izolvaným defictem ACTH | |
| Hypofyzární apoplexie | prokrvácení infarzovaného adenomu, následkem přechodného perioperační perfuze hypofýzy, Sheehanův syndrom – následek výrazné ztráty krve při porodu | |
| Infiltrace hypofýzy | TBC, aktimomykóza, sarkoidóza, histiocytóza X, granulomatóza s polyangitidou, metastázy do hypofýzy | |
| Polékové | chronická léčba glukokortikoidy | |
| Kongenitální izolovaný deficit ACTH | TBX19 (Tpit) | |
| Kombinovaný deficit hypofyzárních hormonů (CPHD) | PROP-1 | progresivní deficit hypofyzárních hormonů v pořadí: GH, PRL, TSH, LH/FSH, ACTH |
| HESX1 | CPHD + septo-optická dysplázie | |
| LHX3 | CPHD + limitovaná rotace krku, sensoneurická hluchota | |
| LHX4 | CPHD + mozečkové poruchy | |
| SOX3 | CPHD + variabilní mentální retardace | |
| Deficit proopiomelanokortinu | POMC | časná obezita, červené vlasy |
Klinický obraz – při adrenální insuficienci je vždy ztráta sekrece glukokortikoidů i adrenálních androgenů. V případě primární se přidává i ztráta mineralokortikoidů, v případě sekundární formy je i časté postižení regulace ostatních endokrinních os (štítná žláza, gonády, růstový hormon, prolaktin) nebo bitemporální hemianopsie při útlaku chiasma opticum. Nutná zábrana náhlého přerušení terapie glukokortikoidy (nutná postupná detrakce dávek).
| Příznaky deficitu glukokortikoidů |
| slabost, nedostatek energie |
| váhový úbytek, nechutenství |
| bolesti svalů a kloubů |
| hypotenze |
| horečka |
| hyponatrémie |
| anemie, ↑eozinofily a lymfocyty |
| lehká elevace TSH |
| hypoglykémie (častější u dětí) |
| Příznaky deficitu mineralokortikoidů |
| slabost, vertigo |
| bolesti břicha, nauzea, zvracení |
| hypotenze |
| touha po soli |
| zvýšení kreatininu (hypovolémie) |
| hyponatrémie |
| hyperkalémie |
| Příznaky deficitu adrenálních androgenů |
| slabost, nedostatek energie |
| suchá, svědící kůže (u žen) |
| ztráta libida (u žen) |
| ztráta axilárního a pubického ochlupení (u žen) |
| Ostatní příznaky |
| hyperpigmentace (pouze u primární formy pro nadbytek POMC) |
| bledá, alabastrová kůže (pouze u sekundární formy pro nedostatek POMC) |
Chronická adrenální insuficience – nespecifické příznaky, proto bývá diagnóza často opožděná (slabost, nedostatek energie). U primární adrenální insuficience hyperpigmentace oblastí, které jsou exponovány tření, střižným silám nebo Slunci (nadbytek POMC), naopak u u sekundární adrenální insuficience je kůže bledá, alabastrová kůže (nedostatek POMC, tzv. bílí Addisoni).
Akutní adrenální insuficience – většinou se objevuje po delší periodě nespecifických příznaků, častěji u pacientů s primární adrenální insuficiencí. Bývá spuštěna stresovou situací (infekce, operační výkon nebo další inaktivace glukokortikoidů – hyperthyreoidismus). Mezi příznaky patří posturální hypotenze, která progreduje do hypovolemického šoku a někdy připomíná neurologickou chorobu (sopor až kóma). Může imitovat náhlou příhodu břišní (nauzea, zvracení, horečka).
Diagnostika
- 1. Laboratorní nálezy
- hyponatrémie – u 80 % pacientů, nejčastěji u primární formy při deficitu mineralokortikoidů, mírná hyponatrémie je ale i u sekundární formy, kdy je sekrece mineralokortikoidů sice zachována (není řízena ACTH, ale RAAS), ale nedostatek kortizolu vede k menší inhibici ADH (vzniká tedy mírná forma SIADH).
- hyperkalémie – 40 % pacientů.
- elevace TSH – glukokortikoidy inhibují sekreci TSH, jejich nedostatek tedy sekreci TSH zvyšuje.
- stanovení hladiny kortizolu během dne má omezený význam (pouze při podezření na adrenální krizi), protože může být náhodně zachycena nízká hladina na základě diurnálního kolísání, na druhou stranu u pacientů se sekundární adrenální insuficiencí může být hladina kortizolu normální, ale selhává její zvýšení na základě stresového stimulu.
- ACTH – stanovujeme vždy při potvrzení adrenální insuficience. Nadměrná hladina je při primární formě, nízká hladina při sekundární formě.
- Renin – zvýšený při nedostatku mineralokortikoidů při primární formě.
- Testy na přítomnost protilátek proti nadledvinám – pozitivní při autoimunitní příčině primární formy. Primární při negativitě je u mužů indikováno stanovení hladiny mastných kyselin s velmi dlouhým řetězcem k vyloučení adrenoleukodystrofie
- 2. Funkční testy
- Krátký kosyntropinový test – posuzuje reaktivitu zona fasciculata na exogenně podaný ACTH. Výsledek je pozitivní v případu hladiny kortizolu ˂ 550 nmol/l za 30 – 60 minut po podání kosyntropinu (analog ACTH). Během časné fáze poškození osy hypothalamus – hypofýza – nadledvina (první 4 týdny trvání hypopituitarismu) může zůstat určitá reaktivita na exogenní stimulaci ACTH s následným rizikem falešně negativního výsledku.
- Inzulinový test – posuzuje reaktivitu zona fasciculata na velmi silný stresový stimul, kterým je hypoglykémie (cílem je glykémie pod 2,2 mmol/l). Kontraindikován u pacientů s diabetes mellitus, ischemickou chorobou srdeční a anamnézou epilepsie.
- 3. Zobrazovací metody
- při průkazu primární adrenální insuficience a negativitě testu na autoprotilátky indikováno CT nadledvin (zejména při podezření na krvácení, infiltraci nebo tumor).
- při průkazu adrenální insuficience s nízkou/normální hladinou ACTH indikováno MRI hypothalamu a hypofýzy
Terapie
- substituce glukokortikoidů – při substituci glukokortikoidů musí být respektována bazální potřeba glukokortikoidů v organismu: 15 – 25 mg hydrokortizonu rozdělené do 2 – 3 dávek denně (50 % denní dávky se podává ráno, 25 % v poledne a večer). Glukokortikoidy o delším biologickém poločasu (prednisolon, dexametazon) nejsou k substituci vhodné, protože díky dlouhé době účinku nelze simulovat diurnální rytmus. Modifikace:
- dávka při tělesné teplotě 37 – 38oC – 2x vyšší
- 38 – 39oC – 3x vyšší
- nad 39oC – hospitalizace a podávání i.v. substituce
- dávka při posledním trimestru těhotenství – 1,5x vyšší
Ekvivalence glukokortikoidů: 20 mg hydrokortison = 5 mg prednison = 4 mg methylprednisolon = 0,75 mg dexametazon = 0,6 mg betametazon
Monitorace substituce glukokortikoidů je většinou založena na známkách hypo- nebo hyperkortizolémie (včetně tělesné hmotnosti a krevního tlaku). Hladina ACTH, 24hodinový sběr moči na kortizol nebo denní křivka kortizolémie neříká nic o adekvátnosti substituce. U izolované primární adrenální insuficience je nutno monitorovat štítnou žlázu (autoimunitní thyreoiditida) a u žen pohlavní hormony (předčasné ovariální selhání). Při léčbě suprafyziologickými dávkami glukokortikoidů (ekvivalent 30 mg hydrokortizonu a více) by měla být pravidelná kontrola kostní denzity.
Všichni pacienti musí být instruování o nutnosti navýšení substituční dávky při jakémkoliv stresu (horečka, trauma, operace). Při cestě do odlehlých oblastí by měli být vybaveni self-injection emergency kitem a kartičkou s upozorněním.
- substituce mineralokortikoidů – při primární adrenální insuficienci je základní substituční dávka 100 – 150 μg fludrokortizonu denně. U pacientů, kteří cestují do teplých krajů by měla denní dávka navýšena o 50 – 100 μg. Progesteron má antimineralokortikoidní účinky, proto by během těhotenství měla být zvýšena substituční dávka. Během těhotenství nelze použít reninovou akti vitu jako marker adekvátnosti terapie, protože reninová aktivita stoupá během těhotenství fyziologicky. Adekvátnost substituce lze posoudit:
- měřením krevního tlaku vleže a vestoje (posturální pokles může značit hypovolémii)
- hladinou sodíku, draslíku a reninu
Při substituci kortikoidů musíme započítat i mineralokortikoidní efekt hydrokortizonu: (40 mg hydrokortizonu = 100 μg fludrokortizonu).
- substituce adrenálních androgenů – indikována u pacientů s primární adrenální insuficienci s optimální substituci glukokortikoidů i mineralokortikoidů a příznaky únavy a nevýkonnosti, u žen se ztrátou libida. Optimální substituční dávkou je 25 – 50 mg DHEA denně. Monitorace substituce by mělo být prováděno stanovením hladiny DHEAS, androstendionu, testoteronu a SHBG za 24 hodin od poslední dávky DHEA.
Terapie akutní adrenální insuficience
- rehydratace – úvodem až 1000 ml/hod, dále dle úrovně kardiálních funkcí.
- substituce glukokortikoidů – úvodem bolusová dávka 100 mg hydrokortizonu, poté 100 – 200 mg během 24 hodin.
- substituce mineralokortikoidů – substituce by měla být zahájena při poklesu dávky glukokokortikoidů pod ekvivalent 50 mg hydrokortizonu, protože vyšší dávky glukokortikoidů stimulují i mineralokortikoidní receptor.
Kongenitální adrenální hyperplazie
Definice – způsobena mutacemi genů kódujících enzymy:
- zapojených do syntézy glukokortikoidů (CYP21A2, CYP17A1, HSD3B2, CYP11B1)
- sloužících jako kofaktory oxidoreduktáz P450, které jsou donory elektronů (CYP21A2 a CYP17A1)
Nepravidelně je u těchto pacientů vyjádřen deficit glukokortikoidů, nadbytek mineralokortikoidů nebo deficit sexuálních hormonů. Diagnóza je stanovena zvýšením hladiny hormonů (v séru nebo moči), které se hromadí před enzymatickým blokem.
Etiologie
| Defektní enzym | Gen | Klinický obraz | Diagnostický marker |
| 21-hydroxyláza | CYP21A2 | deficit glukokortikoidů, deficit mineralokortikoidů | v séru – 17-hydroxyprogesteron, 21-deoxykortizol |
| nadbytek adrenálních androgenů | v moči – pregnanentriol, 17-hydroxypregnanolon, pregnantriolon | ||
| 11β-hydroxyláza | CYP11B1 | deficit glukokortikoidů | v séru – 11-deoxykortizol, 11-deoxykortikosteron |
| nadbytek mineralokortikoidů, nadbytek adrenálních androgenů | v moči – tetrahydro-11-deoxykortizol, tetrahydro-11-deoxykortikosteron | ||
| 17α-hydroxyláza | CYP17A1 | (deficit glukokortikoidů), deficit adrenálních androgenů | v séru – 11-deoxykortikosteron, kortikosteron, pregnenolon, progesteron |
| nadbytek mineralokortikoidů | v moči – tetrahydro-11-deoxykortikosteron, tetrahydrokortikosteron, pregnendiol, pregnandiol) | ||
| 3β-hydroxysteroid dehydrogenáza | HSD3B2 | deficit glukokortikoidů, (deficit mineralokortikoidů) | v séru – 17-hydroxypregnenolon |
| nadbytek adrenálních androgenů | v moči – pregnantriol | ||
| P450-oxidoreduktáza | POR | deficit glukokortikoidů, deficit adrenálních androgenů | v séru – pregnenolon, progesteron, 17-hydroxyprogesteron |
| nadbytek mineralokortikoidů | v moči – pregnandiol, pregnantriol | ||
| malformace skeletu |
Mutace 21-hydroxylázy (CYP21A2) – 90 – 95 % všech případů kongenitální adrenální hyperplazie. Porušena je syntézy glukokortikoidů a mineralokortikoidů, zpětnovazebně je nárůst ACTH a stimulace syntézy adrenálních androgenů (nadbytek jejich prekurzorů před enzymatickým blokem). Dle závažnosti mutace je závažný i klinický obraz. Známky nadbytku androgenů jsou přítomny u všech pacientů. Formy:
- „klasická“ – těžká virilizace genitálu u novorozených děvčátek (46,XX DSD), těžká adrenální krize u chlapců během prvních měsíců života (zejména v zaostalých státech, kde se nedělá screening), předčasná puberta s uzávěrem růstových zón.
- „neklasická forma“ – hirsuitismus a oligomeorhea při syndromu polycystických ovarií u žen, předčasná puberta s uzávěrem růstových zón u chlapců. U mužů často patrné jen díky cílenému screeningu.
Komplikace:
- ženy – sterilita při oligo-/amenorhee s chronickou anovulací.
- muži – „testicular adrenal rest tumors“ – hyperplastické adrenokortikální buňky, lokalizované v rete testis, které by neměly být zaměněny za tumory varlat. Mohou ireverzibilně poškozovat spermatogenezi a indukovat fibrózu.
Terapie – cílem je substituce glukokortikoidů (tím i suprese ACTH se snížením syntézy adrenálních androgenů), tak aby imitovala diurnální kortizolový profil a zejména zabránila stimulaci sekrece ACTH během brzkých ranních hodin a tak i nadměrnou produkci adrenálních androgenů. Cíle:
- v dětství je hlavním cílem optimalizace růstu, pohlavního zrání a prevence adrenokortikálních krizí (vhodný hydrokortizon, který je krátkodobý a lze vytitrovat dávky odpovídající diurnálnímu profilu – cca 10 – 13 mg /m2/den).
- v dospělosti udržení fertility (glukokortikoidy o střední délce působení, např. prednison, dexametazon, používané v nejnižší dávce, která suprimuje nadbytek androgenů) a zábrana vedlejších účinků terapie (zejména metabolického syndromu a osteoporózy). K adekvátnosti suprese adrenálních androgenů je vhodné monitorovat androstendion a testosteron (měly by se nacházet v normálním rozmezí). 17-hydroxyprogesteron se zvyšuje při oversupresi, která může potlačit osu hypothalamus-hypofýza-gonády.
Špatně kontrolovaná choroba progreduje do adrenokortikální hyperplazie (odtud jméno choroby) při dlouhodobé zvýšené hladině ACTH. Při makronodulární formě mohou vznikat v uzlech autonomně adrenální androgeny, jejichž produkce je nepotlačitelná glukokortikoidy.
Při kongenitální adrenální hyperplazii u dětí je potřebná vyšší dávka mineralokortikoidů (nezralost ledvin) s nutností substituce soli. Adekvátnost substituce lze posuzovat podle hladiny reninu (měla by být udržována v horní polovině normálního referenčního rozmezí).
Incidentalomy nadledvin
Definice – jde o náhodně zjištěné zvětšení hmoty nadledvin.
Epidemiologie – prevalence cca 2 % (narůstá s věkem – 1 % u 40 letých, 7 % u 70 % letých).
Etiologie
- adenom nadledvin – někdy v rámci MEN-1 (MEN1), MEN-2 (RET), Carneyho komplexu (PRKAR1A), McCune-Albrightova syndromu (GNAS1). Je ve 25 % hormonálně aktivní.
- makronodulární adrenokortikální hyperplázie – vyšší incidence při aberantní expresi receptorů některých hormonů (např. gastric inhibitory peptide, β-adrenergní,LH, typ V1 pro vazopresin, IL-1).
- karcinom nadledvin – 5 % všech případů zvětšení hmoty nadledvin, častější jsou metastázy ze solidních nádorů jiných tkání.
- bilaterální zvětšení hmoty nadledvin může být způsobeno kongenitální adrenální hyperplazií, bilaterální makronodulární hyperplazií, bilaterální hemoragií do nadledvin (pro antifosfolipidový syndrom nebo Waterhouse-Friderichsenův syndrom – asociovaný se sepsí), granulomy, amyloidózou, infiltrativními choroby, TBC.
Diagnostika – při náhodně objeveném nádoru nadledvin je nutné provést následující kroky:
Diagnostický postup u incidentalomů dle České endokrinologické společnosti 2017: (dostupné online: https://endokrinologie.blob.core.windows.net/cms/ContentItems/60_00060/A38e3z/18-incidentalom-nadledviny-doc-mudr-tomas-zelinka-ph-d.pdf)
- 1. Současně je úvodem nutné stanovení:
- 1a. Rizika malignity – indikováno CT nadledvin bez kontrastu – pokud se jedná o homogenní, hypodenzní (HU<10, protože obsahují tuk) nádor <4 cm, není nutné žádné další kontrolní zobrazovací vyšetření. Při hraničním nálezu je možné provedení kontrolního CT s odstupem, MRI nebo rovnou adrenalektomie. Pokud nejde o pacienta s extraadrenálním maligním nádorem, není důvod provádění diagnostické biopsie.
- 1b. Hormonální sekrece – indikován:
- 1 mg dexametazonový test (1 mg dexametazonu ve 23:00, odběr v 8:00. Interpretace: kortizol < 50 nmol/l vylučuje autonomní nadprodukci, 51 – 138 nmol/l možná autonomní nadprodukce, > 138/nmol/ autonomní nadprodukce kortizolu). Při potvrzení autonomní nadprodukce je nutné vyloučit hypertenzi, poruchu metabolismu glukózy a asymptomatických fraktur obratlů. Při indikaci adrenalektomii by měla být potvrzena nezávislost na ACTH (nízká hladina ACTH).
- feochromocytom by měl být vyloučen pomocí stanovení plazmatických metanefrinů, při současné hypokalémii je nutné vyloučit současný primární hyperaldosteronismus pomocí stanovení hladin reninu, aldosteronu a jejich poměru. Při podezření na adrenální karcinom je vhodné stanovení hladiny steroidních prekurzorů i pohlavních hormonů.
- 2. Dle tohoto bychom se měli snažit určit definitivní diagnózu. Následující scénáře:
- afunkční, dle zobrazovacích metod benigní tumor < 4 cm – bez dalších vyšetření
- adenom s autonomní sekrecí kortizolu – při benigním nádoru je indikována laparoskopická adrenalektomie, u maligního laparoskopická/otevřená adrenalektomie v zavilostí na závažnosti lokální invaze.
- jiný tumor s hormonální nadprodukcí – chirurgické řešení.
Karcinom nadledvin
Epidemiologie – roční incidence 1: 500 tisíc – 1 milión. Ženy postiženy 1,5x častěji než muži, výskyt má dva vrcholy dle věku (děti do 5 let, cca 50 let).
Etiologie – mutace:
- TP53 (17p13, gen kódující tumorový supresor) – u 25 % pacientů se sporadickým karcinomem nadledvin je pozitivní mutace genu pro tumorový supresor. Pokud je mutace TP53 hereditární, nazývá se syndrom Li-Fraumeni a je spojena s tumory mnoha orgánů včetně karcinomu nadledvin. Syndrom Li – Fraumeni je přítomen u 25 % dětských pacientů s karcinomem nadledvin (v Brazílii téměř 100 %).
- Wnt/β-catenin pathway – skupiny genů pro insulin-like growth factor 2 (nadprodukce IGF2 je přítomna u 90 % pacientů s karcinomem nadledvin).
Histopatologie – velice obtížná. Stanovuje se dle Weissova skóre: posuzuje se vzhled jádra a buněk, rychlost a atypie mitóz, architektura, přítomnost nekróz, invaze do žil a sinusů a pouzdro tumoru.
Klinický obraz – je celkově považován za velice maligní nádor. 60 – 70 % karcinomů nadledvin je hormonálně aktivních (nejčastěji glukokortikoidy a prekurzory adrenálních androgenů). Produkce je většinou asymptomatická, protože je velice neefektivní, může se ale projevit Cushingovým syndromem nebo nadprodukcí androgenů. Metastázy jsou většinou do jater a plic.
Diagnostika – přísně kontraindikována je FNA (riziko založení implantačních metastáz v průběhu kanálu po jehle). Zásadní je vyloučení:
- feochromocytomu – volné plazmatické meta- a normetanefriny. V případě potvrzení by před výkonem byla nutná alfa blokáda.
- Cushingova syndromu – 1 mg dexametazonový supresní test (1 mg, 23.00 hod.), bazální hladina kortizolu (sérum), bazální hladina ACTH (plazma).
- nadprodukce aldosteronu – draslík v séru, poměr aldosteron/renin, zátěžové testy, separované odběry aldosteronu z adrenálních žil.
- adrenogenitální syndrom – DHEA-S, 17-OH-progesteron, androstendion (sérum), testosteron.
Hlavním parametrem odlišení benigní a maligní léze je charakter nádoru na:
- CT – nepravidelné okraje, nepravidelné sycení kontrastní látky, někdy s přítomností kalcifikací, lze posoudit i invazivitu růstu, nativní denzita > 10 HU, problémem je, že 30 % adenomů má také vyšší denzitu. V tom případě je vhodné použití pozdních skenů, které u karcinomů prokáže rychlejší odplavení kontrastu, protože jsou více vaskularizované.
- MR, PET CT (průkaz zvýšeného metabolismu glukózy).
- Tato vyšetření posuzují i přítomnost lymfadenopatie a vzdálených metastáz. Pro maligní tumor svědčí i jeho průměr > 4 cm (při velikosti> 6 cm je již podezření poměrně velké).
Terapie
1. Kompletní chirurgické odstranění nádoru s regionální lymfadenektomií – vhodné u pacientů bez diseminace. U malých nádorů lze někdy použít laparoskopická technika, nevýhodou jsou časté pozitivní resekční okraje a vysoké riziko recidivy. Zlatým standardem je otevřená adrenalektomie.
Nutné dodržení některých zásad při operaci (dle Porpiglia): „No touch“ technika, zachování intaktního parietálního peritonea na přední straně nadledviny, „en block“ resekce nádoru s širokým bezpečnostním lemem v okolí kapsuly tumoru, striktní neporušení celistvosti nádorové kapsuly, minimalizace krvácení a omezení cirkulace tekutin v operované krajině, časté výměny rukavic, operačního pláště a operačních nástrojů (zejména po odstranění nádoru
před uzavřením dutiny břišní).
2. Chemoterapie – jediným specifickým lékem je mitotan. Počáteční dávka 500 mg 4x denně se zvýšením dávky o 1000 mg každé 2 týdny do maximální tolerované dávky (většinou 8 – 10 g/m2/den s podáváním po dobu nejméně 2 let). Lze monitorovat hladinu mitotanu v plazmě (doporučená 14 – 20 mg/l, vyšší je již neurotoxická). Současně je potřeba substituovat hydrokortizon (vyšší dávky než je obvyklá substituční dávka, protože mitotan je induktor CYP3A4 a zvyšuje hladinu CBG – cortizol binding globulin a tedy snižuje volnou, biologicky účinnou frakci glukokortikoidů).
3. Při nálezu solitárních metastáz je možné použít radiofrekvenční ablaci. Při zjištění bolestivých kostních metastáz lze použít radioterapii.
Prognóza – velice špatná, 5 leté přežití je 30 – 40 %. Prognózu rapidně zhoršuje poškození pouzdra tumoru při primárním chirurgickém výkonu a přítomnost metastáz.