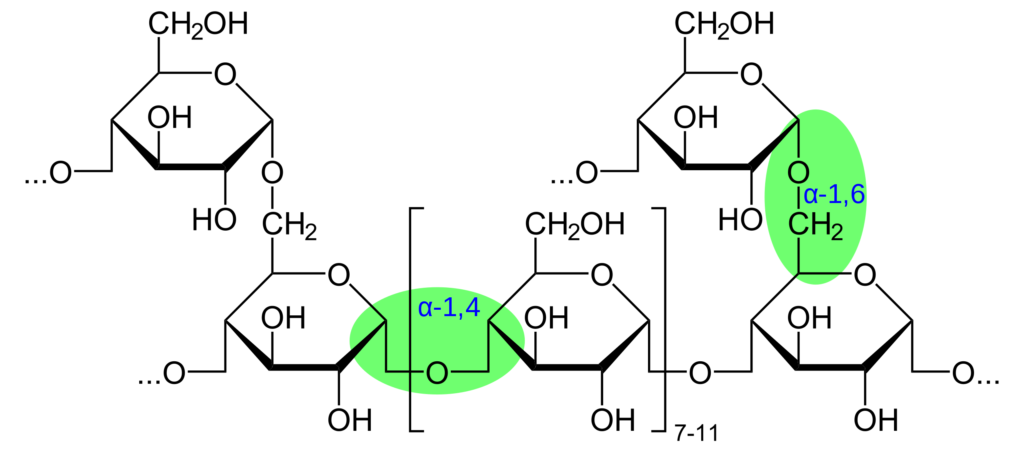
Glykogen patří mezi homopolysacharidy (je složen pouze z glukózy – Glu). Jde o zásobní polysacharid, který je přítomen v játrech (slouží k udržování glykémie, cca 150 g, po 12 – 20 hodinách hladovění klesá na nulu) a svalech (jako energetická rezerva, cca 300 g, nikdy neklesá na nulu). Jde o řetězec spojený O-glykosidovou vazbou α-(1→4), který se po cca 12 Glu dělí pomocí α-(1→6) vazby. Částice glykogenu jsou obrovské glykoproteinové molekuly s malým proteinovým jádrem a obrovským rozvětveným polysacharidem Glu, které se nachází v cytoplazmě.

Glykogenogeneze
Glykogen vzniká vždy na nějakém primeru (nelze jen tak od nuly začít vázat Glu jednu za druhou). První možností je zahájení vazby na neredukujícím konci nejméně čtyřčleného, již existujícího zbytku Glu, druhou možností pak zahájení vazby na OH skupině tyrozinu bílkoviny glykogenin, který sám o sobě funguje jako primer.
1. Po vstupu do buněk se Glu fosforyluje na Glu-6-P (γ-fosfát ATP se přenáší z ATP na OH skupinu 6C), která tak získá náboj a nemůže opustit buňku. Tuto reakci katalyzuje glukokináza (pouze v játrech, nízká afinita ke Glu) a hexokináza (ve všech tkáních, vysoká afinita ke Glu). Rozdíl v afinitě je významný při hladovění, kdy glukokináza v játrech fosforyluje Glu pouze málo a ponechá ji k dispozici ostatním orgánům, např. mozku.
2. Glu-6-P se reverzibilně izomeruje na Glu-1-P pomocí fosfoglukomutázy.
3. Glu-1-P a UTP dává vznik uridindifosfátglukóze (UDPG) pomocí UDPG-pyrofosforylázy. Při této reakci se spotřebovává energie, což zajišťuje ireverzibilitu gly
4. Glukóza se z UDPG přenáší na neredukující konec sacharidového řetězce (není zde volný hemiacetalový hydroxyl), kam se připojuje vazbou α-(1→4). Reakci katalyzuje glykogensyntáza, která je pod hormonální kontrolou (stimuluje jí inzulín, inhibuje glukagon, adrenalin, hormony štítné žlázy).
Deficit je vzácný a působí glykogenózu typu 0, která se projevuje nevysvětlitelnou glykémií v časném věku, která může postupně působit až poškození mozku. Léčba je symptomatická a spočívá zejména v zabránění hypoglykémií.
5. Vždy po určité době se z konce řetězce přenese oligosacharidový řetězce o cca 7 molekulách Glu na OH skupinu 6C jiné Glu a syntéza glykogenu pokračuje nadále. Reakci katalyzuje větvící enzym.
Jeho deficit působí glykogenózu typu IV (Andersonova choroba) s tvorbou kompaktních glykogenových molekul podobných amylopektinu (chybí vazby α-(1→6). Projevuje se jaterním postižením, není specifická terapie, jedinou možností je transplantace jater.

Glykogenolýza
Důležitost glykogenolýzy plyne z nutnosti udržet stálou glykémii. Inhibuje ji inzulín, stimuluje glukagon, adrenalin, hormony štítné žlázy.
1. Podstatou a stále se opakující reakcí je fosforolýza(!). Z neredukujícího konce glykogenového řetězce (od Glu s volnou OH skupinou na C4) se pomocí H3PO4 odštěpí Glu-1-P. Reakce je zprostředkována glykogenfosforylázou (hormonálně řízená).
- Deficit jaterní fosforylázy působí glykogenózu typu VI, vzácné benigní onemocnění, které se projevuje hepatomegalií a růstovou retardací v časném dětství, léčba je symptomatická.
- Deficit svalové fosforylázy působí AR dědičnou glykogenózu typu V (McArdleho nemoc). Neschopnost štěpit glykogen vede k jeho hromadění s nemožnosti jeho využití ve formě ATP. Pacient díky tomu trpí bolestí svalů a netoleruje svalovou námahu, po které dochází k rabdomyolýze s myoglobinurii, naopak, laktát se nezvyšuje (nedochází k anaerobní glykolýze, protože není substrát).
2. Jakmile na štěpeném řetězci zůstanou čtyři zbytky Glu, (1) odštěpí se skupina tří Glu a přenese se na nerudukující konec sousedního řetězce, kde se opět napojí α-(1→4) vazbou, na původním řetězci tak zbyde jediný zbytek Glu napojený α-(1→6) vazbou, který je (2) odštepen za vzniku Glu (nikoliv Glu-1-P). Oba tyto pochody katalyzuje linearizační enzym.
Deficit jaterní linearizačního enzymu působí AR dědičnou glykogenózu typu III (Coriho chorobu), která se projevuje hypoglykémií, hepatomegalií, nízkou postavou a variabilně myopatií a kardiomyopatií (na rozdíl od typu I není přítomna laktátová acidóza ani hyperurikémie, naopak je běžná ketoacidóza). Specifická farmakoterapie neexistuje, léčbou může být vysokoproteinová dieta k nastartování glukoneogeneze a léčba komplikací.
Po rozštěpení glykogenové částice vzniká velké množství Glu-1-P a malé množství volné Glu. Glu-1-P musí být převeden fosfoglukomutázou na Glu-6-P a pak vstupuje do pentosafosfátové dráhy nebo glykolýzy.