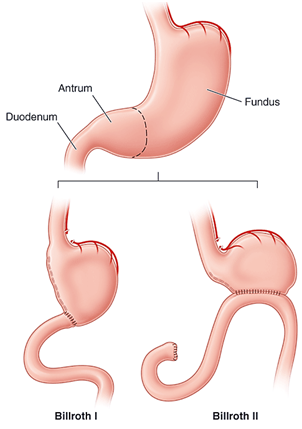
Anatomie a fyziologie žaludku

Epitel žaludeční sliznice je zřasen do záhybů (rugae gastricae), jejichž spodina je pokryta mikroskopickými jamkami, do každé z nich pak ústí čtyři až pět vývodů žlázek. Skladba žlázek závisí na jejich anatomické lokalizaci:
- v oblasti kardie (˂ 5 % povrchu žaludku) obsahují hlen a endokrinní buňky
- v oblasti fundu a těla žaludku (75 % povrchu žaludku) se nachází hlenové buňky krčku, hlavní buňky (produkují lipázy a pepsinogen, který se aktivuje kyselým prostředím na pepsin), parietální buňky. Nachází se v oblasti krčku, isthmu nebo parietálních žlázkách. V klidovém (nestimulovaném) stavu mají v cytoplazmě přítomny výrazné tubuly, vezikuly a intracelulární kanálky obsahující krátké mikroklky podél jejich apikálního povrchu. V oblasti tubulovezikulárních membrán je exprimována H+,K+-ATPáza. Po stimulaci dochází k transformaci do husté sítě apikálních intracelulárních kanálku s dlouhými mikroklk, na jejichž vrcholku je secernována kyselina chlorovodíková. Cca 30 – 40 % objemu celé buňky dělají mitochondrie, které pokrývají tento energeticky náročný proces.). Dále se zde nachází endokrinní buňky (produkují serotonin), enterochromafinní a enterochromaffin-like buňky
- v oblasti pyloru obsahují hlen a endokrinní buňky (obsahují buňky produkující gastrin).


Sliznice žaludku a duodena je i přes neustálou přítomnost různých škodlivých nox (kyselina, pepsin, žlučové kyseliny, pankreatické enzymy, léky a baktérie) zachována díky řadě protektivních fyziologických mechanismů.
1. Preepiteliální úroveň – první úrovní je vrstva hlen-bikarbonát-fosfolipidy, která chrání před fyzikálními a chemickými vlivy řady molekul, včetně H+ iontů:
- hlen je produkován epiteliálními buňkami gastroduodena. Je složen z 95 % vodou, zbytek dělá směs směs fosfolipidů a mucinu. Slouží jako bariéra proti některým iontům a molekulám (např. pepsin).
- bikarbonát je secernován gastroduodenálními epiteliálními buňkami do hlenové vrstvy, díky tomu vzniká gradient pH v rozsahu 1 – 2 v lumen a 6 -7 na epiteliálním povrchu žaludku.
2. Epiteliální úroveň – epiteliální buňky působí protektivně několika mechanismy. Jak bylo uvedeno výše, produkují hlen a bikarbonát, navíc některé iontové transportéry udržují intracelulární pH, protektivně působí i intracelulární tight junctions, produkují heat shock proteiny působící preventivně proti denaturaci některých bílkovin a ochraňující epiteliální buňky za přítomnosti určitých rizikových faktorů, např. zvýšené teploty, cytotoxických látek nebo oxidačního stresu a produkují trojici faktorů a katelidicinů mající důležitou roli v ochraně a regeneraci epitelu.

3. Subepiteliální úroveň – podstatou třetí protektivní vrstvy je složitý systém mikrocirkulace uvnitř submukózy. Poskytuje bikarbonát, který neutralizuje kyselinu produkovanou parietálními buňkami. Další funkcí mikrocirkulace je přísun kyslíku a živin a odstraňování toxických látek.
V systému ochrany žaludeční sliznice hrají zásadní roli prostaglandiny, které stimulují uvolňování bikarbonátu a hlenu, inhibují sekreci HCl a jsou důležité pro udržení krevního průtoku sliznicí a restituci epiteliálních buněk. Prostaglandiny jsou syntetizovány z esterifikované arachidonové kyseliny vznikající pomocí fosfolipázy A2 z fosfolipidů. Klíčovým enzymem v syntéze je enzym cyklooxygenáza (COX), která je přítomna ve dvou izoformách (COX-1, COX-2), které se liší ve struktuře a tkáňové distribuci a expresi. COX-1 je konstitutivně exprimována v řadě tkání, např. žaludku, krevních destičkách, endoteliálních buňkách, ledvinách. Hraje významnou roli v zachování renálních funkcí, agregaci trombocytů a ochraně žaludeční sliznice. Naopak, COX-2 je indukována zánětlivou reakcí a je exprimována makrofágy, leukocyty, fibrioblasty a synoviálními buňkami. Právě inhibice COX-2 je odpovědna za příznivý protizánětlivý efekt nesteroidních antiflogistik (NSAID) a naopak, inhibice COX-1 působí jejich nežádoucí účinky (např. gastrointestinální ulcerace, zhoršení renálních funkcí).
Dvěma hlavními látkami secernovanými žaludkem se schopností poškození žaludeční sliznice jsou kyselina chlorovodíková a pepsinogen. Obě hrají důležitou roli v trávení proteinů, ochraně proti exogenním mikroorganismům a absorpci železa a vitamínu B12.

Žaludeční kyselinu i vnitřní faktor syntetizují parietální buňky, které se nachází v blízkosti ostatních buněk důležitých pro tento proces sekrece (ECL, D buňky). Parietální buňky exprimují receptory pro několik substancí, které je k sekreci stimulují:
- 1. Histamin, který po vazbě na H2 receptory aktivuje adenylátlcyklázu se zvýšením koncentrace cAMP. Ke stimulaci sekreci dochází i nepřímou cestou, protože se histamin váže i na H3 receptory D buněk, které inhibují uvolnění somatostatinu.
- 2. Gastrin, který po vazbě na cholecystokinin B/gastrin receptor aktivuje proteinkinázu C se zvýšením koncentrace inositoltrifosfátu.
- 3. Acetylcholin, který po vazbě muskarinový M3 receptor také aktivuje proteinkinázu C.
Každá z těchto signálních drah aktivuje složitou kinázovou kaskádu, která reguluje H+,K+-ATPázu. Z toho vyplývá důležitý poznatek, že blokáda jedné z těchto drah vede ke kompenzační aktivaci dvou zbývajících. Parietální buňky exprimují i receptory pro ligandy, které sekreci inhibují:
- 1. Prostaglandiny
- 2. Somatostatin
- 3. Epidermální růstový faktor (EGF)
Sekreci kyseliny chlorovodíkové lze rozdělit na bazální a stimulovanou. Bazální sekrece má cirkadiánní charakter s nejvyšší intenzitou v noci a nejnižší v ranních hodinách. Hlavními regulátory bazální sekrece jsou cholinergní vlákna z nervus vagus. Stimulovaná sekrece probíhá typicky ve třech fázích, odlišujících se místem vzniku sekrečního stimulu (mozek, žaludek, střevo). Hlavními komponentami mozkové fáze jsou zrak, chuť a vůně potravy, které stimulují sekreci cestou nervus vagus. Jakmile potrava dorazí do žaludku, je aktivována žaludeční fáze, která je řízena živinami (aminokyseliny a aminy), které přímo stimulují G buňky s následným uvolněním gastrinu. Gastrin následně aktivuje přímým i nepřímým mechanismem parietální buňky. K uvolnění gastrinu vede i roztažení žaludeční stěny. Střevní fáze je zahájena postupem potravy do střeva a zahájením trávení. Současně se spouštěním těchto stimulačních sekvencí jsou aktivovány i procesy inhibující uvolnění žaludeční kyseliny. Z endokrinních buněk žaludeční sliznice (D buňky) je jako odpověď na HCl uvolněn somatostatin, který inhibuje produkci kyseliny přímo (ovlivněním parietálních buněk) i nepřímo (snížení uvolnění histaminu z ECL buněk a gastrinu z G buněk). Důležitou roli hraje i řada dalších nervových (centrálních i periferních) i humorálních faktorů (amylin, atriální natriuretický peptid, cholecystokinin, ghrelin, obestatin, secretin a serotonin). Ghrelin, hormon regulující chuť k jídlu, je tvořen v žaludku a přes nervus vagus stimuluje sekreci HCl.

ACh – acetylcholin, ANP – atriální natriuretický peptid, CGRP – calcitoningene-related peptide, EC – enterochromaffinní buňky, ECL – enterochromaffin-like buňky, GRP – gastrin-releasing peptide, PACAP – pituitary adenylate-cyclase activating peptide, SST – somatostatin, VIP – vazoaktivní intestinální peptid
Enzym H+,K+-ATPáza je membránový protein produkující velké množství H+ iontů. Je složen ze dvou podjednotek, α podjednotky, odpovědnou za vlastní sekreci, a β podjednotky, jejíž funkce není zatím známá. Principem je energeticky náročný transfer H+ iontů z cytoplazmy parietálních buněk do sekrečních kanálků, který se děje výměnou za K+. H+,K+-ATPáza se nachází v sekrečních kanálcích i nesekrečních cytoplazmatických tubulovezikulách. Inaktivace enzymu v tubulovezikulách je způsobená jejich neprostupností pro K+ ionty, čimž chybí substrát pro funkci pumpy. Distribuce H+,K+-ATPáza mezi inaktivní formou v tubulovezikulách a aktivní formou cytoplazmatické membrány závisí na aktivačním stavu parietální buňky. Jinými slovy, po odeznění sekrečního stimulu se enzym zanoří do cytoplazmy a inaktivuje.
Hlavní buňky se nachází zejména ve fundu žaludku. Jejich dominantní funkcí je syntéza a sekrece pepsinogenu, inaktivního prekurzoru proteolytického enzymu pepsinu. Štěpení a aktivace pepsinogenu na pepsin vyžaduje kyselé prostředí, které panuje v žaludku (pH ˂ 2) a naopak, pepsin je při pH ˃ 4 reverzibilně, a při pH ˃ 7 ireverzibilně inaktivován a denaturován.
Vředová choroba gastroduodena
Definice – histologicky definován jako slizniční defekt, který proniká stěnou trávící trubice pod muscularis mucosae (povrchovější je označován jako eroze).
Etiologie – mezi hlavní příčiny tedy patří:
- 1. Chronická infekce H. pylori
- 2. Sekundární vředy
- polékové (NSAID, glukokortikoidy)
- stresové (Curlingův u těžkých popálenin, Cushingův po operacích mozku), v.s. při poruše mikrocirkulace
- endokrinně podmíněné (Zollinger – Ellisonův syndrom při nadprodukci gastrinu, hyperparatyreoidismus)
- hepatogenní při selhání jater
- při respirační insuficienci
- stařecké (vlivy nutriční a poruchy cirkulace)
Dlouho platí zásada Karla Schwarze z roku 1910: „Není kyselina, není vřed“. Žaludeční kyselina je nutnou podmínkou konverze pepsinogenu na pepsin, který působí lýzu sliznice. Zásadní je převládnutí agresivních vlivů nad protektivními:
I. Agresivní vlivy – přispívají ke vzniku peptického vředu:
- Účinek kyselé žaludeční šťávy.
- Infekce Helicobacter pylori – roku 1982 byl publikován objev mikroaerofilní, G+, spirálovité bakterie Helicobacter pylori, která vykazuje výraznou afinitu ke sliznici žaludku. Obsahuje ureázu, která umožňuje vytvářet alkalické okolí v silně kyselém prostředí, které takto neutralizuje. Za její objev byla roku 2005 udělena Nobelova cena. Bakterie poškozuje buněčnou membránu sliznice, nejdříve v antru, poté i orálněji se vznikem pangastritidy. Bakterie se přenáší fekálně/oro- orální cestou, v rozvojových zemích je postiženo cca 25 % populace, v rozvojových až 90 %.
- Léky – NSAID, glukokortikoidy.
- Kouření
- Porucha mikrocirkulace (stresové vředy)
- Duodeno – gastrický reflux s agresivním vlivem žlučových kyselin a lyzolecitinu.
II. Ochranné faktory – přirozeně chrání proti peptickému vředu. Patří mezi ně dobrá mikrocirkulace a regenerační schopnost sliznice, žaludeční hlen, bikarbonát a zachovalá sekrece protektivních prostaglandinů (PgI2, PgE2).
Klinický obraz duodenálního vředu – postiženi jsou častěji mladší muži, nejčastěji se objevuje do 3 cm od pyloru. Za většinu případů duodenálních vředů je odpovědna infekce Helicobacter pylori a abusus NSAID. Maligní varianty jsou extrémně vzácné. Projevuje se bolestí epigastria ve střední čáře nebo vpravo od ní, typicky na lačno nebo > 2 hodiny od jídla, často budí nemocného ze spánku, může se šířit pod pravý žeberní oblouk nebo do zad. Má charakter dyskomfortu, bolestivého hladu nebo přímo bolesti. Vyzvracení žaludečního obsahu většinou poskytuje úlevu. Typické je, že ustupuje po antacidech nebo požití potravy, proto nemocní často úlevově jí a mohou přibírat na hmotnosti, jiní se naopak bojí jíst.
Klinický obraz žaludečního vředu – vyskytuje se ve vyšším věku s maximální incidencí v 60 letech, s častějším postižením mužů. Mohou být maligní a měly by proto být v čase diagnózy bioptovány a histologicky vyšetřeny. Nejčastější příčinou je abusus NSAID, kdy jsou často oligosymptomatické a mohou se projevit až komplikací, dále chornickou infekcí H. pylori. V typickém případě je hlavním příznakem tupá, tlaková bolest v epigastriu, která vzniká bezprostředně nebo do 1 hodiny po požití jídla (čím proximálněji je vřed uložen, tím je vazba na jídlo těsnější). Bolest je často každodenní (tím se liší od biliární koliky). Zvracení může být známkou stenózy pyloru. Po úspěšné eradikaci H. pylori k recidivě vředu téměř nedochází.
Změna bolestí peptického vředu nebo objevení dalších příznaků (nauzea a/nebo zvracení) naznačuje možný vznik komplikací peptického vředu:
- pokud se dyspepsie stává konstantní, propaguje se do zad a je neovlivnitelná příjmem potravy ani antacid, může to být příznakem penetrace vředu (do pankreatu).
- náhlý vznik těžké, generalizované bolesti břicha může znamenat perforaci vředu.
- zhoršení bolesti spojené s nauzeou a zvracením následující po jídle může být známkou stenózy pyloru.
- zapáchající dehtovitá stolice a zvracení kávové sedliny je příznakem krvácení do trávicího traktu.
Komplikace žaludečního vředu
- Gastrointestinální krvácení – nejčastější komplikací vředové choroby gastroduodena, zejména u starších jedinců vzhledem k nadužívání NSAID. Projevuje se jako hemateméza nebo meléna, řešení je endoskopické nebo chirurgické.
- Perforace – druhou nejčastější komplikací, vyšší výskyt u pacientů ˃ 60 let (opět vzhledem k vyššímu abusu NSAID). Dochází k ní, pokud je vznik vředu natolik rychlý, že nedochází k zánětlivé adhezi s okolními orgány. Projevuje se jako náhle vzniklá prudká bolest, která je setrvalá a neovlivnitelná s rozvojem náhlé příhody břišní s peritonitidou. RTG břicha ve stoje a CT břicha prokážou pneumoperitoneum. Léčbou je urgentní chirurgický výkon.
- Penetrace – perforace, která neproniká do břišní dutiny, ale do přilehlých orgánů. V rámci pomalejšího růstu dochází ke vzniku adhezi a vřed neperforuje do volné dutiny břišní, ale postupně proniká do okolních orgánů. Nejčastěji duodenální dorzálním směrem do pankreatu se vznikem pankreatitidy a úpornými trvalými bolestmi propagujícími se do zad. Žaludeční mohou penetrovat do levého jaterního laloku.
- Stenóza pyloru – nejvzácnější komplikací pylorického nebo duodenálního vředu. Projevuje se rozvojem časné sytosti po jídle, s nauzeou a zvracením velkých porcí potravy, které přináší nemocnému velkou úlevu. Následkem bývá váhový úbytek. Stenóza vzniká díky zánětu při ulceraci, následné hojení může vést k jizvení, fibrotizaci a obstrukci. Tato komplikace je řešitelná endoskopickou dilatací nebo chirurgicky. Vždy musí být vyloučen stenozující karcinom!





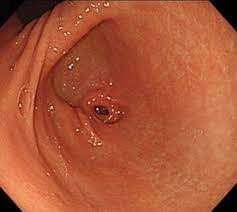
Diagnostika – základem je endoskopické vyšetření. Tzv. bulbitida (edém a zarudnutí sliznice, ložiska krvácení a bělavé fibrinové nálety) se v současnosti bere jako ekvivalent peptického vředu.

Vřed při endoskopii vypadá jako různě hluboký defekt ve sliznici s bílou nebo žlutou spodinou. CAVE Vždy je nutné biopticky vyloučit karcinom. Při mnohočetných vředech je nutné zvážit sekundární příčinu (Zollinger – Ellisonův syndrom, lymfom, abusus NSAID apod.).
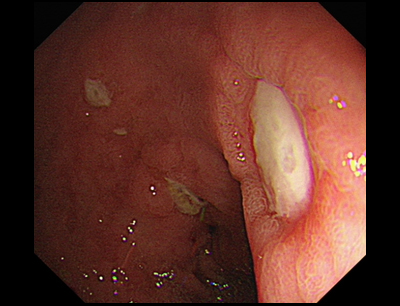
Vždy je nutné došetřit přítomnost infekce Helicobacter pylori:
- testování biopsií na přítomnost ureázy (PyloriTek, CLOtest, Hpfast, Pronto Dry), jejichž senzitivita a specifita je vyšší než 90 – 95 %
- dechový test s ureou značenou 13C nebo 14C
- sérologické vyšetření
- průkaz helikobakterového antigenu ve stolici
CAVE AŽ 3 % endoskopických „vředů“ jsou ve skutečnosti karcinomy, tedy „VŽDY“ je nutná biopsie a histologické vyšetření.
Laboratorní testy nejsou v diagnostice vředu zásadní, jsou důležité ve stanovení event. sekundární příčiny vředu (hyperkalcémie, Zollinger-Ellisonův syndrom).
Terapie – podobná u žaludečního i duodenálního vředu. Zamířena na potlačení kyselé sekrece a eradikace infekce H. pylori.
I. Režimová opatření – základem léčby:
- relativní fyzický klid
- zákaz potravin, které stimulují kyselou sekreci a nemají neutralizační vlastnosti (káva, čaj, kola, alkohol), nejsou vhodná ostrá jídla.
- zákaz kouření
- omezení ulcerogenních léků (NSAID, ASA? glukokortikoidy
II. Farmakoterapie – základním cílem farmakoterapie je eradikace infekce H. pylori a potlačení kyselé sekrece. eradikace infekce H. pylori snižuje riziko žaludečního vředu o 70 %, duodenálního o 90 %, navíc snižuje toxický účinek NSAID a ASA, snižuje riziko vzniku MALTomu a také zlepšuje histologický nález již vzniklé atrofické gastritidy. Tedy při průkazu infekce H. pylori je ji nutné vždy eradikovat. Problémem je narůstající rezistence k nejčastěji používaným antibiotikům (30 % u klaritromycinu, 50 % u metronidazolu). Po eradikaci klesá riziko recidivy vředové choroby na 0 – 5 %. Úspěšná eradikace je definována jako nemožnost průkazu H. pylori po jednom měsíci od ukončení eradikace. Dle nynějších doporučení je tedy:
- léčbou první linie – bizmut subcitrát + metronidazol + tetracyklin (PYLERA v kombinovaném preparátu bizmut subscitrát 140 mg + metronidazol 125 mg + tetracyklin 125 mg v dávce 3-3-3) + PPI 2x denně po dobu 10 – 14 dnů.
- při intoleranci bizmutu pak amoxicilin 1g 1-0-1 + metronidazol 500 mg 1-0-1 + klaritromycin 500 mg 1-0-1 + PPI 2x denně po dobu 10 – 14 dnů.
- do léčby druhé linie se přidává bizmut (pokud nebyl použit v první linii), nebo trojkombinace amoxicilin 1g 1-0-1+ levofloxacin 500 mg 1-0-0 + PPI 2x denně.
U sekundárních vředů, které nejsou způsobeny infekcí H. pylori je základem léčby dlouhodobá léčba PPI a léčba vyvolávajícího faktoru (vysazení NSAID, léčba endokrinopatie apod.).
III. Chirurgická terapie – primární léčba vředové choroby je dnes již minulostí, chirurgická terapie se používá pouze u komplikací (perforace, penetrace, masivní krvácení apod.).
Je nutné si uvědomit, že u pacientů po resekci žaludku vzniká v pahýlu žaludku karcinom 2 – 5x častěji než u neoperovaných osob a to často i s dlouhou latencí od resekce. Pacienti po resekci před více než 10 lety by tedy měli být dispenzarizováni a pravidelně sledování.