Metabolismus kyseliny močové
Úvod – puriny i pyrimidiny jsou v lidském těle částečně syntetizovány, částečně přijaty z potravy. Výchozí látkou je ribóza-5-fosfát a v 11 reakcích vzniká postupně inozin-monofosfát. Ke 4. a 10. reakci jsou potřeba deriváty tetrahydrofolátů, nedostatek purinů je tedy často způsoben deficitem kyseliny listové. Nejdůležitějším mechanismem je 1. syntéza de novo (viz níže), další možností je 2. fosforibosylace purinů a 3. fosforylace purinových nukleotidů. Puriny jsou degradovány až na kyselinu močovou. Adenosin je deaminován na inosin, ze kterého je následně odstraněn ribóza-1-fosfát za vzniku hypoxantinu a následně xantinu. Z guanosinu je odstraněn ribóza-1-fosfát za vzniku guaninu a následně xantinu. Xantin je poté oxidován na kyselinu močovou.
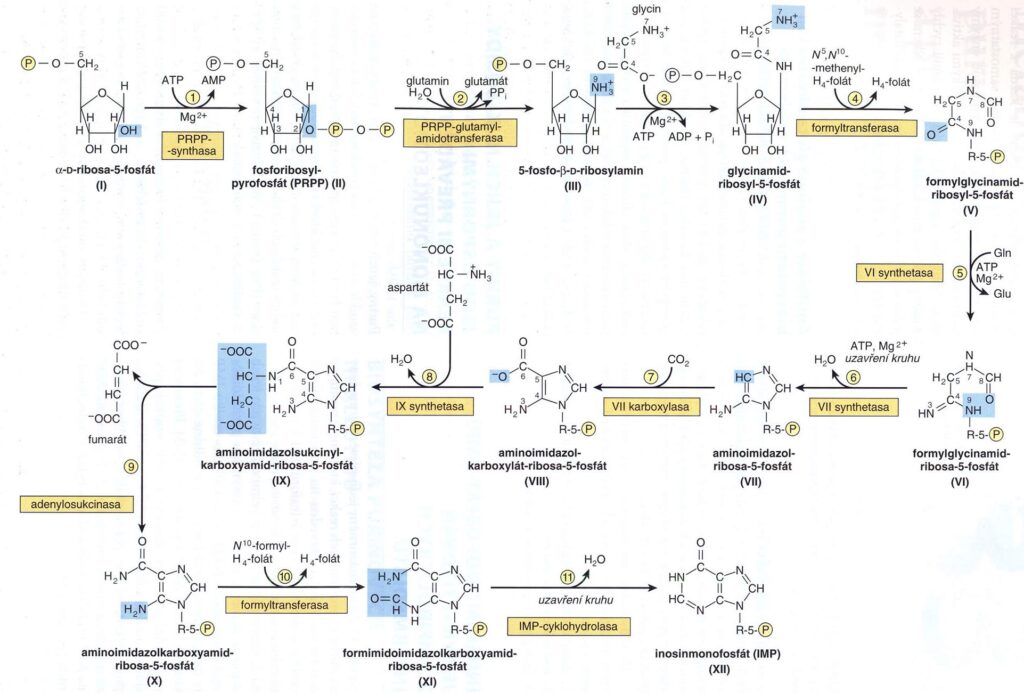
Pyrimidiny vznikají z karbamoylfosfátu a asparagové kyseliny a jsou metabolizovány na beta-alanin a beta-aminoizobutyrát (transaminován na methylmalonát a poté na sukcinyl-CoA).
Kyselina močová (finální produkt metabolismu purinů) je slabou kyselinou (pKa 5,75 a 10,3). Koncentrace urátu sodného při kterém je tekutina nasycena:
- plasma – 405 μmol/l
- moč – záleží na pH. Při pH = 5 dochází k nasycení při 360 – 900 μmol/l, při pH = 7 při koncentracích 9500 – 12000 μmol/l.
Tedy jestli dojde k precipitaci krystalů, záleží na:
- koncentraci urátu
- v případě moči na jejím pH
- přítomnosti precipitačního jádra
Přestože jsou purinové nukleotidy syntetizovány a degradovány ve všech tkáních, uráty vznikají pouze v orgánech, které obsahují xantin oxidázu (játra, tenké střevo). Hladina urátů záleží na několika faktorech:
- I. Pohlaví a věku – hladina urátů po pubertě začíná u mužů narůstat, zatímco u žen zůstává stejná a srovnává se po menopauze.
- II. Alkohol zvyšuje jaterní metabolismus ATP (nárůst hladiny urátů) i hladinu laktátu (blokuje jejich renální exkreci). Oboje vede k hyperurikémii.
- III. Exogenní příjem purinů – striktní restrikce příjmu purinu (nejvíce obsaženy v játrech, vnitřnostech, ančovičkách a olivách) sníží hladinu urátu v séru o max. 60 μmol/l a jejich exkreci o max. 1,2 mmol/den.
- IV. Endogenní produkce purinů – vznik urátu je proces o celkem 11 krocích. Množství vzniklého urátu je ovlivňováno:
- aktivitou enzymů (nevíce aminofosforibosyltransferáza a hypoxantinfosforibosylrtansferáza)
- endogenní nabídkou purinů, která je zvýšená při všech stavech s vysokým buněčným obratem nebo zánikem buněk (leukemické blastické krize, tumor lysis syndrome, hemolýza, rabdomyolýza po excesivním fyzickém výkonu nebo status epilepticus).
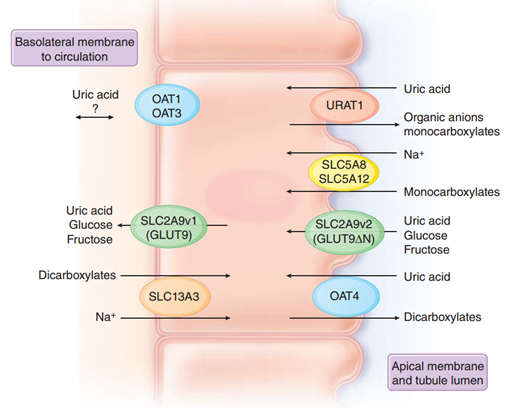
- V. Vylučování urátů – kyselina močová je z cca 70 % vylučována ledvinami, zbytek játry. 90 % pacientů s hyperurikémií vykazuje poruchu vylučování (aby bylo vyloučeno dostatečné množství kyseliny močové musí být její koncentrace v plazmě nastavena na vyšší hladinu). Při CKD je určitá kompenzace ve vylučování kyseliny močové. kdy dochází k nárůstu její frakční exkrece a zvyšuje se jejich hepatální clearance. Renální exkrece probíhá zejména v proximálním tubulu souhrou řady transportérů:
- Na+ – monokarboxylátový kotransport (SMCT1, SMCT2) na apikální straně a Na+ – dikarboxylátový kotransport (SLC13A3) na bazolaterální straně zprostředkovávají vstup karboxylátů do tubulárních buněk, kde slouží jako substrát pro antiporty kyselina močová – monokarboxyláty + organické anionty (URAT1) a kyselina močová – dikarboxyláty anionty (OAT4) na apikální straně. To je důvod, proč karboxyláty (pyrazinamid, niacin, laktát, β-OH butyrát a acetoacetát) a dále zvýšené koncentrace Na+ v tubulární tekutině působí hyperurikémii.
- Symport kyselina močová – glukóza/fruktóza (GLUT9) na apikální i bazolaterální straně mohou za známý fakt, že nápoje slazené fruktózou mohou vyvolat hyperurikémii se zvýšeným rizikem dny.
Hyperurikémie
Epidemiologie – definována jako hladina kyseliny močové v séru > 405 μmol/l. Prevalence hyperurikémie záleží na populaci a lze ji odhadnout na 10 %, zatímco prevalence dny na 2 %. Je velmi častou komplikací (někdy složkou) metabolického syndromu. Terapie asymptomatické hyperurikémie je vhodné zahájit při hladině > 540 μmol/l.
Diagnostika
- Stanovení hladiny kyseliny močové v séru
- Stanovení exkrece kyseliny močové do moči pomůže ke zjištění, zda je přítomna snížená exkrece. Muži na bezpurinové dietě s normální renální funkcí normálně vyloučí < 4,2 mmol urátů/den. Pokud je přítomna hyperurikémie a nedochází ke zvýšení exkrece urátů v moči jde o „hypoexkretory“, pokud je přítomna hyperurikémie i přes zvýšené vylučování urátů ledvinami, jde o „overproduktory“.
Komplikace
- Dnavá artritida – nejčastější komplikací (6 % mužů a 2 % žen), riziko vzniku je přímo úměrné hladině urátů v séru.
- Nefrolitiáza – vyskytuje se většinou u jedinců trpící současně dnou. Při hladině urátů v krvi 770 μmol/l a vylučování v moči > 6,5 mmol/den je riziko urátové nefrolitiázy 50 %. Urátová litiáza může sloužit i jako jádro pro vznik kalcium oxalátových kamenů. Terapie je doporučena u všech pacientů se dnou a urátovým nebo kalciumoxalátovými kameny. Vždy je doporučen dostatek tekutin k dosažení diurézy > 2 litry denně a ke zvážení je alkalizace moči (bikarbonát, acetazolamid). Specifickou léčbou je podání inhibitorů xantinoxidázy:
- Allopurinol 1 x d, (poločas 18 hodin). Účinek za 24 hodin, maximum za 2 týdny.
- Febuxostat lze podávat také jednou denně.
- Urátová nefropatie – nyní poměrně vzácná a pozdní manifestace těžké hyperurikémie s nálezem krystalů urátu sodného obklopených velkobuněčnou zánětlivou reakcí v intersticiu ledvin. Všichni jedinci mají anamnézu dny.
- Acidurická nefropatie – akutní selhání ledvin vzniklé precipitací krystalů kyseliny močové v tubulech a sběrných kanálcích ledvin. Vzniká za situace náhlého zvýšení hladiny kyseliny močové v krvi (leukemické blastické krize, tumor lysis syndrome, hemolýza, rabdomyolýza po excesivním fyzickém výkonu nebo status epilepticus). K prevenci vzniku při tumor lysis syndrom je indikováno preventivní podání rasburikázy a dále v terénu dehydratace a acidózy. Neléčená má mortalitu cca 50 %, léčená téměř nulovou. Důležitější než sérová hladina kyseliny močové (může být 720 – 4800 μmol/l) je koncentrace kyseliny močové v moči. Léčbu je nutné zahájit okamžitě. Indikována forsírovaná diuréza (krystaloidy + i.v. furosemid) k dosažení diurézy > 100 ml/h, alkalizace moči s dosažením pH moči > 7,0 (acetazolamid, bikarbonát), allopurinol v jednorázové dávce 8 mg/kg, při přetrvávání AKI je nutná redukce dávky na 100 – 200 mg/den (aktivní metabolit oxypurinol se hromadí při renálním selhání) hemodialýza.
Dna
Epidemiologie a etiologie
- Geograficky – odpovědny odlišné enviromentální, dietní a genetické vlivy. Všeobecně lze říct, že prevalence hyperurikémie i dnavých záchvatů celosvětově roste. Roční incidence akutního dnavého záchvatu v USA je 1:770 dospělých a je příčinou návštěvy pohotovosti v 0,2 % případů. Objevuje se častěji na jaře a méně často v zimě (proč se tak děje, není známo). Ve Velké Británii je roční incidence dnavého záchvatu 1:370 (muži postiženi 3,3 x častěji než ženy) a vzrůstá s rostoucím věkem (2007). V Itálii je roční incidence dnavého záchvatu je 1:110 (muži postiženi 4 x častěji než ženy) a vzrůstá s rostoucím věkem (2009).
- Pohlaví – více ohroženi jsou jednoznačně muži, estrogeny mají mírný urikosurický efekt a proto se rozdíly zmenšují po menopauze. Urikémie u mužů roste postupně od puberty.
- Věk – dnavý záchvat se poprvé objevuje nejčastěji ve věku 30 – 60 let (při genetické a enviromentální predispozici mnohem dříve). Hyperurikémie bývá obvykle přítomna 10 – 20 let před primomanifestací záchvatu. Ve věkové skupině 70 – 79 let je riziko dny téměř 5 x vyšší než u osob mladších 50 let (toto pravděpodobně souvisí i s vyšší četností metabolického syndromu, léčby diuretiky a ASA a chronického srdečního selhání). Výrazně dřívější manifestace je při genetické poruše (nejčastěji enzymovém defektu).
- Rasa – u Afro-Američanů je roční incidence dnavého záchvatu 1:320, zatímco u bílé rasy jen 1:500. Frekvence dny je nejvyšší u Maorů a Chamorrů (kmen v Malajsii a Polynésii) a indiánů kmene Blackfoot a Pima. Naopak u černé populace žijící v Africe je dna extrémně vzácná.
Etiologie viz výše.
CAVE Triggerem dnavého záchvatu není absolutní množství kyseliny močové, ale rychlá změna její hladiny.
CAVE Nutno vždy vyloučit zejména septickou artritidu.
Patofyziologie – dna je metabolická porucha vyvolaná akumulací kyseliny močové s následnou hypersaturací a precipitací urátových solí ve formě jehlicovitých krystalů, jejichž srážení napomáhá kyselé prostředí a nízká teplota (důvod, proč jsou postiženy zejména periferní klouby). Kromě geneticky daných poruch (raritní), jsou hlavními vyvolávajícími faktory ty enviromentální. Dnavý záchvat je vyvolán uvolněním urátových krystalů (např. rozpuštění mikrotofu spuštěné změnou urikémie) nebo jejich precipitací v hypersaturovaném prostředí (např. uvolnění kyseliny močové buněčným poškozením). Krystaly poté interagují s intracelulárními a povrchovými receptory místních dendritických buněk a makrofágů s následným spuštěním imunitního systému. Tato interakce může být zesílena vazbou IgG. Dalším krokem je uvolnění IL-1β, které spouští kaskádu prozánětlivých cytokinů (IL-6, IL-8, TNF-α). Tuto reakci tlumí antagonisté receptoru IL1RA nebo TGF-β. Celkové množství kyseliny močové v organismu pacientů s dnou je až 1000 x vyšší, než u zdravých jedinců.
Hlavním rizikovým faktorem dny je zvýšená hladina kyseliny močové v séru (dle rozsáhlé studie je celkové riziko rozvoje dny 32 x vyšší u hyperurikemické populace, než u té normourikemické, v podskupině mužů s velmi závažnou hyperurikémií bylo toto riziko dokonce 625 x vyšší).
Klinický obraz
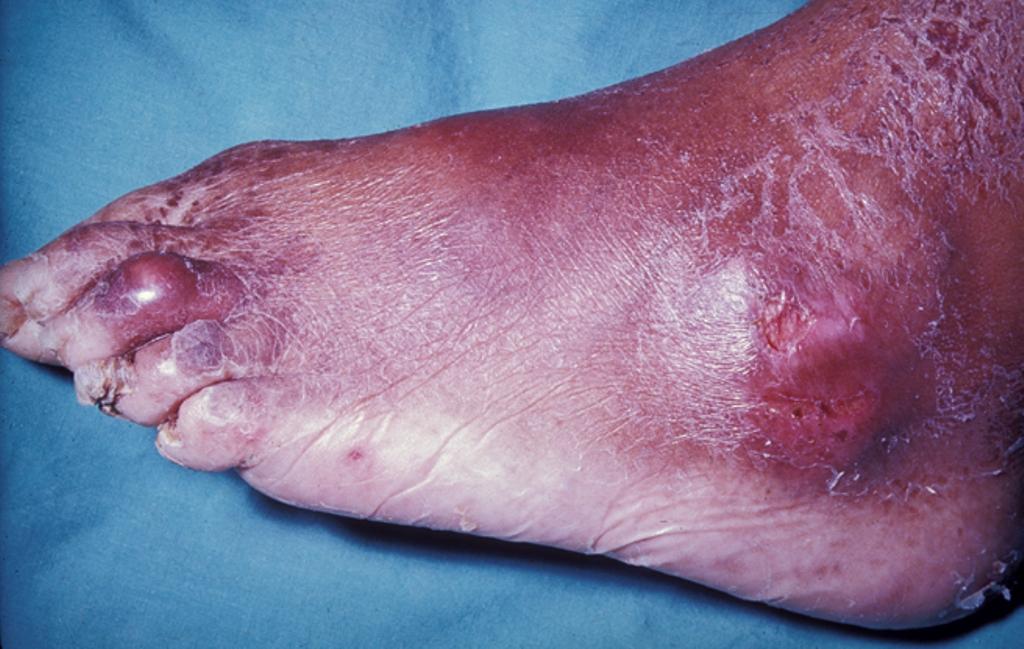
1. Akutní dnavý záchvat – typickým projevem je náhlá a intenzivní bolestivost, zarudnutí, zánět a otok prvního MTP kloub (iniciálně postižen u 50 % pacientů a u 90 % během dalšího průběhu choroby – podagra), mezi další postižené klouby patří klouby prstů, zápěstí, kotníky a kolena (postižení ramenou je vzácné). Nejčastější je monoartikulární forma, nikoliv vzácné je i polyartikulární postižení (nejčastěji postiženy malé klouby prstů nohou a rukou a kolena). U 10 % pacientů choroba začíná polyartikulárně, v ostatních případech je polyartikulární postižení zejména v případě pozdní léčby. Vzácně vzniká migrující polyartritida nebo se může projevovat syndromem karpálního tunelu. Maximum obtíží je po 8 – 12 hodinách od začátku záchvatu. Bez léčby jsou záchvaty delší, intenzivnější a postihují více kloubů, včetně proximálně uložených a těch na horních končetinách. Při fyzikálním vyšetření jsou přítomny známky zánětu (otok, zarudnutí, teplota a napětí postiženého kloubu) včetně horečky (připomíná infekční artritidu). Akutní dnavý záchvat většinou bez léčby ustupuje do 10 dnů. Na počátku choroby udávají někteří pacienti anamnézu opakované artritidy, která spontánně ustupuje.


2. Chronická dnavá artropatie – může mít polyartikulární formu a připomínat revmatoidní artritidu. Pokud tato chronická artritida začíná opakovanými akutními záchvaty, je v prvé řadě nutné myslet na dnu. Na charakteristických místech lze prokázat dnavé tofy (helix ušního boltce, prsty, palce nohou, prepatelární burza, olecranon). Dna může postihovat i oči (tofy, dnavé uzlíky spojivek, pruhovitá keratopatie, rozmazané vidění, vzácně přední uveiditida a episkleritida). Krystaly v měkkých tkáních jsou nejlépe prokazatelné při fixaci 100 % alkoholem. Jejími komplikacemi jsou:
- těžká degenerativní artritida
- fraktury v kloubech s tofózní dnou
- sekundární infekce
- urátová nefropatie a nefrolitiáza
- impingement syndrom nervů a míchy
- syndrom nervus interosseus posterior je vzácnou komplikací způsobenou kompresí zmíněného nervu, která se projevuje parézou svalů jím inervovaných, např. radiální dukcí ruky při snaze o sevření ruky v pěst (paréza m. extensor carpi ulnaris). Syndrom byl prokázán u pacientů s postižením lokte (častěji u pseudodny) a po intraartikulární aplikaci steroidů ustupuje.

Fyzikální vyšetření
- Postižení kloubů – nejčastější je monoartikulární forma (typicky I. MTP), přesto musí být vyšetřeny všechny klouby. Postižené klouby mají všechny atributy přítomnosti zánětu (bolestivost, zarudnutí, teplota a otok), hybnost je výrazně omezena bolestí a je často horečka (zejména při polyartikulárním postižení). Kůže kloubu je napnutá až se leskne (zrcátkový fenomén), v dalším průběhu se může olupovat. Stav připomíná infekční artritidu nebo celulitidu. Při chronické artritidě bývají klouby ztuhlé a oteklé, s různě vyjádřenou aktivitou zánětu.
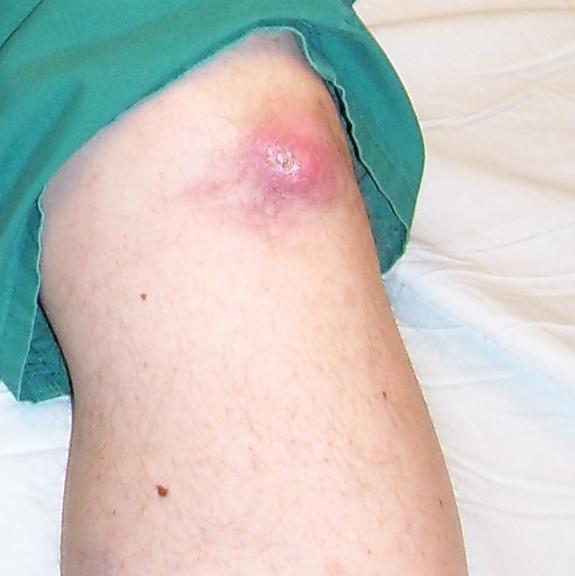
- Tofy – způsobeny depozicí urátových krystalů v synoviálních strukturách (typicky burzy a šlachy). Vznikají až po dlouhé době neléčené hyperurikémie (cca jedna dekáda), typicky u pacientů s chronickou dnavou artritidou. Dřívější vznik byl popsán u starších žen, zejména při současném užívání diuretik. Bývají lokalizovány typicky v oblasti helixu ušního boltce, dále na prstech (zejména palce nohou), prepatelární burze a olecranonu. Tofy mohou občas spontánně prasknout s evakuací bílých, krémovitých hmot. Svým vzhledem mohou připomínat revmatoidní uzlíky. Přítomnost podobných lézí u pacientů s negativním revmatoidním faktorem by mělo vzbudit okamžité podezření na dnu.


- Oči – postižení oči je způsobeno depozicí urátových krystalů, projevuje se rozmazaným viděním. Je vzácné, ale patří k celkovému obrazu dny:
- na očních víčkách mohou být přítomny dnavé tofy
- jehlovité krystaly na jejich vnitřní straně mohou působit mírnou keratitidu
- pruhovitá keratopatie způsobená krystaly v hloubce tkáně rohovky
- vzácně přední uveitida, hemoragická iritida, sekční nálezy prokázaly i přítomnost krystalů v okulárních svalech
Diagnostika – dle Janssena et al jsou pro dnavý záchvat typické tyto atributy:
- mužské pohlaví
- předchozí ataky artritidy v anamnéze
- nástup obtíží kratší než 1 den
- zarudnutí kloubu
- postižení I. MTP kloubu
- hypertenze nebo jedno či více kardiovaskulárních rizikových faktorů
- hladiny kyseliny močové v séru ˃ 350 μmol/l
Definitivním potvrzením dny je průkaz urátových krystalů v aspirované synoviální tekutině při absenci ostatních příčin artritidy.
I. Laboratorní vyšetření
1. Artrocentéza – zásadní u pacientů s podezřením na dnavou artritidu. Vždy je nutné vyšetření výpotku:
- pod polarizačním mikroskopem, protože průkaz krystalů je nezpochybnitelným diagnostickým důkazem. Krystaly urátu sodného jsou jehličkovité a pod polarizačním mikroskopem jeví silnou negativní dvojlomnost (pokud jsou ve směru polarizovaného světla, mají žlutou barvu, napříč jsou modré, senzitivita 84 % a specificita 100 %). Alkalizace snižuje jejich rozpustnost a naopak, enzym urikáza je rozpouští. Nutné je rozlišit od detritu, který nemá ostré hrany a nemusí být rovný.
CAVE Ve velmi časných stádiích mohou krystaly v kloubu chybět
CAVE Kortikosteroidy po injekci do kloubů mohou také krystalizovat do podoby jehliček s různě vyjádřenou dvojlomností.
- buněčná analýza, zejména diferenciální rozpočet leukocytů (typicky 10000 – 70000/μl)
- kultivace a stanovení citlivost na antibiotika
- biochemicky s nálezem normální hladiny glukózy ve výpotku (na rozdíl od septické artritidy, kdy bývá snížená)
2. Hladina kyseliny močové v séru – velké množství jedinců trpí hyperurikémií, přesto, jen malé množství z nich někdy během života postihne dnavý záchvat. Pětileté riziko akutního záchvatu u pacientů s urikémií:
- < 460 μmol/l = 0,6 %
- 461 – 530 μmol/l = 1 %
- > 530 μmol/l = 22 %
Vznik dnavých záchvatů nesouvisí s koncentrací kyseliny močové v séru (přesto 95 % pacientů trpí hyperurikémií), ale spíše s jejími rychlými změnami. Normourikémie proto nevylučuje dnavý záchvat, který může být vyvolán právě rychlým poklesem urikémie.
3. Celkové množství kyseliny močové v moči za 24 hodin – vyšetření indikováno u vysoce rizikových pacientů, např. po průkazu urátové urolitiázy, výrazně pozitivní rodinné anamnéze, záchvaty dny před 25 rokem života a dále pokud zvažujeme urikosurickou terapii, naopak při kontraindikaci urikosurik (anamnéza renální insuficience nebo nefrolitiízy) není stanovení urikosurie indikováno. Při denní renální exkrecí kyseliny močové při normální dietě:
- < 13,5 μmol – pacienti jsou underexkretory
- > 13,5 μmol – pacienti jsou overproducery i overexkretory, proto spíše profitují z allopurinolu
- > 18,5 μmol – vysoké riziko urátové nefropatie a litiázy (častá monitorace renálních funkcí)
Ostatní laboratorní metody
- během dnavého záchvatu je leukocytóza s posunem doleva a zvýšené FW
- renální funkce (urea a kreatinin) při podezření na urátovou nefropatii
- při dně bývá zvýšená hladina triacylglycerolů a snížené HDL
- glykémie, protože pacienti s dnou jsou často současně diabetiky
- jaterní testy, jejichž výsledek může ovlivnit volbu léčivého přípravku
II. RTG – poměrně specifické vyšetření. V časných stádiích je nález normální, pouze s otokem měkkých tkání. Eroze s převislými okraji jsou pro dnu typické (mohou být ale nalezeny i při amyloidóze, multicentrické retikulohistiocytóze a hyperlipoproteinémii IIa). Kloubní prostor je bez redukce, chybí periartikulární osteopenie, ale jsou přítomny sklerotické okraje („cookie cutter“). Tyto změny bývají asymetrické se silnou predilekcí postižení distálních kloubů dolních končetin. V pozdních stádiích může být patrno „zamlžení“, způsobené přítomností tofů, které mohou kalcifikovat.

III. Ultrazvuk – ultrazvukový obraz může být při prvním záchvatu normální. Ultrazvuk může prokázat i depozita urátových krystalů v tkáních. V pozdějších stádiích jsou patrné:
- dvojitá kontura kloubních chrupavek, která vzniká díky nepravidelné vrstvě urátových krystalů na povrchu chrupavku, pod kterou je normální chrupavčitá tkáň a poté další hyperechogenní vrstva subchondrální kosti
- materiál tofů vytvářející hypo- nebo hyperechogenní oblasti, ohraničené anechogenním lemem („wet clumps of sugar“)
- kostní eroze naléhající na tofózní depozita
IV. CT – užitečné k průkazu urátové uro- nebo nefrolitiázy.
V. MRI – může prokázat přítomnost větších depozit krystalů v burzách nebo vazech, ale není z této indikace rutinně prováděna. Je indikovaná k došetření etiologie postižení svalových šlach a při nutnosti vyloučení osteomyelitidy. V T1- i T2-vážených sekvencích mají tofy nízký nebo střední signál. Při absenci zánětu jsou tofy výrazně ohraničené, zvýšené signálu v okolí tofů značí jeho přítomnost. Signál tofů i okolního zánětu zesiluje gadolinium.
VI. Histologie – urátové krystaly jsou rozpustné ve vodě a tak je nelze při rutinních barveních prokázat. Chronická urátová depozita jsou v HE barvení zobrazena jako rozsáhlá bledě růžové acelulární oblasti složené z rozpuštěných krystalů, které jsou obklopeny histiocyty a obrovskými mnohojadernými buňkami. Pokud je krystalů velké množství, mohou některé z nich „přežít“ barvení a v tom případě se zobrazí jako šedohnědý materiál ve světelném mikroskopu nebo elegantně v polarizačním mikroskopu.
Diferenciální diagnostika – svým průběhem může připomínat septickou artritidu a pseudodnu. Dále je nutné vyloučit amyloidózu, burzitidu, kalcifikující periartritidu, vrozenou intoleranci fruktózy, kalcinózu spojivek, gonokokovou artritidu, hyperparatyreózu, Lesch-Nyhanův syndrom, maligní tumory měkkých tkání, milk-alkali syndrom, retikulohistiocytózu, paronychium, pigmentovou vilonodulární synovitidu, hyperaktivitu fosforibosyl pyrofosfát syntétázy, hyperlipoproteinémii typ IIa, pseudodnu, psoriatickou artritidu, reaktivní artritidu, renální osteodystrofii, spondylartropatie, revmatoidní artritidu, sarkoidózu, tenosynovitidu a trauma.
Terapie – léčba má několik složek:
I. Léčba akutního dnavého záchvatu – vždy je třeba stanovit správnou diagnózu, což je možné pouze rychlou analýzou kloubního výpotku (nediagnostikovaná septická artritida může vést ke ztrátě končetiny). Čím je léčba akutního záchvatu zahájena dříve, tím větší má efekt. Vždy je třeba redukovat zánět i bolest (NSAID, glukokortikoidy, kolchicin), volba léku záleží na komorbiditách (např. NSAID nejsou vhodné u pacientů s peptickými vředy). Pokud je limitováno použití NSAID i kolchicinu, je optimálním způsobem léčby intraartikulární injekce glukokortikoidů.
CAVE Před intraartikulární injekcí glukokortikoidů je třeba vždy vyloučit septickou artritidu.
CAVE Při akutním zánětu je snaha o změnu urikémie naprosto nevhodná (může prodloužit a zhoršit záchvat). Pokud je již léčba snižující hladinu kyseliny močové u pacienta zavedena, podáváme ji dál a její dávkování neměníme.
NSAID – lék volby u pacientů s dnavým záchvatem bez jiných komorbidit. Nejčastější volbou je indometacin, dobrý efekt mají ale všechny léky této skupiny (vhodnější jsou látky s rychlým nástupem účinku). Jediná nepřípustná je ASA, která ovlivňuje hladinu kyseliny močové a tak zhoršuje a prodlužuje dnavý záchvat. Ke zvládnutí akutního záchvatu by měla být podávána plná dávka po dobu 5 dnů s následným postupným vysazováním léku během cca 2 týdnů (měly by být podávány nejméně ještě 2 dny po vymizení příznaků záchvatu). NSAID jsou nevhodné u pacientů s anamnézou gastroduodenální vředové choroby, krvácení z GIT, při renální insuficienci, porušených jaterních funkcích nebo užívajících warfarin. Opatrnosti je třeba u starších jedinců (možnost nežádoucích neurologických účinků).
Kolchicin – mechanismem účinku je inhibice mikrotubulů a tak i fagocytózy, motility neutrofilů a chemotaxe, dále inhibuje syntézu prostaglandinů. V současnosti je na ústupu (úzké terapeutické okno a riziko toxicity) a nahrazován NSAID. Aby byl účinný, léčba musí být zahájena do 36 hodin od začátku obtíží. Hlavním nežádoucím účinkem u 80 % pacientů je průjem a zvracení. Dávkování: 1. den – úvodem 1 mg p.o. a dále á 2 hodiny 0,5 mg do celkové dávky 6 mg. 2. a další den – redukce dávek o třetinu. Léčba se ukončuje při podstatné úlevě od bolesti nebo nástupu nežádoucích účinků (průjem). Dávka se musí redukovat na polovinu při poklesu GF pod 0,8 ml/s, u pacientů s chronickým renálním selháním a jaterní insuficiencí je kontraindikován úplně.
CAVE Odpověď na kolchicin není pro dnu patognomonická. Obdobně dobře může reagovat i psedodna, sarkoidóza, psoriatická artritida nebo kalcifikující tendinitida.
Kortikosteroidy – užitečné při kontraindikaci NSAID nebo kolchicinu. Systémové kortikoidy nemají ve srovnání s perorálními žádný benefit. Lékem volby je prednison v dávce 40 mg po dobu 1 – 3 dnů s postupnou detrakcí během 2 týdnů. Při mono- nebo oligoartikulární formě je výhodná intraartikulární aplikace dlouhodobých glukokortikoidů.
Kombinační terapie je možná iniciálně u těžkých forem nebo při rezistenci k monoterapii. Vhodné kombinace:
- NSAID + kolchicin
- perorální kortikosteroidy + kolchicin
- intraartikulární kortikosteroidy + kolchicin / NSAID
Canakinumab – selektivní anti-IL-1β protilátka, u které bylo prokázáno, že výrazně snižuje bolestivost u akutního dnavého záchvatu. I přesto nebyl v této indikaci v roce 2011 schválen FDA.
II. Léčba chronické dny – asymptomatická hyperurikémie < 540 μmol/l bez hyperexkrece kyseliny močové ledvinami nemusí být léčena, u těchto pacientů by měly být sledovány renální funkce. Na druhou stranu, ACR doporučuje udržování urikémie < 350 μmol/l dokud nedojde k rozpuštění tofů a vymizení urátové artritidy.
U underexkretorů jsou indikovány urokosurika (probenecid) s měsíčním zvyšováním dávky, dokud není dosaženo požadovaného efektu. Doporučena je i alkalizace citrátem draselným a hojné množství tekutin.
Při chronické renální insuficienci jsou lékem volby inhibitory xanthin oxidázy (allopurinol a zejména febuxostat). Lékem druhé volby (při nedostatečném účinku nebo kontraindikaci inhibitorů xantin oxidázy) je probenecid, u kterého je ovšem třeba opatrnosti při glomerulární filtraci < 0,8 ml/s.
Zavedení terapie snižující urikémii vede často k vyvolání dalšího záchvatu a zhoršení depozice krystalů v kloubech, synovii a ledvinách. Někteří autoři doporučují nenasazovat tuto léčbu ani po prvním dnavém záchvatu a čekat, jestli se objeví druhý, poté je již tato léčba plně indikovaná (u některých pacientů se již dnavý záchvat nikdy neopakuje). Riziko recidivy po prvním dnavém záchvatu je 62 % do 1 roku, 78 % do 2 let, 93 % do 10 let.
Allopurinol – mechanismem účinku je blokáda xantin oxidázy a snížení produkce kyselinu močové. Nežádoucí účinky
- lehké (u 3 – 10 % pacientů) – dyspepsie, bolesti hlavy, svědivý makulopapulózní rash
- těžké (1 % pacientů) – těžký hypersenzitivní syndrom s horečkou, toxickou epidermální nekrolýzou, útlumem kostní dřeně, leukocytózou a eozinofilií, jaterním i renálním selháním a vaskulitidou. Vyskytuje se častěji u Thajců, Číňanů a Korejců, a pacientů s renální insuficiencí, kteří užívají thiazidová diuretika a jejichž iniciální dávka allopurinolu byla 300 mg/den a více. Pokud není jistota, mělo by se začít s dávkou 100 mg/den. Byla zjištěna výrazná korelace s nosičstvím alely HLA-B*5801. ACR doporučuje u vysoce rizikových pacientů vyloučení této alely pomocí PCR reakce.
- DRESS syndrom (0,4 % pacientů) s postižením kůže, jater a ledvin se může objevit až za 6 – 8 týdnů od zahájení terapie. Pravděpodobnou podstatou je buněčná imunitní reakce vyvolaná allopurinolem nebo jeho metabolity. Léčbou volny je N-acetylcystein a steroidy.
Dávkování – obvyklá iniciální dávka 100 mg/den (při CHRI 50 mg/den). Po 2 – 5 týdnech navyšování dávky do dosažení cílové urikémie < 350 µmol/l. Maximální dávka u pacientů se zdravými ledvinami je 800 mg/den (dle FDA). Po 6 měsících od zahájení léčby přerušit profylaxi kolchicinem.
Interakce – prodlužuje poločas azathioprinu a 6-merkaptopurinu, zvyšuje myelotoxicitu cyklofosfamidu, při současném podávání ampicilin/amoxicilinu je zvýšené riziko exantému.
Febuxostat – nepurinový inhibitor xantin oxidázy, podáván orálně a metabolizován játry (vhodný u CHRI). Obvyklá denní dávka je 80 mg/den, při potřebě až 120 mg/den.
Probenecid – snižuje tkáňové zásoby urátů inhibicí tubulární reabsorpce zvyšuje jejich renální exkreci. Někteří autoři doporučují před zahájením léčby probenecidem alkalizaci moči ke snížení rizika urátové nefrolitiázy. Dávkování – 250 mg 2x denně v úvodu po dobu 1 týdnu. postupné zvyšování na 500 mg 2x denně na 500 mg 4x denně.
Urikáza – nerekombinantní urát-oxidáza (nejčastěji peglotikáza), není doporučována jako lék první volby. Indikace:
- prevence těžké hyperurikémie po chemoterapii v rámci tumor lysis syndromu
- u vybraných pacientů i k primární léčbě dny (krátkodobé podávání u těžké tofózní formy může vést k debulkingu celkové urátové nálože, jejíž hladinu lze poté udržovat allopurinolem nebo febuxostatem)
Hlavními nežádoucími účinky je vysoká imunogenita s rizikem anafylaxe, infuzní reakce, indukce dnavého záchvatu a exacerbace městnavého srdečního selhání.
Vitamín C – mírný urokosurický efekt, v jedné studii vitamín C podávaný v dávce 500 mg/den snížil u pacientů bez dny urikémii o cca 30 µmol/l. Nevhodný u pacientů s nefrolitiázou, urátovou nefropatií a cystinurií.
Fenofibrát – spolu s redukcí VLDL, triacylglycerolů a celkového cholesterolu snižuje i urikémii. Naopak, nevýhodou je zvýšení hladiny kreatininu a vymizení všech těchto účinku po vysazení léku.
III. Profylaxe – jelikož léčba snižující hladinu kyseliny močové může vyvolat dnavý záchvat, je v prvních 6 měsících po zavedení této terapie vhodné podávat profylaxi dalšího záchvatu. Kolchicin má moc redukovat četnost recidivy o 85 %, navíc, pokud je podán při prvních známkách záchvatu, může jej ještě zvrátit.
- 1. volba – kolchicin (500 mg 1-0-1), při tomto dávkování je riziko NÚ z GIT 4 %, i toto dávkování může vést k myopatii (svalová slabost a zvýšení CK) a útlumu kostní dřeně – event. lze použít nízké dávky NSAID.
- 2. volba (při kontraindikaci předchozího) – ke zvážení nízké dávky prednisonu
IV. Ostatní opatření
1. Režimová opatření – jelikož jsou puriny obsaženy ve všech proteinech, nelze je z potravy zcela eliminovat.
- Pokud jsou pacienti obézní, je vhodné snížit tělesnou hmotnost, zároveň je nutné vyvarovat se hladovění.
- Dostatečná hydratace snižuje riziko dnavých záchvatů.
- Nutné omezení potravin:
- bohatých na puriny (ančovičky, sardinky, brzlík, vnitřnosti a masové extrakty)
- bohatých na fruktózu (např. pečivo slazené fruktózovým kukuřičným sirupem)
- alkoholu (pivo i destiláty)
- pacienti užívající kolchicin by se měli vyvarovat grepu a grepových šťáv
CAVE Restrikce purinů v potravě nesníží hladinu kyselinu močové o více než 60 µmol/l, proto je dieta sama o sobě v léčbě hyperurikémie nedostatečná.
2. Úprava farmakoterapie – pokud je to možné, pacientovi by se neměly podávat léky zvyšující urikémii (thiazidová diuretika, nízké dávky ASA zvyšující urikosurii, losartan zvyšuje urikosurii o cca 1 μmol/den).
V. Chirurgická léčba – tofy by neměly být chirurgicky evakuovány. Chirurgický zásah je indikován při vzniku komplikací (např. impingment syndrom míchy, neztišitelná bolest, ulcerace ve vtahu k tofózním erozím) nebo, pokud se nachází v kritické lokalizaci.
Prognóza – hyperurikémie je většinou spojena se zvýšením mortality (pravděpodobně v souvislosti s metabolickým syndromem) a je významným nezávislým rizikovým faktorem kardiovaskulární morbidity a mortality. Zajímavé je, že pro ženy toto pravděpodobně neplatí.
Důležitá je časná diagnostika i zahájení léčby. Pokud je zahájena včas a pacienti spulupracují, je prognóza excelentní. Při pozdní terapii je horší díky rozvoji renální insuficience. Situaci při pozdní nebo špatné léčbě dále zhoršuje řada komplikací (prasklé tofy se mohou sekundárně infikovat, chronická artritida vede k destrukci kloubů, vzácně vzniká impingement syndrom míchy).
CAVE V prvních 6 – 24 měsících hypourikemické terapie může být vyšší frekvence dnavých záchvatů.
Hypourikémie
Je definována jako hladina kyseliny močové < 120 μmol/l. Incidence je < 0,2 %. Nemá žádné příznaky, a proto nevyžaduje žádnou léčbu. Může být ale známkou vážnější choroby. Nejčastější příčinou je zvýšení exkrece kyseliny močové ledvinami, což lze prokázat sběrem odpadu kyseliny močové v moči:
- léky s urikosurickým účinkem (fenofibrát, losartan, fenylbutazon, jodové kontrastní látky, salicyláty ve vysokých dávkách, ACTH, vitamin C, estrogeny)
- celková parenterální výživa (pravděpodobně díky vysokému obsahu glycinu)
- SIADH
- Fanconiho syndrom (primární, sekundární při Wilsonově chorobě, mnohočetném myelomu, intoxikaci těžkými kovy)
- tumory, jaterní cirhóza, diabetes mellitus
- vrozené
Genetické poruchy
Hyperaktivita fosforibosylpyrofosfát syntetázy – X dědičná
Deficit hypoxantinribosyltranferázy
Porucha lokalizována na X chromozómu (postiženi pouze muži). Kompletní deficit (Lesch-Nyhanův syndrom) je spojen s hyperurikémií, urátovou nefropatií, choreou, mentální retardací a sebepoškozováním. Částečný deficit (Keelley-Segmilerův syndrom) je spojen s pouhou hyperurikémií.

Hereditární xantinurie
Deficit xantinoxidázy. 2/3 pacientů je asymptomatických, u zbytku se vyvine nefrolitiáza.
Porucha metabolismu pyrimidinů
Z poruchy metabolismu pyrimidinů je důležitý deficit 5´nukleotidázy, který působí hemolytickou anémii s bazofilním tečkováním erytrocytů. Specifická léčba neexistuje. Získané formy poruchy byly popsány při intoxikaci olovem a talasémii.
Nemoc z ukládání kalcium-pyrofosfát dihydrátu
Úvod – druhá nejčastější metabolická artropatie, která je způsobena depozicí krystalů kalcium-pyrofosfát dihydrátu (CPD) ve vazivových a hyalinních chrupavkách a synoviální membráně s následným vznikem kalcifikací. Choroba je často asymptomatická a prokazatelná pouze zobrazovacími metodami. Byla poprvé popsána v roce 1962.
Epidemiologie – častější ve vyšším věku (začíná se vyskytovat od 5. decennia, dříve bývá spíše při sekundární formě). Radiologické známky chondrokalcinózy má téměř 50 % jedinců > 85 let. Zhruba se stejnou četností se vyskytuje u všech ras, mírně častěji u žen (1,4:1).
Etiologie
- Primární CPPD – neznámá, předpokládá se zvýšení produkce ATP a následně i anorganického pyrofosfátu s jeho ukládáním v kloubech. Je prokázaná souvislost s věkem, roli hraje i genetická predispozice (vzácné vrozené formy bývají AD dědičné). Identifikovány defekty v genech ANKH a COL a dále v genu pro osteoprotegerin (regulace vývoje osteoklastů).
- Sekundární CPPD
- jistá koincidence CPPD s vyšším věkem, předchozím traumatem nebo chirurgickým zákrokem na kloubu, hypomagnezémií, hyperparatyreoidismem, hemochromatózou a hypofosfatázií
- pravděpodobná koincidence CPPD s hypotyreózou, dnou a familiární hyperkalciurií
- možná koincidence CPPD s akromegalií, diabetes mellitus, ochronózou, Wilsonovou chorobou
Patofyziologie – u pacientů s CPPD bývá popisována nadprodukce enzymů souvisejících s metabolismem ATP (nukleosid trifosfát pyrofosfohydroláza) v chrupavce. Anorganický fosfát váže kalcium s následnou depozicí CPP v chrupavkách a synovii. Častěji postižena hyalinní chrupavka, fibrokartilaginózní (menisky kolenou) ale mohou být zasaženy také.
Klinický obraz
- 1. Asymptomatická CPDD – nejčastější forma, často přehlédnuta. Pacient s asymptomatickými radiologickými projevy, nejčastěji chondrokalcionóza chrupavek kolena, triangulárního ligamenta zápěstí, symfýzy a acetabula.
- 2. Akutní pseudodna (25 % případů CPPD) – k precipitaci choroby může docházet po závažných inzultech (např. infarkt myokardu, srdeční selhání, iktus, chirurgický výkon, trauma) nebo při změně kalcémie. Mono- nebo oligoartikulární artritida (nejčastěji kolena nebo zápěstí), postižen může být ale i jakýkoliv jiný kloub, včetně I. MTP (imitace podagry). Projevy jsou podobné, jako u klasické dny, otok a bolestivost ale obvykle nejsou tak intenzivní, ale občas i ve formě pseudoseptického syndromu (akutní artritida + horečka + leukocytóza s posunem doleva). Oligoartikulární formy jsou vzácnější.
- 3. Pseudoartróza (50 % případů, polovina z nich trpí současně pseudodnou) – postihuje klouby, které jsou u primární osteoartrózy zasaženy vzácně (MCP, zápěstí, lokty a ramena), dále kolena (nejčastěji), PIP a páteř.
- 4. Pseudorevmatoidní artritida (5 %) – spojena se symetrickým zánětem PIP a MCP, otoky kloubů a ranní ztuhlostí.
CAVE Starší lidé mají pozitivitu revmatoidních faktorů v nízkém titru (nesmí být zaměněno za revmatoidní artritidu).
- 5. Pseudoneuropatický kloub (˂ 5 %) – těžká, destruující artritida postihující nejčastěji kolena. Na rozdíl od neuropatického kloubu není přítomna žádná jiná neurologická choroba. Ve stanovení diagnózy může pomoci přítomnost chondrokalcinózy.
Diferenciální diagnostika – je nutné zvážit přítomnost dny, pseudodny, hemochromatózy, hyperparatyreózy, hypotyreózy, osteoartrózy, revmatoidní artritidy nebo septické artritidy.
Revidovaná diagnostická kritéria CPPD (1997)
- Kritérium I – průkaz depozitů krystalů CPPD ve tkáních anebo synoviální tekutině (RTG, difrakční analýza, chemická analýza).
- Kritérium IIa – identifikace monoklinických nebo triklinických krystalů vykazující slabou dvojlomnost v polarizačním mikroskopu
- Kritérium IIb – přítomnost typických RTG kalcifikací
- Kritérium IIIa – akutní artritida, zejména kolen nebo jiných velkých kloubů
- Kritérium IIIb – chronická artritida, zejména kolena, pánve, PIP, MCP, zápěstí, lokte ramene, patrná zejména při akutní exacerbaci
Diferenciální diagnostika CPPD a osteoartrózy – nezvyklá lokalizace (MCP, zápěstí, lokty, ramena), RTG vzhled (zúžení RC nebo femoropatelárního kloubu, zejména izolovaně), vznik subchondrálních cystických formací, závažnost degenerace (progresivní s kolapsem a fragmentací subchondrální kosti a vznikem radiokontrastních intraartikulárních tělísek), variabilně vznik osteofytů kalcifikace šlach (zejména tricepsu, Achillovy šlachy a obturátorů)
- Definitivní diagnóza = splnění kritéria I nebo IIa + IIb
- Pravděpodobná diagnóza = splnění kritéria IIa nebo IIb
- Možná diagnóza = splnění kritéria IIIa nebo IIIb by mělo upozornit na možnost CPPD
Diagnostika
1. Laboratorní vyšetření – nebývá přínosné. Může být leukocytóza a zvýšení FW. Důležité je vyloučení metabolické podstaty CPDD (Ca, P, Mg, ALP, Fe, ferritin, vazebná kapacita železa, TSH, fT4).
2. Artrocentéza – nejdůležitější procedura, zejména u pacientů s pseudodnou. Získanou tekutinu je nutné vyšetřit pod polarizačním mikroskopem a provést její kultivaci.


3. Histologické vyšetření – průkaz kalcifikací (nejspecifičtější), zánětu a fragmentů chrupavky. Patognomonickým nálezem je přítomnost krystalů vykazujících slabou dvojlomnost v polarizačním mikroskopu, které mají rombický (kosočtvercový) tvar.
4. RTG – vždy by se měl provést RTG rukou, zápěstí, pánve (kyčlí a symfýzy) a kolen.
- Chondrokalcinóza je nejčastěji na kloubních i vazivových chrupavkách (koleno, triangulární ligamentum, symfýza, labrum glenoidale apod.), ale i kdekoliv jinde.
- Při pseudorevmatoidní formě mohou být prokázány kloubní eroze.
- Mohou být přítomny hákovité osteofyty (zejména II. – V. MCP, podobný obraz může být i u hemochromatózy).

5. MRI kloubu – neprůkazné, při 4T MRI lze nalézt krystaly CPPD.
6. Ultrazvuk kloubu – pomocí ultrazvuku lze prokázat krystaly CPPD i kalcifikace chrupavek (dle Gutiereze et al. dokonce s vyšší senzitivitou než při RTG).
Terapie – forma terapie závisí na manifestaci choroby:
- 1. Asymptomatická forma – nemusí být léčena, pokud není sekundární (hypoparatyreóza, hemochromatóza), v tomto případě je indikována léčba vyvolávající příčiny.
- 2. Akutní pseudodna – podobná jako v případě akutní dny:
- intraartikulární kortikoidy u oligoartikulární formy
- systémové glukokortikoidy u polyartikulární formy
- NSAID ve vyšších dávkách během akutních atak, v nižších dávkách jako prevence CAVE Gastrointestinální a renální nežádoucí účinky.
- kolchicin ve vysoké dávce jako lék poslední volby
- anakinra (anti-IL1 Ab) vzhledem k dominující roli IL-1 při vzniku pseudodnavého záchvatu, zejména u pacientů s renální insuficiencí a rizikem použití NSAID
Prevence akutního záchvatu je složitá, s variabilním výsledkem. Lze užít malé dávky NSAID nebo kolchicinu (600 mg 1-0-1).
- 3. Pseudoartróza – podobná léčbě při akutní osteoartrózy.
- 4. Pseudorevmatoidní artritida – malé dávky glukokortikoidů (např. prednison 5 g/den). Při těžkém průběhu s dominující destrukcí kloubu lze vyzkoušet metotrexát. Teoretickou cestou je pokus o odstranění kalcifikací chirurgicky.
Prognóza – zhoršení kvality života pro bolestivost, akutní ataky pseudodny a příznaky chronické artropatie. Je důležité zahájoit léčbu ještě před zničením cílových kloubů.