371. Fyziologie hypofýzy
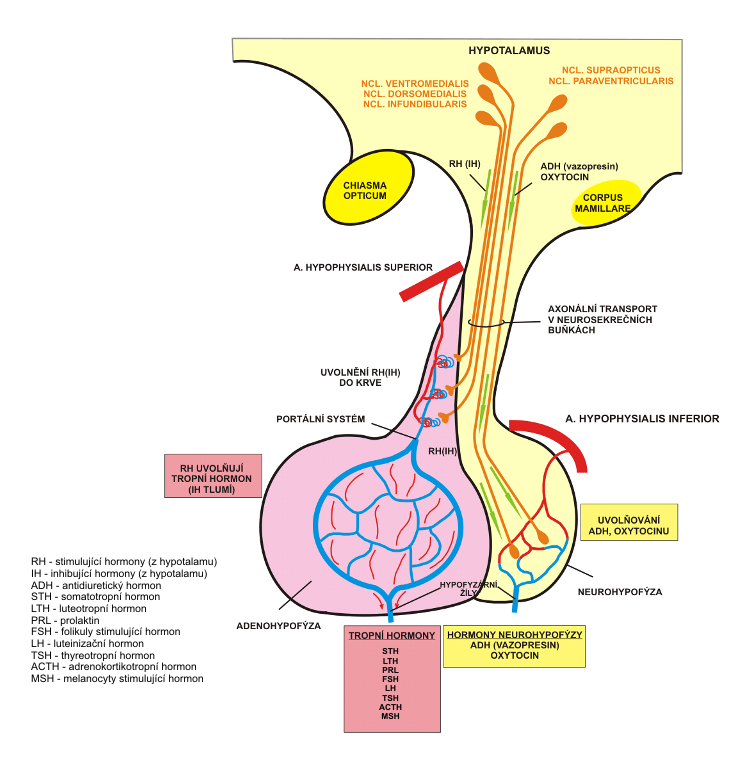
Anatomické a fyziologické základy – hypotalamus je částí mezimozku, který integruje signály z limbického systému se signály přicházejícími z periferie. V jádrech hypotalamu se nachází pulzový generátor, který reguluje vegetativní a hormonální funkce v čase. Řídí krevní tlak, pulz, tělesnou teplotu, spánek a bdění, příjem a výdej tekutin a potravy, tělesnou hmotnost a typ distribuce tuku. Hypotalamické jádra produkují hypotalamické hormony:
- ADH – antidiuretický hormon, který je tvořený v supraoptickém a paraventrikulárním jádře hypotalamu. Působí na distální tubuly ledvin a reguluje vodní hospodářství.
- Liberiny
- TRH – stimuluje sekreci TSH a prolaktinu.
- CRH – stimuluje spolu s ADH sekreci ACTH.
- GnRH – stimuluje sekreci FSH a LH.
- GHRH – somatoliberin, stimuluje uvolnění GH (jeho uvolnění stimuluje i ghrelin).
- Statiny
- somatostatin – inhibuje sekreci GH a TSH
- dopamin – inhibice sekreci prolaktinu
Hypofyzotropní hormony se dostávají k hypofýze pomocí portálního hypotalamo-hypofyzárního krevního oběhu. Větvičky a. hypophysialis superior se dělí na hustou kapilární síť prostupující hypotalamus (primární plexus). Tyto větévky se přes portální žíly sbíhají do tkáně adenohypofýzy, kde se opět větví do sítě prostupující adenohypofyzární buňky (sekundární plexus), část větévek prostupuje i do zadního laloku hypofýzy, tzv. neurohypofýzy. Menší část vláken jde zpět z hypofýzy do hypotalamu (tractus hypothalamo-hypophysialis). Některá vlákna končí v oblasti eminentia mediana, tedy ještě než se dostane do neurohypofýzy. To má klinický význam, protože tato vlákna mohou po operaci hypofýzy převzít funkci zásobárny ADH a oxytocinu, která je jinak v neurohypofýze, což pomáhá k odeznění pooperačního diabetes inspidus.
I. Hypotalamické hyperfunkční syndromy
Pubertas praecox
Definice – pubertas praecox je stav, při kterém dochází k rozvoji sekundárních pohlavních znaků před 8. rokem života u děvčat, popř. před 9. rokem života u hochů.
Klasifikace
- centrální – zvýšená hypofyzární sekrece gonadotropinů s fyziologickou stimulací gonád.
- periferní – zvýšená sekrece pohlavních hormonů gonádami bez centrální regulace.
Etiologie
- Expanze hypotalamu – jako příčina pubertas praecox častěji u hochů, nejčastěji jde o hamartomy, které mají schopnost vyvolat pulzní uvolnění gonadotropinů.
- Záněty hypotalamu.
- Idiopatické – častěji u děvčat.
Klinický obraz – nejprve se objeví pubické a axilární ochlupení, u dívek následuje pubertální vývoj prsu (telarche) a objevuje se menstruace (menarche). U chlapců se předčasně vyvíjí genitál, současně se zvyšuje tempo růstu, ale zároveň se i předčasně uzavírají růstové štěrbiny s výslednou nízkou postavou.
Diagnostika – zřejmá z klinického obrazu. Laboratorně lze potvrdit testem se syntetickým GnRH, při kterém dochází k živé odpovědi obou gonadotropinů. Současně je indikováno MRI k vyloučení organické příčiny. Zmíněné hamartomy jsou viditelné pouze na MRI, CT vyšetření je proto indikováno pouze při kontraindikaci MRI.
Terapie – Pokud je příčinou expanzivní proces hypotalamu, je nejdůležitější snaha o kauzální léčbu s odstraněním tohoto tumoru. Pokud operaci nelze, je snaha o farmakologickou supresi gonadotropinů z hypofýzy, pomocí superaktivních analog gonadoliberinu (triptorelin), snižujících citlivost hypofyzárních gonadotropinů na endogenní gonadoliberin. V terapii je nutno pokračovat až do přirozené puberty.
II. Hypotalamické hypofunkční syndrom
a) Diabetes inspidus centralis
viz níže.
b) Hypotalamický hypopituitarismus
S výjimkou prolaktinu jsou klasické hypofyzární funkce hypothalamem spíše stimulovány (převaha pozitivní regulace). Defekt syntézy hypothalamických „liberinů“ může způsobit poruchu příslušné hormonální osy.
Etiologie
- Vrozené příčiny – např. Kallmanův syndrom (olfaktogenitální dysplázie) s anosmií.
- Získané příčiny – viz příčiny diabetes inspidus centralis.
Klinický obraz – hypotalamický hypopituitarismus se projeví podobně jako jeho hypofyzární forma. Rozdílem je přítomnost některých neendokrinních hypotalamických příznaků, např. hypotalamické obezity u syndromu Prader-Willi. U získané formy je častá hyperprolaktinémie díky výpadku dopaminu produkovaného hypotalamem. U expanzivních forem bývá častý diabetes inspidus.
Diagnostika – základem je stanovení hladiny hormonů (viz hypofyzární hypopituitarismus), vyšetření MRI a vždy vyšetření perimetru.
Terapie – stejná jako při hypofyzárním hypopituitarismu s některými rozdíly, např. lze použít gonadoliberiny k léčbě hypotalamické infertility.
c) Endokrinologické změny při mentální anorexii
Regulace hypotalamických hormonů je podmíněna mimo jiné dostatečným přívodem některých živin, např. aminokyselin a glukózy. Při dlouhodobém nedostatku dochází k hypotalamické dysfunkci.
Klinický obraz
- Prvním příznakem bývá centrální amenorea.
- Koncentrace růstového hormonu bývá zvýšena (díky snížené tvorbě IGF-1).
- Zvyšuje se tvorba CRH se zvýšením koncentrace kortizolu.
- Podobně jako při každém katabolickém stavu se snižuje konverze T4 na T3. Sérové hladiny T3 jsou tak sníženy, rT4 je zvýšené, kdežto T4 a TSH je normální.
Terapie – základem je psychiatrická léčba, při těžké malnutrici je nutná realimentace. Včas je třeba zahájit substituci estrogenů, který se podílí na vzniku osteoporózy. Endokrinní odchylky upraví po normalizaci hmotnosti.
III. Choroby hypofýzy
Anatomické a fyziologické základy – hypofýza váží cca 600 mg, nachází se v tureckém sedle kosti klínové a skládá se z anatomicky i funkčně odlišné adeno- a neurohypofýzy. Cévní zásobení adenohypofýzy je zajištěno pomocí a. hypophysea superior a inferior a tvoří hypotalamo-hypofyzální portální plexus (viz výše). Neurohypofýza je zásobena z a. hypophysea inferior a je přímo inervována eferentními vlákny z nucleus supraopticus a paraventricularis, které prochází stopkou a kudy do ní přichází její hlavní dva produkty – vazopresin (ADH) a oxytocin. Hypofýza se původně vyvíjí z Rathkeho výchlipky.
Hormony adenohypofýzy
Prolaktin (PRL) = luteotropní hormon. Je kódován PRL genem na dlouhém raménku 17. chromozómu a buňky produkující PRL tvoří celkem 20 % objemu adenohypofýzy. Peptidový hormon (199 aminokyselin) má více než 300 účinků na lidský organismus. Jeho sekrece je inhibována dopaminem (secernovaný nukleus arcuatus hypotalamu) cestou stimulace D2 receptorů laktotropních buněk adenohypofýzy a stimulována TSH. Účinky:
- stimulace mléčné žlázy v prsou (je zvýšeně secernován na konci těhotenství při poklesu hladiny progesteronu na konci těhotenství).
- pocit sexuálního uspokojení s poklesem sexuálního vzrušení (působí proti účinku dopaminu, který je zodpovědný za sexuální vzrušení).
- fyziologické hladiny u mužů zvyšují hladinu LH, což vede ke spermatogenezi, vysoké hladiny potlačují ovulační cyklus inhibicí sekrece GnRH, FSH a LH a následně i testosteronu (u mužů) a estrogenů (u žen) a dále působí duševní problémy.
- stimuluje proliferaci a diferenciaci prekurzorových buněk v oligodendrocyty, zodpovědné za myelinizaci axonů v CNS a podporuje neurogenezi plodu.
- přispívá k tvorbě surfaktantu plodu na konci těhotenství.
- přispívá k imunitní toleranci plodu na konci těhotenství v těle matky.
PRL je produkován v hypofýze, decidue myometria, prsou, prostatě, lymfocytech a leukocytech. Během těhotenství estrogeny stimulují sekreci PRL, na druhou stranu estrogeny a progesteron potlačuje vlastní účinky prolaktinu. Na konci těhotenství náhle klesá hladina těchto hormonů, proto dochází ke zvýšení účinku PRL a zahájení produkce mléka, další stimulaci produkce PRL přebírá mechanické dráždění bradavek při sání dítětem a dále spouští produkci oxytocinu. Za obvyklých podmínek při ukončení kojení dojde k zastavení produkce mléka za cca 1 – 2 týdny. Mimo těhotenství hladina prolaktinu vrcholí během REM spánku a častých ranních hodinách. Stoupá po jídle, cvičení, pohlavním styku, stresu nebo epileptickém záchvatu. Při vazbě prolaktinu na receptor dochází k jeho dimerizaci a cestou JAK-STAT2 kinázy aktivaci genů. Normální hodnoty:
- u mužů – 3 – 7 μg/l
- u žen – 3 – 13 μg/l
- v těhotenství 10 – 200 μg/l
Růstový hormon (GH) – lineární polypeptid o 191 aminokyselinách se dvěma vnitřními disulfidickými můstky. Gen pro GH je umístěn na dlouhém raménku 17. chromozómu ve shluku pěti genů. Buňky tvořící GH (somatotropní) tvoří cca 50 % buněk adenohypofýzy. V plazmě se váže na GHBP (GH binding protein) a má plazmatický poločas 20 – 50 minut. GH má dvě vazebná místa pro receptory, tzn. když se naváže na jednu receptorovou podjednotku, jeho druhé vazebné místo přitáhne druhou podjednotku receptoru se vznikem homodimer, který je nezbytný pro aktivaci receptoru a následně různých intracelulárních kaskád (především cestou JAK2-STAT aktivace genů v jádře).
Sekrece GH je řízena dvěma hypothalamickými hormony, které jsou secernovány do portální hypofyzární krve:
- Somatoliberin (GHRH) – působí stimulačně. Jeho podání vede k rychlé sekreci GH (během minut), vrcholu dosáhne po 30 minutách a účinek přetrvává 60 – 120 minut. Plazmatický poločas je 50 min.
- Somatostatin (GHIH) – působí inhibičně na sekreci GH i TSH. Jeho dlouhopůsobícím analogem je oktreotid.
Vedle somatoliberinu a somatostatinu regulují sekreci GH další faktory:
GH se do krve vyplavuje v pulzech. Tato nepravidelná, intermitentní sekrece je spojená se spánkem a závisí na věku. Vrcholu dosahuje za 1–4 hodiny po usnutí (během spánkových fází 3 a 4). Tyto noční sekreční pulzy činí asi 70 % celkového množství secernovaného za den a jsou vyšší u dětí, s věkem se snižují.
Inzulinu podobné růstové faktory (IGF) – účinek GH je zprostředkován především insulinu podobnými růstovými faktory (IGF-I a IGF-II), GH má ale také některé přímé účinky – cestou cAMP). IGF-I a IGF-II jsou hlavními a u lidí pravděpodobně jedinými somatomediny v krvi. Oba mají strukturu podobnou proinzulinové molekule a oba se váží na proteiny plazmy (což prodlužuje jejich poločas v krvi). Nedostatek GH způsobuje nižší koncentrace IGF-I i IGF-II, ale nadbytek GH zvyšuje IGF-I aniž by ovlivnil IGF-II.
Účinky IGF-I:
- zvyšuje zabudovávání sulfátu (SO4)2- do chrupavek a tím stimuluje jejich růst.
- stimulační vliv na hematopoézu.
- stimulační vliv na tvorbu ovariálních steroidů, proliferaci a diferenciaci myoblastů.
- diferenciace oční čočky.
- potlačuje sekreci GH a stimuluje sekreci somatostatinu.
Před narozením sekrece IGF-I na růstovém hormonu nezávisí, po narození je však stimulována GH a IGF-I má výrazný stimulační účinek na růst. Koncentrace IGF-I v krvi stoupá v dětství a vrcholí v době puberty, pak klesá až k nízkým hodnotám ve stáří. Podávání IGF-I zvyšuje retenci dusíku a snižuje dusík močoviny v krvi a stimuluje růst u GH resistentních pacientů (Laronův nanismus).
IGF-II – receptor typu II přednostně váže IGF-II, většina účinků IGF-II se zdá být zprostředkována interakcí s receptorem typu I, byly popsány i nezávislé účinky IGF-II prostřednictvím receptoru typu II. IGF-II je na GH převážně nezávislý a má význam při růstu plodu před narozením. Další faktory regulující sekreci GH:
- Stimulační
- hypoglykémie (např. podání 2-deoxyglukózy, která způsobí intracelulární deficit glukózy, se zvýší sekrece STH)
- příjem potravy bohaté na proteiny, ale také proteinokalorická malnutrice (vede ke snížení tvorby IGF-I a tím k odpadnutí negativní zpětné vazby)
- intravenózní infúze aminokyselin (např. argininu), hladovění (díky tomu dojde k mobilizaci tuků jako zdroje energie a šetření proteinů)
- tělesná námaha, stres, dopaminergní a α-adrenergní agonisté.
- Pohlavní hormony, především estrogeny, a ß-adrenergní antagonisté zvyšují reakce STH na stimulační podněty (jako jsou arginin, inzulin).
- Snižující hladinu
- glukóza (využítí v diagnostickém testu akromegalie).
- ß-adrenergní agonisté a dopaminergní antagonisté.
- mastné kyseliny, nadbytek kortizolu hypo- i hypertyreoidizmus snížují citlivost na některé sekreční podněty, jako jsou arginin a hypoglykemie
Účinky růstového hormonu – stimulace lineárního růstu (většina růstového účinku je zprostředkována IGF-I) – zvyšuje proteosyntézu, snižuje proteokatabolismus přímým uvolněním mastných kyselin a zesílením jejich konverze na acetyl-CoA, dále podporuje ketogenezi). Zvyšuje výdej glukózy z glykogenu jater a svalů a je celkově diabetogenní se zvýšením inzulínové rezistence. Toto může nakonec vést až k vyčerpání B-buněk (snížení tvorby inzulinu). GH způsobuje pozitivní bilanci dusíku a fosforu. Zvyšuje hladinu fosfátů v plazmě a snižuje hladiny dusíku močoviny a aminokyselin v krvi. Nezávisle na nadledvinách (aldosteronu) se snižuje exkrece Na+ a K+ (tyto elektrolyty jsou směřovány do rostoucích tkání). Dále se zvyšuje resorpce Ca2+ v trávicím ústrojí. Během života se zvyšují hladiny IGF-I a dosahují maxima ve 13 – 17 letech, hladina IGF-II se však během postnatálního života nemění.
Adrenokortikotropní hormon (ACTH) – polypeptidový hormon o 39 aminokyselinách je derivován z POMC (proopiomelanokortin) prekurzorového proteinu, ze kterého následně vznikají i další peptidy jako β-endorfiny, metenkefaliny a α-melanocyty stimulující hormon. Buňky produkující ACTH tvoří celkem 20 % objemu adenohypofýzy. Regulace sekrece:
- Stimulace sekrece
- CRH – peptidový hormon z hypotalamu, který stimuluje transkripci POMC.
- ADH
- arginin
- prozánětlivé cytokiny (např. IL-6), stres, fyzická i psychická námaha, akutní onemocnění
- hypoglykémie
- Inhibice sekrece
- glukokortikoidy
Sekrece ACTH je vysoce pulzatilní (nejnižší o půlnoci, nejvyšší okolo 6. hodiny ranní) následuje ji i sekrece glukokortikoidů nadledvinami. Hlavní funkcí osy CRH – ACTH – glukokortikoidy je zachování metabolické homeostázy v období stresu. Receptorem pro glukokortikoidy je MC2R (melanocortin-2 receptor).
Gonadotropiny FSH a LH – buňky produkující gonadotropiny tvoří celkem 10 % objemu adenohypofýzy a syntetizují FSH a LH. Oba hormony jsou glykoproteiny, které se skládají z α a β podjednotek (α jsou společné pro FSH, LH, TSH i hCG, β zajišťují jejich unikátní funkce). Jejich produkce je regulována:
- GnRH (gonadotropin-release hormone) – peptid produkovaný hypothalamem v diskrétních pulzech o periodě 60 – 120 minut. pouze jeho pulzatilní sekrece vede k produkci gonadotropinů, pokud je sekrece kontinuální, dochází k inhibici jejich produkce (to je podstatou potlačení produkce gonadotropinů např. při léčbě karcinomu prostaty). Regulace sekrece:
- Estrogeny – jejich chronická expozice inhibuje produkci GnRH, FSH i LH, zatímco postupný nárůst v preovulační periodě má za následek další stimulaci sekrece FSH i LH.
- Progesteron – zpomaluje frekvenci pulzů GnRH, ale zvyšuje k němu citlivost.
- Inhibin a aktivin – gonadální peptidy, které ovlivňují hladinu FSH, ale nemají vliv na LH.
FSH u žen stimuluje vývoj folikulu a produkci estrogenů vaječníkem, u mužů stimuluje spermatogenezi, LH zprostředkuje ovulaci a udržení corpus luteum, u mužů stimuluje syntézu testosteronu.
Thyroid-stimulující hormon (TSH) – buňky produkující TSH tvoří celkem 5 % objemu adenohypofýzy. Skládá se z α a β podjednotek (α jsou společné pro FSH, LH, TSH i hCG, β zajišťují jejich unikátní funkce). Regulace sekrece:
- TRH – hypotaalamický tripeptid, který stimuluje produkci TSH i PRL.
- Hormony štítné žlázy, dopamin, somatostatin a glukokortikoidy – inhibují produkci TRH a tak i TSH.
Nejsilnější negativně zpětnovazebně působí hormony štítné žlázy, takže jakékoliv poškození jejich produkce štítnou žlázou (ozáření, thyreoidektomie, zánět apod.) má za následek zvýšení plazmatické hladiny TSH. Při dlouhodobě neléčeném hypothyreoidismu může tato dlouhodobá zvýšená sekrece mít za následek hyperplázii thyreotropních buněk a zvětšení hypofýzy.
Přestože je TSH také produkován v pulzech, jsou poměrně malé a tak lze hladinu TSH stanovit jednorázově v kteroukoliv denní dobu. TSH se váže na receptor štítné žlázy a stimuluje produkci jejích hormonů.
372. Hypopituitarismus
Definice – hypopituitarismus = nedostatečná funkce adenohypofýzy.
Etiologie
I. Primární příčiny – adenohypofýza vzniká migrací buněk z Ratkeho výchlipky nazofaryngu, jakékoliv poruchy postihující tuto oblast (krvácení, poranění, asfyxie) mohou vést ke vzniku hypopituitarismu.
Septooptická dysplázie – vzniká poruchou vzniku septum pellucidum nebo corpus callosum. Projevuje se např. rozštěpem patra, hypertelorismem, hypoplazií očního nervu, deformacemi uší, anosmií, syndaktylií a mikropenisem.

Kallmannův syndrom – vzniká v důsledku defektní syntézy GnRH v hypothalamu a projevuje se anosmií díky agenezi bulbus olfactorius. Mimo tento charakteristický znak se může projevovat celou řadou dalších poruch. Laboratorně je typický nález nízké hladiny GnRH, FSH, LH, testosteronu i estradiolu. Dlouhodobá aplikace hCG a testosteronu u mužů a cyklické podávání estrogenů a progestinu u žen vede k obnovení sekundárních pohlavních znaků a puberty. Při snaze o obnovení fertility jsou indikovány opakované pulsy GnRH (pumpou, obnovení sekrece FSH a LH) nebo cyklická aplikace FSH a LH.
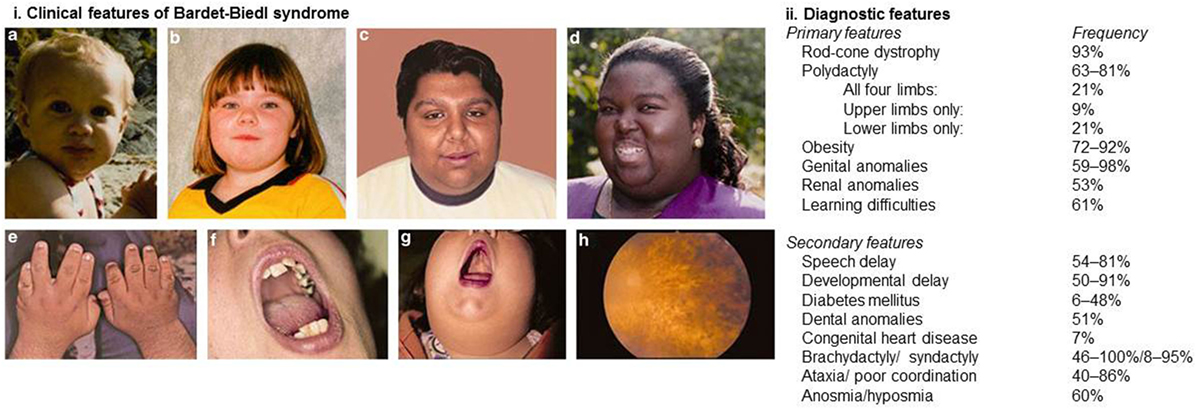
Syndrom Bardet-Biedlové – velmi vzácná genetická porucha charakteristická degeneraci sítnice (slepota většinou před 30. rokem života), mentální retardací, hexadaktylií a poruchami ledvin.
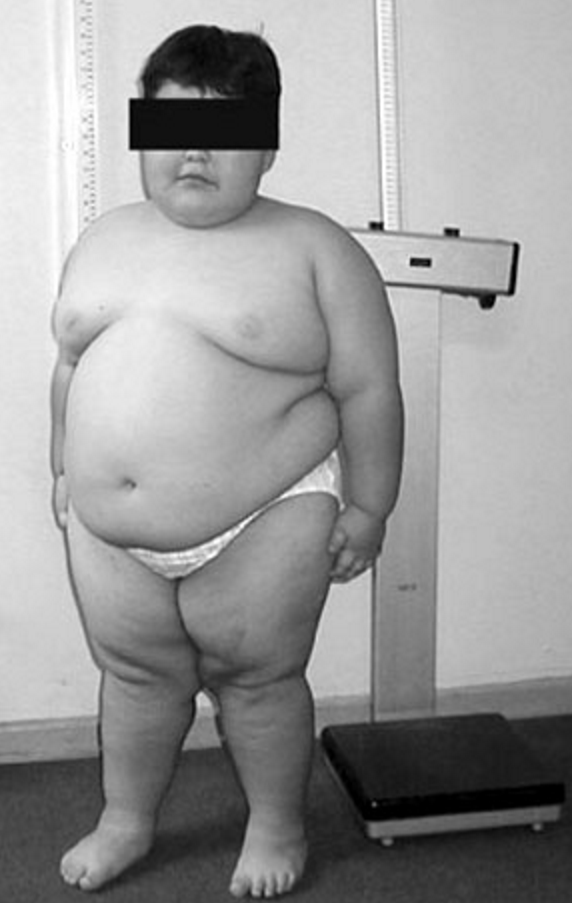
Syndrom Prader-Williho – projevuje se hypogonadotropním hypogonadismem, mentální retardací, chronickou hypotonií svalstva, hyperfágií s obezitou a vznikem diabetes mellitus v dospělosti.
II. Sekundární příčiny
- Mechanické – trauma, neurochirurgická operace.
- Cévní – aneurysmata.
- Tumory – adenomy hypofýzy, kraniofaryngeom a ostatní tumory v této lokalizaci.
- Infiltrační – sarkoidóza, hemochromatóza, amyloidóza, histiocytóza X.
- Záněty – tuberkulóza, oportunní infekce spojené s AIDS, terciární syfilis, granulomatózy.
- Lymfocytární hypofyzitida – nejčastěji vzniká u žen po porodu a projevuje se často hyperprolaktinémií a expanzí na MR mozku. CAVE Pokud u žen po porodu nově vznikne expanze hypofýzy je potřeba zvážit tuto diagnózu, protože jinak by mohlo dojít k záměně s adenomem a zbytečné neurochirurgické operaci.
- Ozáření hypofýzy – vzniká po 5 – 15 letech od ozáření hypofýzy, je přímo závislé na dávce (50 Gy vede k hypopituitarismu u 70 % pacientů).
- Apoplexie hypofýzy – krvácení do hypofýzy může vzniknout spontánně nebo do přítomného adenomu, po porodu (Sheehanův syndrom – během těhotenství dochází fyziologicky ke zvětšení hypofýzy, tedy jde o predisponující faktor), dále ve spojení s hypertenzí, diabetem, šokem nebo srpkovitou anémií. Jde o emergentní stav, projevuje se náhle vzniklou bolestí hlavy s meningeálním drážděním, změnami vízu, oftalmoplegií, šokem a smrtí. Je indikováno emergentní CT nebo MRI mozku. Při lehčích příznacích je možné zkusit postupovat konzervativně (vysoké dávky kortikoidů), při závažnějších příznacích (ztráta vízu, obrny hlavových nervů, poruchy vědomí), je indikována urgentní neurochirurgická operace. Po apoplexii je častý hypopituitarismu, proto je důležitý follow-up.
- Empty sella – často náhodný nález při MRI, který může být spojen s intrakraniální hypertenzí. Pacienti mohou mít často normální funkci hypofýzy (plně funkční lem zdravé hypofyzární tkáně).
Klinický obraz – závisí na deficitu jednotlivých hormonů. Obvykle dochází nejdříve k sekvenčnímu postižení sekrece v tomto pořadí: GH → FSH + LH → TSH → ACTH → prolaktin (obvykle jsou již přítomny známky hypogonadotropního hypogonadismu, takže se deficit prolaktinu neprojeví). Při postižení neurohypofýzy vzniká polydipsie, která při dlouhodobém trvání zhoršuje kardiovaskulární riziko.
Diagnostika – hypopituitarismus lze diagnostikovat při nízké nebo normální hladině hypofyzárního hormonu a nízké hladině periferního hormonu. K průkazu je někdy nutné použít provokační testy (provokační testy u adrenální insuficience je nutné provádět s rozmyslem, protože je tendence k hypoglykémii a hypotenzi, podobně je inzulinový toleranční test kontraindikován u ischemické choroby srdeční):
Terapie – základem je substituce chybějícího hormonu (mimo deficit prolaktinu). Dávky:
Deficit GH u dětí
Růstové chrupavky jsou ovlivněny celou řadou hormonů (GH, IGF-I, pohlavních hormonů atd.) a po zvýšení produkce pohlavních hormonů dochází k jejich rychlému uzávěru. Ke zdárnému růstu je potřeba i dostatek živin a energie. Růstový spurt vrcholí v kostním věku 12 let u žen a 13 let u mužů (cca 6 cm ročně). Opožděný kostní věk je většinou způsoben hormonálními nebo systémovými změnami, zatímco normální kostní věk a nízká výška poruchou růstové chrupavky. Příčiny:
- mutace receptoru pro GHRH – těžký nanismus spojený s nízkou hladinou GH, která nereaguje na podání GHRH.
- mutace receptoru pro GH – vyznačuje se necitlivostí k GH (Laronův syndrom). Diagnóza založena na vysoké hladině GH a nízké IGF-I. Vzácně je příčinou přítomnost protilátek proti receptoru GH.
- deficit GH v dětství – projevuje se nízkou postavou, zvýšeným množstvím tuku, vysokým hlasem, mikropenisem a tendencí k hypoglykémii (není antagonizován inzulín).
- nedostatečná nutrice, psychosociální faktory – reverzibilní po odstranění základní příčiny.
Nedostatek GH by měl být vyloučen, pokud je vzrůst dítěte > SD pro daný věk a pohlaví. Cílová výška dítěte lze velmi orientačně odhadnout z průměrů z výšky obou rodičů a přičtení/odečtení 6,5 cm u mužů/žen. Vzhledem k pulsatilní sekreci GH je nejlepší došetření pomocí provokačních testů (GHRH, argininový, dopaminový, insulinový toleranční). Normální je vzestup hladiny > 3 μg/l. Základem léčby je substituce GH.
CAVE Při průkazu deficitu GH je nutné vyloučení deficitu i ostatních hypofyzárních hormonů.
Deficit GH u dospělých
Nejčastěji vzniká získaným poškozením hypothalamu a hypofýzy. Typickým nálezem je změna složení těla (více centrálního tuku, méně svalů), únava, zhoršení výkonnosti i tolerance zátěže a trojnásobné zvýšení kardiovaskulárního rizika (hyperlipidémii, hypertenze, tendence k ateroskleróze). Syndrom je vzácný, proto by se měl vyloučit zejména při predisponujících faktorech (u pacientů po neurochirurgickém výkonu na hypofýze, nevysvětlitelném nedostatku IGF-I, potřebě GH v dětství a tumoru/granulomu/ozáření v této oblasti). K vyloučení je vhodný inzulinový test, který je ale kontraindikovány u diabetes mellitus, ICHS, cerebrovaskulárních onemocnění a epilepsie, pak je alternativou GHRH/argininový test nebo jeho kombinace. Léčbou je aplikace růstového hormonu v dávce, která udržuje normální hladinu IGF-I prodané pohlaví a věk. Léčba je kontraindikovaná u pacientů s aktivním tumorem, nitrolební hypertenzí a nekontrolovatelným diabetem a retinopatií. U 30 % pacientů vzniká po zahájení substituce retence tekutin, bolesti kloubů a syndrom karpálního tunelu a u > 40 % myalgie a parestézie.
Deficit ACTH
Nedostatek ACTH se projevuje únavou, slabostí, nauzeou, nechutenstvím a částečně hypoglykémií. Na rozdíl od periferního selhání nadledvin je sekrece mineralokortikoidů zachována. Nejčastější příčinou je rychlé vysazení glukokortikoidů, vznikat může i při jiných procesech, které utlačují hypofýzu nebo při lymfocytární hypofyzitidě. Projevuje nízkou hladinou kortizolu spolu s nízkou hladinou ACTH. Léčí se substitucí glukokortikoidů.
CAVE Při nemoci nebo stresu je nutné substituční dávku navýšit.
Deficit gonadotropinů
Častá porucha při hypopituitarismu, bývá pravidlem při hyperprolaktinémii. Z vrozených příčin časté např. při Kallmanově syndromu, ze sekundárních příčin často při anorexii, stresu, hladovění a výrazné fyzické zátěži. U žen se projevuje se poruchou cyklu, neplodností, sníženým libidem a atrofií mléčné žlázy. U mužů neplodností, snížením libida a potence, slabostí a snížením svaloviny, zvýšením podílu tuku, redukcí ochlupení a měkkými varlaty. U obou pohlaví vzniká typicky osteoporóza. Projevuje se nízkými nebo normálními gonadotropiny a současně nízkou hladinou testosteronu u mužů a estradiolu u žen. U mužů je i nízký počet spermií ve spermiogramu. Po i.v. podání GnRH, které stimulují gonadotorpní buňky hypofýzy k sekreci FSH (peak po 30 minutách) a LH (peak po následujících 60 minutách). Normální reakce hypofýzy znamená problém v hypothalamu, nedostatečná reakce znemožní odlišení hypothalamické/hypofyzární příčiny. Při centrálním hypogonadismu by mělo následovat došetření selární oblasti pomocí MRI.
- U mužů je léčbou podání testosteronu (i.m, náplast, gel), při hypothalamickém hypogonadismu pulsní podání GnRH, při snaze o obnovení fertility hCG.
- U premenopauzálních žen cyklická substituce estrogenu a progesteronu vedou k rozvoji sekundárních pohlavních znaků a prevenci premenopauzální osteoporózy. K indukci růstu a zrání folikulů indikováno FSH, při indukci ovulace LH nebo hCG, při hypothalamickém hypogonadismu pulsní podání GnRH.
373. Tumory hypofýzy
V tureckém sedle se mohou vyskytnout expanzivní procesy různé etiologie, např. cysty, tumory, záněty (sarkoidóza, TBC, lymfocytární hypofyzitida, absces apod.), cévní změny (aneuryzmata), malformace, hamatromy, granulomy. apod.
Adenomy hypofýzy lze rozdělit podle velikosti na mikroadenomy (< 1 cm v největším rozměru) a makroadenomy (> 1 cm v největším rozměru). Podle hormonální sekrece na afunkční adenomy a hormonálně aktivní (např. prolaktinom apod.). Histochemicky lze u většiny adenomů prokázat tvorbu hormonů, ale jde často o nekompletní molekuly, tedy jeví se jako afunkční (podobně jako většina gonadotropinomů).
Klinické příznaky – hormonálně aktivní adenomy se projevují jednak tvorbou hormonů (specifické u jednotlivých typů – viz dále) a jednak příznaky z lokální expanze struktur v okolí hypofýzy a jsou tak ovlivněny podle směru, kam se propagují:
- útlak samotné hypofýzy – hypopituitarismus
- nahoru s útlakem chiasma opticum (bitemporální hemianopsie, slepota, skotomy)
- dorzálně do hypothalamu (poruchy chuti k jídlu, poruchy vnímání žízně, hyperfágie, poruchy chování, autonomního nervstva, termoregulace, spánku apod.)
- do sinus cavernosus (diplopie, oftalmoplegie, ptóza víčka)
- do temporálního laloku (čichové halucinace)
- do frontálního laloku (anosmie, poruchy osobnosti)
- centrálním směrem (bolesti hlavy, hydrocefalus, demence, psychózy apod. )
Diagnostika – základem je hormonální vyšetření k odhalení případné autonomní nadprodukce hormonu, ze zobrazovacích metod je metodou volby MRI hypofýzy (CT až při kontraindikaci MRI), podrobné oční vyšetření (zejména k odhalení poruch hybnosti bulbů, zorného pole vyšetřením perimetrem a vizu).
Terapie – léčba hormonálně aktivních adenomů viz dále (obecně mimo prolaktinomů, kde je metodou volby léčba farmakologická, by ostatní adenomy měly být léčeny neurochirurgicky). Afunkční mikroadenomy je vhodné pouze sledovat, makroadenomy je vhodné po individuálním zvážení (věk, příznaky z lokální expanze) řešit chirurgicky (přístupem volby je transsfenoidální přístup přes nos), popřípadě ozářením (Leksellův gama nůž, méně lineární urychlovač). Při vzniku hypoituitarismus je nutné substituovat deficitní hormon.,
Prolaktinomy
Epidemiologie – prevalence je 1:8000, incidence 1:30000/rok.
- fyziologická hyperprolaktinémie – fyzická námaha, stres, soulož, těhotenství, šestinedělí, spánek, kojení.
- farmakologicky indukovaná hyperprolaktinémie (psychofarmaka, estrogeny, gestageny, blokátory H2 receptorů, metoklopramid, celková anestetika, opiáty, nikotin, methyldopa, verapamil).
- patologická hyperprolaktinémie
- endokrinopatie – prolaktinom, akromegalie, adenom GH+PRL, útlak stopky hypofýzy
- periferní hypothyreoidismus
- dráždění hrudní stěny, jaterní cirhóza, sclerosis multiplex, SLE, chronická renální insuficience, míšní léze
Etiologie
Klinický obraz
- ženy v reprodukčním věku – porucha menstruačního cyklu, infertilita, často galaktorhea. Vzhledem k tomu diagnostikováno často ve stádiu mikroadenomu.
- muži – snížení libida, erektilní dysfunkce, někdy gynekomastie, vzácně galaktorhea. Vzhledem k tomu diagnostikováno často až ve stádiu makroadenomu. Pokud vzniká již v dětství, dojde k zástavě pubertálního vývoje.
Diagnostika
- laboratorní metody – průkaz zvýšené sekrece prolaktinu odběrem jeho hladiny v plazmě. Norma je 3 – 7 μg/l u mužů, 3 – 13 μg/l u žen, v těhotenství 10 – 200 μg/l. U prolaktinomu většinou> 300 μg/l.
- zobrazovací metody – MRI hypofýzy – průkaz adenomu hypofýzy. Pouze v případě kontraindikace MR indikováno CT.
- oční vyšetření – perimetr – průkaz útlaku zrakové dráhy typicky s bitemporální hemianopsií.
Diferenciální diagnostika – pseudoprolaktinom = afunkční makroadenom, který utlačuje stopku hypofýzy, díky tomu omezuje průtok dopaminu do předního laloku hypofýzy a desinhibici sekrece prolaktinu. Hladina prolaktinu bývá nižší (většinou do 300 μg/l).
Terapie
1. volba je farmakoterapie agonisty dopaminu – cabergolin (nejlépe snášený), quinagolid, bromocryptin. Působí aktivaci hypofyzárních D2 receptorů pro dopamin, který působí inhibičně na sekreci prolaktinu. V počátcích léčby může dojít ke krvácení do adenomu (apoplexi), které se projeví intenzivními bolestmi hlavy, někdy i poruchami vizu. Vyžaduje okamžité neurochirurgické řešení.
2. volba je neurochirurgické řešení, event. radioterapie.
Prognóza – příznivá, pokud není příčinou maligní proces.
Adenom hypofýzy produkující somatotropin
Epidemiologie – incidence 1:250 tisíc/rok.
Etiologie
- hypofyzární adenom – téměř vždy.
- zcela vzácně z ektopické sekrece somatoliberinu (GH-RH) z karcinomů pankreatu a plic nebo autonomně z hypothalamických hamartomů.
- může být součástí genetických syndromů (např. MEN-I). Častá kombinovaná sekrece s prolaktinem, méně často s TSH.
Klinický obraz – v dětství se projevuje jako gigantismus, který je charakteristický především excesivním růstem (při současném hypogonadismu může růst trvat dlouho do dospělost). V dospělosti se projevuje jako akromegalie.
Příznaky:
- zvětšení akrálních částí těla – uši, nos, rty, mandibula (rozestup zubů, které mají větší kazivost), nadočnicové oblouky, prsty, jazyk (přítomné otisky zubů na jazyku). Pacienti pozorují, že jsou jim menší boty, prstýnky.
- organomegalie
- pohybový aparát
- akromegalická artropatie – důsledek excesivního růstu artikulujících ploch s poruchou artikulace a akcelerací vzniku artrózy a kloubních deformit.
- akromegalická myopatie, projevující se svalovou slabostí. Častý syndrom karpálního tunelu
- kardiovaskulární aparát – arteriální hypertenze, akcelerovaná ateroskleróza, akromegalická kardiomyopatie (hypertrofie, fibróza, systolická i diastolická dysfunkce) snižují průměrnou délku života cca o 10 let.
- cefalea
- otoky – zejména prstů rukou a nohou
- zvýšené pocení – hypertrofií potních, ale i mazových žlázek
- porucha glukózové tolerance – vzniká inzulinová rezistence se zvýšením rizika diabetes mellitus.
- vyšší tvorba střevních polypu, tedy mírně zvýšené riziko kolorektálního karcinomu
- syndrom spánkové apnoe
- nodózní struma – téměř vždy
- častá současná hyperprolaktinémie (příznaky mohou dále modifikovat průběh)


Diagnostika
- Laboratorní metody – průkaz zvýšené sekrece somatotropinu:
- ranní odběr hladiny GH nalačno 3x v hodinových intervalech (norma je 1 – 5 μg/l), doplněné stanovením hladiny IGF-I (také zvýšené při akromegalie, výhodou je stabilní hladina během dne)
- oGTT – mimo koncentrace glukózy měříme i koncentraci GH 1 a 2 hodiny po podání roztoku se 75 g glukózy (norma je suprese hladiny pod 0,4 μg/l)
- Zobrazovací metody – MRI hypofýzy – průkaz adenomu hypofýzy. Pouze v případě kontraindikace MRI je indikováno CT.
- oční vyšetření – perimetr – průkaz útlaku zrakové dráhy.
Terapie
- 1. volbou je neurochirurgický zákrok nejčastěji transsfenoidálním přístupem, při reziduu možnost ozáření.
- 2. volba při neúspěchu farmakologická léčba
- agonisté dopaminu (cabergolin, bromocryptin, quinagolid) jsou účinné jen u malé části GH produkujících adenomů s malou aktivitou, ideálně se smíšenou produkcí i prolaktinu.
- superaktivní analoga somatostatinu (lanreotid, octreotid) jsou velmi dobře účinná.
- 3. volba – při neúspěchu
- antagonisté růstového hormonu – pegvisomant – zábrana dimerizace a aktivace receptoru (obvykle s analogy somatostatinu). Účinek se monitoruje hladinou IGF-I.
Prognóza – čím pozdější rozpoznání choroby, tím je prognóza horší
Adenom hypofýzy produkující ACTH (Cushingova choroba)
V 90 % je příčinou kortikotropní mikroadenom hypofýzy (< 1 cm v průměru), v 10 % makroadenom hypofýzy (> 1 cm v průměru). Většinou solitární nález, velice vzácně v rámci syndromu MEN 1. Blíže viz choroby nadledvin.
Adenom hypofýzy produkující TSH
Vzácný typ adenomu. Produkované TSH stimuluje štítnou žlázu aktivací TSH receptoru a indukcí syntézy periferních hormonů se vznikem klinického obrazu hypertyreoidismu. Typickým nálezem je zvýšená hladina fT4 nebo fT3, spolu s normální nebo zvýšenou (tedy nesuprimovanou) hladinou TSH. MRI většinou prokáže adenom hypofýzy. Základem léčby je nejdříve normalizace funkce štítné žlázy (často velice obtížná) s následnou neurochirurgickou operací nebo radioterapií Leksellovým gama nožem. Při selhání terapie nebo při čekání na efekt radioterapie lze použít superaktivní analoga somatostatinu (oktreotid, lanreotid).
Adenom hypofýzy produkující gonadotropiny
Adenomy produkující gonadotropiny (LH a FSH) jsou velice časté, ale adenomy často produkují pouze neúplné molekuly gonadotropinů (nejčastěji FSH, ale i společnou α podjednotku, LH nebo kombinace hormonů) a pouze u jejich malé části dochází ke zvýšení jejich sérové koncentrace. Klinicky jsou tedy přítomny nejčastěji příznaky z expanze (hormony nejsou kompletní nebo je jich malé množství) až s rizikem vzniku hypopituitarismu z útlaku zdravé tkáně hypofýzy, pouze u malé části pacientů jsou přítomny příznaky z hyperfunkce (hypergonadotropní hypergonadismus). Laboratorně lze prokázat zvýšení koncentrace FSH a/nebo LH a/nebo α podjednotky popř. naopak hypopituitarismus, na MRI hypofýzy je průkaz adenomu. Léčbou volby je neurochirurgické odstranění makroadenomu, při nekompletní resekci adjuvantní radioterapie (nejčastěji Leksellovým gama nožem). Event. hypopituitarismus se léčí substitucí.
374. Choroby neurohypofýzy
Neurohypofýza je tvořena axony neuronů pocházejících z nucleus supraopticus a paraventricularis hypothalamu a produkuje antidiuretický hormon (ADH) a oxytocin.
Antidiuretický hormon
ADH je nonapeptid , který vzniká štěpením prekurzoru na ADH, neurofyzin a kopeptin, který je kódován na 20. choromozómu. Sekrece ADH je regulována:
- osmoreceptory v hypothalamu, které jsou extrémně citlivé na koncentraci sodíku a téměř necitlivé na koncentraci jiných solutů jako urea a glukóza. Při osmolalitě 280 mosmol/l (popř. natrémii 135 mmol/l) se začíná ADH uvolňovat do krve a své maximální koncentrace dosahuje při osmolalitě 294 mosmol/l a vyšší. Tato hranice bývá mírně posunuta směrem dolů při těhotenství, během menstruačního cyklu díky kolísání hladiny estrogenu a při akutní hypovolémii. Aktivací těchto receptorů je zároveň navozen pocit žízně, který je nastaven o cca 3 % výš než osmostat.
- hypovolémií kdy k uvolnění ADH dochází v případě ztráty > 10 – 20 % objemu tekutin.
- stimulována nauzeou (zvyšuje plazmatickou hladinu ADH 50 – 100 x), akutní hypoglykémií, deficitem glukokortikoidů, kouřením a zvýšenou hladinou angiotenzinu.
Hlavní účinky ADH:
- Snížení sekrece vody a zvýšení koncentrace moči:
- ADH se váže na na V2 receptory (Xq28) spřažené s G receptorem a aktivující adenylátcyklázu s externalizací aquaporinů 2 (12q13) a dramatickém zvýšení propustnosti distálního tubulu a sběrných kanálků pro vodu. Bez ADH dochází k vylučování velkého množství zředěné moči o osmolalitě cca 50 mosmol/l, s maximální koncentrací ADH stoupá osmolalita moči (s rostoucím věkem tato maximální koncentrační schopnost klesá).
- aktivace Na+/Cl– transportéru a K+ kanálu tlusté část vzestupného raménka Henleovy kličky vede k hyperosmolaritě dřeně ledvin, která je základní podmínkou vzniku protiproudového mechanismu. Transport urey dále renální osmotický gradient zvyšuje.
- Při vysokých koncentracích ADH stimuluje kontrakci hladkého svalstva cév kůže a GIT, glykogenolýzu v játrech a uvolnění ACTH. Tyto pochody jsou zprostředkované receptory V1a a V1b spřažené s fosfolipázou C.
Poločas v cirkulaci je 10 – 30 minut, degradace probíhá v játrech a ledvinách, během těhotenství je clearance zvýšeno 3 – 4x díky aktivitě placentární vazopresinázy.

Oxytocin
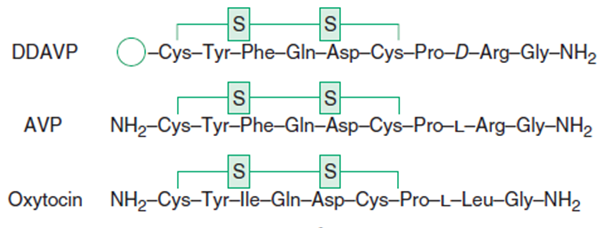
Nonapeptid, který se od ADH liší pouze v pozici 3 a 8. Účinkuje:
- v mammárních duktech a usnadňuje ejekci mléka během kojení.
- stimuluje kontrakce hladkého svalstva děložní svaloviny.
Diabetes inspidus
Definice – diabetes inspidus (DI) je vzácné onemocnění vzniklé důsledkem nedostatečné sekrece ADH nebo periferní odpovědi na něj. Typickým příznakem je polydipsie a polyurie. Diagnóza se stanoví koncentračním testem.
Etiologie – DI má řadu primárních i sekundárních příčin:
- 1. Idiopatický DI (> 50 % pacientů)
- 2. Primární DI
- Po neurochirurgickém výkonu se objevuje do 24 h po operaci, po několika dnech přechází v neadekvátní antidiurézu a po 2 – 3 týdnech DI částečně nebo úplně ustoupí.
- Genetické příčiny primárního DI – 5 různých forem.
- Poškození neurohypofýzy podobné jako adenohypofýzy.
- 3. Gestační DI – způsobený zvýšenou aktivitou placentární N-terminální aminopeptidázy. Příznaky vznikají během těhotenství a mizí během několika týdnů po porodu.
- 4. Primární polydipsie – patofyziologicky opak DI, kdy nadměrný přísun tekutin vede k inhibici sekrece ADH. Tři kategorie:
- Dipsogenní DI – neúměrná žízeň způsobená poklesem cut-off hodnoty osmostatu. Příčinou může být choroba CNS, častěji je idiopatický.
- Psychogenní polydispie – není spojena s žízní a nadměrné pití je spojeno s psychiatrickým onemocněním.
- Iatrogenní polydipsie – doporučení neúměrné konzumace tekutiny zdravým jedincům.
- 5. Nefrogenní DI – genetická (nejčastěji X dědičná mutace genu pro V2 receptor), získaná nebo poléková rezistence distálního tubulu nebo sběrných kanálků k ADH.

Patofyziologie – při DI dochází k hypovolémii, která vede k podráždění osmoreceptorů a zvýšenému pocitu žízně a polydipsii. Příčina DI a primární polydipsie je opačná:
- Při polydipsii nadměrný přísun tekutin vede k inhibici sekrece ADH. Pokud není polydipsie velice těžká, je pacient se zdravými ledvinami schopen vyloučit nadbytečnou tekutinu a k hyponatrémii nedochází.
- Naopak, při DI vede nedostatek ADH k polydipsii.
Klinický obraz – typickým příznakem je polypsie a polyurie, která je nepřímo úměrná reziduální sekreci ADH (při absolutním nedostatku může přesáhnout 10 litrů/den), kterou musí pacient „dopít“. Pokud jsou zároveň postižené osmoreceptory v hypothalamu může vést absence pocitu žízně k těžké dehydrataci.
Diagnostika – DI by měl být vyloučen u každého pacienta, u kterého diuréza přesáhne 2500 ml:
- Zásadní je anamnéza příjmu tekutin (vyloučení psychogenní polydipsie) a farmakologická anamnéza (diuretika, lithium).
- Každý pacient by měl mít vyšetřenou koncentraci iontů a osmolalitu v moči a séru.
- Diagnóza je v nejasných případech potvrzena koncentračním testem – pacienta necháme žíznit 36 hodin, á 4 hodiny bereme moč a stanovujeme močovou osmolalitu. U kompletního DI osmolalita moče nepřestoupí 200 mmol/kg, při částečném může stoupat. Normální hodnota závisí na věku (věk 15 – 20 let > 970 mmol/l, věk 21 – 50 let > 940 mmol/l, 51 – 60 let > 830 mmol/l, 61 – 70 let > 790 mmol/l, 71 – 80 let > 780 mmol/l). Současně se měří osmolalita séra, která roste. Test se přerušuje při poklesu tělesné hmotnosti o 3 % a více.
- Test s desmopresinem – centrální formu DI potvrzujeme poklesem diurézy a zvýšením osmolality moče po podání desmopresinu.
- V některých laboratořích lze přímo stanovit plazmatickou koncentraci ADH.
- Při MRI hypofýzy je u hypofyzární formy možné zjistit vymizení jasného signálu neurohypofýzy, kterým se neurohypofýza v T1W sekvenci liší od adenohypofýzy.
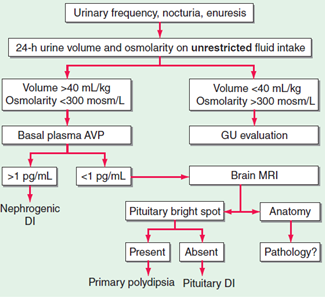
Terapie – závisí na typu DI:
- Hypofyzární typ DI je vhodné léčit desmopresinem (DDAVP), který je selektivním ligandem V2 receptorů s účinkem závislým na dávce a má 3 – 4x delší poločas než ADH. Nástup antidiurézy je rychlý s cílem dosažení osmolality moče 400 – 800 mosmol/l. Dávka se řídí diurézou, optimální je nejmenší dávka, která znormalizuje diurézu a odstraní pocit žízně. Při předávkování hrozí otrava vodou. Terapie je většinou celoživotní, pouze pooperační a posttraumatický diabetes inspidus bývá někdy přechodný.
- Primární polydipsii není možné léčit desmopresinem nebo jinými antidiuretiky protože eliminace diurézy (nebo i snížení exkrece čisté vody thiazidy nebo karbamazepinem) neeliminuje nadbytečné pití s vysokým rizikem hyponatrémie.
- Nefrogenní DI nelze léčit standardními dávkami desmopresinu (u parciálních defektů může být účinná až desetinásobná dávka, což je ekonomicky nepřijatelné). U 30 – 70 % pacientů má účinek kombinační léčba thiazidy a/nebo amilorid + restrikce soli + NSAID (např. indomethacin).
Prognóza – závisí na základní příčině DI, která pokud není závažná (tumor mozku apod.), tak prognóza samotného DI bývá dobrá. Je nutné se vyvarovat předávkování desmpresinem s rizikem otravy vodou nebo naopak dehydratace. Sekundární DI po neurochirurgických výkonech se často sám upraví během několika týdnů.
Hypodipsická hypernatrémie
Definice – hypernatrémie může vznikat díky poklesu celkové vody (nedostatečný příjem, např. při snížení pocitu žízně) nebo nadměrnému příjmu sodíku (nejčastěji primární hyperaldosteronismus). Při sníženém pocitu žízně dochází k recidivující hypertonické dehydrataci s typickými projevy hypovolémie (hypotenze, renální selhání, hyperurikémie a hypokalémie díky sekundárnímu hyperaldosteronismu, při těžších formách poruchy vědomí). Přes výrazné snížení ADH nebývá přítomen DI, který se ale může vyvinout při rehydrataci.
Etiologie – porucha většinou vzniká díky poškození osmoreceptorů předního hypothalamu (jak vrozené, tak získané příčiny podobné hypopituitarismu) nebo neuronů produkujících ADH. Hypernatrémie tedy nefunguje jako hlavní stimulus uvolnění ADH a podobně nedochází k pocitu žízně, při hypovolémii nebo nauzee a ostatních stimulech je sekrece ADH normální.
Patofyziologie – při hypodipsii je redukován pocit žízně a nedochází k náhradě renálních a extrarenálních ztrát a dochází tak k nárůstu osmolality a hladiny sodíku. Ztráty močí přispívají jen málo, protože pokud není destrukce jader hypothalamu kompletní i malé množství ADH stačí k určité koncentraci moči. Samozřejmě, při úplné destrukci hypothalamických jader je hladina ADH nízká s rizikem vzniku DI při rehydrataci.
Diferenciální diagnostika – hlavním vodítkem je situace, kdy u pacienta, který je plně při vědomí, má vysokou osmolalitu a hypernatrémii, chybí pocit žízně.
Terapie – léčbou volby je podání hypotonických roztoků s těsnou monitoraci osmolality a natrémie. U některých se během rehydratace vyvine DI s nutnosti desmopresinu, u jiných hyponatrémie podobné SIADH. Pokud se vyvine hyperglykémie nebo hypokalémie, je nutné ji zavčas hradit, protože může během rehydratace progredovat. Po dokončení rehydratace by měla být provedena ke zjištění příčiny a dlouhodobý plán k prevenci recidivy hypernatremické dehydratace. K zabránění edému mozku je potřena pomalé korekce hypernatrémie (pokles Na+ o max. 0,5 mmol/l/h).
Hyponatrémie způsobená neadekvátní antidiurézou
Mohou nastat tři situace:
- Hypervolemická hyponatrémie, kdy dochází k retenci čisté vody větší než sodíku (jaterní cirhóza, srdeční selhání). ↑↑voda + ↑Na
- Hypovolemická hyponatrémie, kdy je deficit sodíku výraznější než deficit vody (těžké průjmy, diuretika, deficit mineralokortikoidů). ↓voda + ↓↓Na
- Euvolemická hyponatrémie, kdy dochází k nadbytku vody při nemožnosti diluce moče a současně normálních zásobách sodíku (nejčastěji SIADH, nehemodynamický stimulus uvolnění ADH, např. nauzea, deficit glukokortikoidů nebo NSAID s ADH independentní aktivací V2 receptorů). ↑voda + normální Na
Jakákoliv antidiuréza vede ke snížení množství a zvýšení koncentrace moči. Pokud není redukce příjmu tekutin nebo není kompenzace zvýšenou extrarenální ztrátou (průjmy) dochází k retenci vody a hyponatrémii. Pokud je tato chronická, může být asymptomatická, při akutním vzniku dochází k příznakům otravy vodou (bolesti hlavy, zmatenost, nechutenství, nauzea, zvracení, křeče až kóma). Při hypervolemické formě bývají příznaky otoků, při hypovolemické naopak dehydratace.
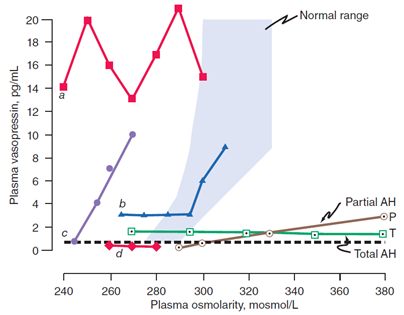
P – parciálni hypodipsie a nedostatečná sekrece ADH
T – parciálni hypodipsie a nedostatečná sekrece ADH.
Dochází k postupné hypovolémii a zvýšení osmolality, na kterou není pacient „upozorněn“ žízní a zároveň nedochází k vzestupu ADH.
a – plazmatické ADH je výrazně zvýšeno a výrazně fluktuuje bez vztahu k osmolalitě (= kompletní ztráta osmoregulace).
b – plazmatická hladina ADH zůstává lehce zvýšené, dokud pacientova osmaolalita nedosáhne normální hodnoty, poté stoupá normálně.
c – plazmatická hladina ADH stoupá adekvátně se vzestupem osmolality, ale celé nastavení osmostatu je posunuto výrazně doleva.
d – plazmatická hladina ADH je při hypoatrémii normálně snížena (= nepřiměřená antidiuréza má pravděpodobně jinou příčinu).
Etiologie – Existuje několik obecných příčin SIADH:
- ektopická produkce nejčastěji karcinomem plic nebo i jinými nádory.
- nadstimulace hypothalamu řadou nemocí (infekce, neurologické choroby) a léků (viz níže).
Patofyziologie – při antidiuréze vždy dochází k retenci tekutin (pokud není výdej jinými cestami). Dochází k expanzi extracelulárního objemu, který je kompenzován zvýšením glomerulární filtrace a koncentrace ANP a snížením aktivity RAAS a aldosteronu což vede k natriuréze, která na jednu stranu zvyšuje vylučování tekutin (sodík strhne velkou část vody se s vyloučením močí), ale dále zhoršuje hyponatrémii a expanduje tak intracelulární prostor. Dochází tak k otoku tkání a mozku, který sebou přináší hlavní příznaky otravy vodou.
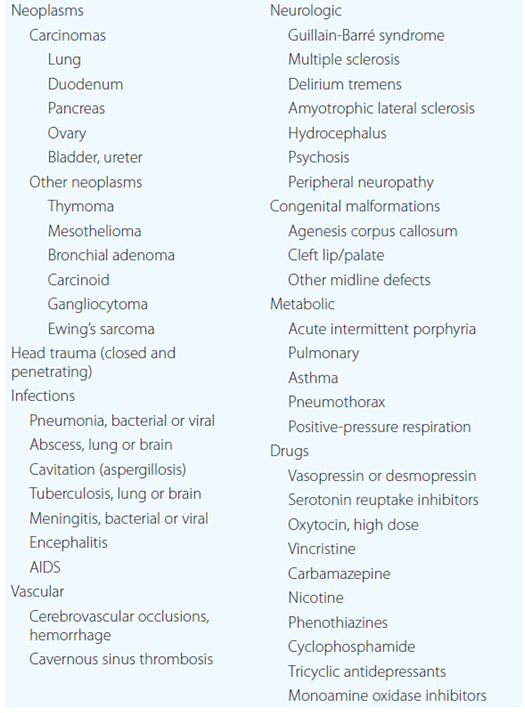
Diferenciální diagnostika – SIADH je diagnózou, která je stanovena per exclusionem (nejčastěji jako euvolemická hyponatrémie, u které je vyloučen hypotyreoidismus a hypokortizolismus). Postup:
- Nutné potvrzení hypoosmolality plazmy. Pokud je hyponatrémie normoosmolální, jde o pseudohyponatrémii, která vzniká např. při vysoké hladině lipidů / proteinů v séru nebo hyperglykémii (korekce – na každých 10 mmol/l vzestupu glukózy připadá pokles Na+ o 3 mmol/l).
- Hodnocení volémie (hypo-, eu-, hypervolémie?).
- Hodnocení osmolality moči. Interpretace:
- < 100 mosm/l – nadměrný příjem hypotonické tekutiny, např. piva, nedostatečný příjem solutů.
- > 100 mosm/l – diuretika nebo onemocnění ledvin.
- Stanovení koncentrace Na+ v moči. Interpretace:
- hypovolémie + Na+U < 30 mmol/l nejčastěji při sníženém příjmu sodíku nebo extrarenálních ztrátách (průjmy, zvracení, pankreatitida).
- hypovolémie + Na+U > 30 mmol/l nejčastěji při zvýšených renálních ztrátách sodíku (diuretika, primární insuficience nadledvin, CSWS).
- euvolémie + Na+U > 30 mmol/l při hypotyreóze, sekundární insuficienci nadledvin, při vyloučení tohoto je nejčastější SIADH.
- hypervolémie + Na+U < 30 mmol/l nejčastěji při srdečním selhání, jaterní cirhóze nebo nefrotickém syndromu.
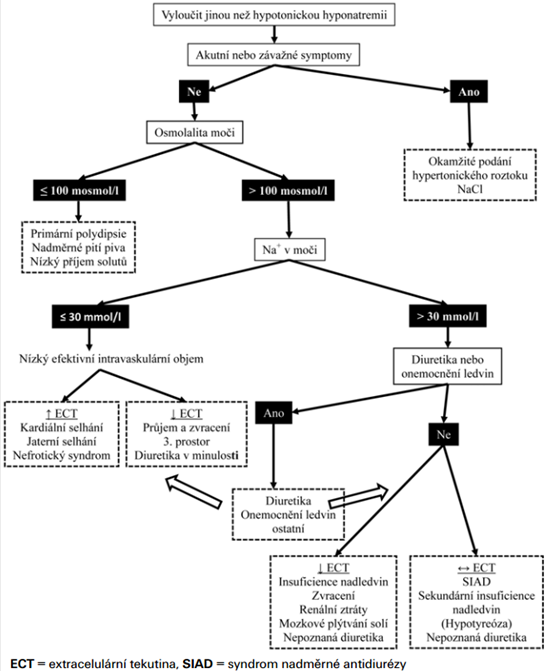
Kritéria SIADH – obecně hypoosmolalita séra s hyponatrémií a zároveň zvýšená osmolalita moči (koncentrace Na+ v moči > 30 mmol/l) za podmínek euvolémie společně s vyloučením postižení nadledvin i hypotyreoidismu.

Terapie – základním pravidlem při léčbě hyponatrémie je:
- U akutně vzniklé (< 48 hodin) nezvyšovat hladinu Na+ rychleji než 2 mmol/l/h.
- U chronické hyponatrémie (> 48 h) nezvyšovat rychleji než 0,5 mmol/l/h se zvýšením max. o 10 mmol/l za první den a 18 mmol/l za první dva dny. Nedodržením těchto pravidel vzniká vysoké riziko myelinolýzy.
- Výjimkou je přítomnost závažných příznaků (křeč, poruchy vědomí, kóma), kdy se podá akutně 150 ml 3 % NaCl (FR + 30 ml 10 % NaCl), kontrola Na+ po 20 minutách zatímco se podává dalších 150 ml. Opakovat, dokud nedojde k vzestupu S-Na+ o 5 mmol/l. Pokud se stav pacienta nemění pokračovat podávání NaCl tak, aby S-Na+ stoupalo o 1 mmol/l/h, při zlepšení stavu zpomalit, pokud se stav nelepší, zrevidovat příčiny obtíží a po 10 mmol/l nebo dosažení 130 mmol/l již S-Na+ nezvyšovat.
- Pokud jsou příznaky středně závažné (nejistota při chůzi, pády, poruchy kognitivních funkcí) zahájí se okamžitá infúze s cílem zvýšení S-Na+ o 5 mmol/l během 24 h s dodržením omezení nárůstu viz výše (bezpečnostní rezerva u menších symptomů).
- Při hypovolémii je nutné doplnění objemu fyziologickým roztokem.
- Při hypervolemii restrikce tekutin.
- Při SIADH restrikce tekutin, při neúčinnosti podání 0,25 – 0,5 g/kg urey nebo NaCl + diuretika. Při chronickém SIADH s lehčí hyponatrémií lze podat vaptany (nejsou vhodné u těžké formy pro riziko rychlé úpravy s rizikem myelinolýzy).