Kolorektální karcinom
Incidence – klesá posledních 25 let, nyní je 1:1400/rok, častěji u mužů a lidí z vyšších socioekonomických vrstev.
Etiologie – většina karcinomů vyroste z původně polypů, které mohou být hamartomy (např. juvenilní polyp), hyperplazie sliznice (hyperplastický polyp) nebo adenomatózní polypy (hlavním předchůdcem karcinomů), které se dělí na tubulární, tubulovilózní a vilózní (např. papilární (nejčastěji jsou přisedlé) malignizují se 3x častěji než tubulární polypy). Adenomatózní polypy lze nalézt v kolon u 30 % jedinců středního věku a 50 % vyššího věku, nicméně z < 1 % polypů se stává karcinom.
Pravděpodobnost, že polyp vs střevě je již maligní roste s jeho velikostí (u lézí < 1,5 cm je riziko < 2 %, u lézí 1,5 – 2,5 cm 2 – 10 %, u lézí > 2,5 cm pak 10 %).
U 30 – 50 % pacientů po odstranění adenomu tento recidivuje jinde a trvá > 5 let, než začne být klinicky významný. Doporučena je proto opakovaná kolonoskopie á 3 roky.
Rizikové faktory vzniku kolorektálního karcinomu
- Dieta – zvýšené riziko při konzumaci živočišné bílkoviny, tuku a oleje (např. Mormoni mají výrazně nižší riziko kolorektálního karcinomu). Jednou z hypotéz je, že červené maso je v tlustém střevě rozkládáno anaeroby za vzniku karcinogenů. Naopak, předpoklad, že konzumace vlákniny působí protektivně opakovaně nebyl v klinických studiích potvrzen.
2. Inzulínová rezistence – obézní jedinci trpí inzulínovou rezistencí se zvýšením hladiny insuline-like growth factor-I (IGF-I), který stimuluje proliferaci střevní sliznice.
3. Kouření – vyšší riziko je zejména při trvání kouření > 35 let.,
4. Vrozené faktory a syndromy – u více než 25 % pacientů s kolorektálním karcinome je přítomna i jeho rodinná anamnéza. Dědičné choroby lze dělit na dvě hlavní skupiny:
- polypóza tlustého střeva – vzácná AD dědičná choroba, v kolon jsou přítomny stovky až tisíce adenomatózních polypů. Základním preventivním i léčebným postupem zůstává kolektomie. Dle dalších znaků lze dělit na:
- Gardnerův syndrom – polypóza tlustého střeva, mnohočetné nádory kostí, měkkých tkání i mezenteriální desmoidní tumory, nádory čelisti, karcinomy Vaterské papily a vrozená hypertrofie sítnicového epitelu.
- Turcotův syndrom – polypóza tlustého střeva a maligní nádory CNS.
- vrozené nepolypózní syndromy (Lynchův syndrom) je AD dědičná výrazná predispozice ke vzniku kolorektálního a u žen ovariálního a endometriálního karcinomu. Diagnostická kritéria – v rodinné anamnéze jsou tři a více příbuzných s kolorektálním karcinomem (z nichž jeden je příbuzným druhého stupně zbývajících dvou), je přítomen v nejméně dvou generacích a u nejméně jednoho postiženého je diagnostikován ve věku < 50 let. Průměrný věk vzniku adenokarcinomu je < 50 let (o 10 – 15 let dříve než u zdravé populace). U postižených jedinců je od 25 let věku doporučena á 1 – 2 roky kolonoskopie a u žen gynekologické vyšetření s biopsií endometria.
5. Nespecifické střevní záněty – riziko karcinomu je vyšší u pacientů s ulcerózní kolitidou než Crohnovou chorobou. Při ulcerózní kolitidě je po 25 letech trvání choroby riziko vzniku kolorektálního karcinomu 8 – 30 % (zejména při ulcerózní pankolitidy vzniku v mladším věku ). V případě aktivní choroby trvající > 15 let je proto ke zvážení provedení kolektomie.
6. Ostatní – dalším rizikovým faktorem je endokarditida nebo sepse jejichž původcem jsou fekální baktérie.
Screening kolorektálního karcinomu – v ČR si může pacient starší než 50 let zvolit jednu ze dvou metod:
- ve věku 50 – 55 let jednou za rok a v pozdějším věku jednou za dva roky test okultního krvácení ve stolici (TOKS). V případě pozitivity je indikována kolonoskopie. CAVE Cca 3 % jedinců má pozitivní TOKS, z nich má < 10 % kolorektální karcinom a naopak, 50 % pacientů s kolorektálním karcinomem má negativní TOKS.
- jednou za 10 let kolonoskopie.
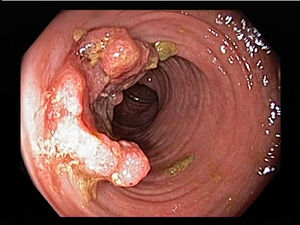
Klinický obraz – liší se dle lokalizace nádoru:
- v oblasti ileocékální oblasti a proximální části tlustého střeva je stolice ještě poměrně měkká, nedochází tedy k příznakům obstrukce a nádor může asymptomaticky narůst do poměrně velkých rozměrů a exulcerovat s dlouhodobým latentním krvácením a následnou sideropenickou anémií. Jelikož krvácení je intermitentní, je u 50 % pacientů s karcinomem TOKS negativní. K došetření každé sideropenické anémie je tedy indikována kompletní kolonoskopie.
- v oblasti transversa a descendentní části tlustého střeva je stolice již tužší, vznik tumoru má za následek onbstrukční příznaky se vznikem křečí, ileu až perforace střeva s následnou peritonitidou. Radiograficky lze prokázat typický výpadek kontrastu v lumen střeva („ohryzek jablka).
- v případě vzniku tumoru v oblasti rektosigmatu mohou být přítomny rektorhagie, tenesmy a tužkovitý tvar stolice.

Diagnostika a staging – záleží na velikost tumoru a přítomnosti metastáz do uzlin i vzdálených orgánů:
- povrchové léze, které nepronikají přes submukózu (T1) nebo muscularis mucosae (T2) se označují jako stádium I.
- hluboká léze, která proniká přes muscularis mucosae (T3), ale nezasahuje regionální lymfatické uzliny se označuje jako stádium II.
- při zasažení lymfatických uzlin (jedna až tři zasažené uzliny – N1, čtyři a více uzliny N2, přičemž by měl být nabrán vzorek z více než dvanácti uzlin), ale bez vzdálených metastáz se označuje jako stádium III.
- při přítomnosti vzdálených metastáz se označuje jako stádium IV (nejčastěji metastazují portálním systémem do jater a odtud do supraklavikulárních uzlin, plic, kostí a mozku). CAVE Při primárních nádorech distálního rekta může tumor obcházet játra paravertebrálním plexem a metastazovat přímo vzdáleně. Při vzdálených metastázách je průměrné přežití 27 – 30 měsíců.
Před zahájením terapie je vhodné stanovit hladinu karcinoembryonálního karcinomu (CEA) ke sledování event. recidivy tumoru po ukončení terapie. Obecně, nádory z distálních částí tlustého střeva mají lepší prognózu než z proximálních, pravděpodobně důsledkem odlišných molekulárně-genetických vlastností.
Terapie – léčba se řídí pokročilostí choroby.
- Karcinom kolon- jedinou léčebnou možností je radikální chirurgická resekce nádoru, před kterou je vždy nutné vyloučit přítomnost vzdálených metastáz (fyzikální a laboratorní vyšetření, z onkomarkerů zejména CEA, CT s kontrastem hrudníku, břicha a pánve, pokud je to možné kolonoskopie):
- karcinom in situ nebo stádia I – chirurgická resekce.
- stádium II – u nízkorizikových pacientů chirurgická resekce, u pacientů s vysokým rizikem (např. T4, high grade nádor apod.) chirurgická resekce + adjuvantní chemoterapie 5-fluorouracil (5-FU) + leukovorin (LV) nebo capecitabin.
- stádium III
- chirurgická resekce
- + adjuvantní chemoterapie 5-fluorouracil (5-FU) + leukovorin (LV) nebo capecitabin nebo FOLFOX (5-FU + LV + oxaliplatina) nebo CAPOX (capecitabin + oxaliplatina) nebo FLOX (5-FU + oxaliplatina).
- + neoadjuvantní chemoterapie – CAPOX, FOLFOX
- stádium IV (přítomnost vzdálených metastáz) – paliativní biologická terapie za použití inhibitorů receptorů epidermal growth factor (EGFR – cetuximab, panitimumab) a inhibitorů vascular endothelial growth factor (VEGF – bevacizumab). Biologickou terapii lze kombinovat s FOLFOX a FOLFORI. Samozřejmostí je paliativní terapie.
- Karcinom rekta – u velmi časných stádií lze zvážit provedení transanální endoskopické mikrochirurgie (TEM), pokud není dosaženo kompletní resekce nebo je riziko recidivy vysoké a mělo by následovat radikální resekční řešení a v individuálních případech lokální radioterapie nebo chemoradioterapie. U lokálně pokročilých karcinomů je možná totální neodajuvantní terapie – radioterapie + chemoterapie FOLFOX nebo CAPOX (studie rapido a PRODIGE23).
Problematika je velice složitá. Guidelines jsou dostupné zde: https://www.linkos.cz/lekar-a-multidisciplinarni-tym/personalizovana-onkologie/modra-kniha-cos/aktualni-vydani-modre-knihy/28-4-zhoubny-novotvar-kolorekta-c18-20/
Karcinom anu
Riziko análního karcinomu je zvýšené u pacientů s chronickou infekcí HPV (condaylomata accuminata) a AIDS. Základem léčby nemetastatického onemocnění je chemoradioterapie, v I. – III. stádiu 5-FU a mitomycin, ve IV. stádiu cis-platina + 5-FU nebo karboplatina + paklitaxel s hodnocením léčebné odpovědi na za 8–12 týdnů, definitivní výsledek léčby lze hodnotit po 6 měsících.
Problematika je velice složitá. Guidelines jsou dostupné zde: https://www.linkos.cz/lekar-a-multidisciplinarni-tym/personalizovana-onkologie/modra-kniha-cos/aktualni-vydani-modre-knihy/28-5-zhoubny-novotvar-riti-a-ritniho-kanalu-c21/