Zdroj informací: Rokyta R, Hutyra M, Jansa P. Doporučené postupy Evropské kardiologické společnosti (ESC) pro diagnostiku a léčbu akutní plicní embolie, verze 2019. Stručný přehled vypracovaný Českou kardiologickou společností. Cor Vasa 2020;62:154–182.
I. Úvod
Žilní tromboembolismus (VTE) je třetím nejčastějším akutním kardiovaskulárním onemocněním (po IM, CMP) s roční incidencí plicní embolie (PE) cca 1:1-2 tisíce a hluboké žilní trombózy (DVT) 1:700 – 2000. Její riziko roste s věkem (nejvíce > 80 let).
Patofyziologie plicní embolie – zvyšuje se afterload pravé komory, která následně dilatuje se vznikem trikuspidální regurgitace. Roste napětí stěny levé pravé komory se zvýšením jejich nároků na kyslík se vznikem hypoxického poškození pravé komory a poklesem její kontraktility. Následně klesá její tepový objem, který musí být kompenzován tachykardií. Pokud je plicní embolie závažná ani toto nestačí, klesá minutový srdeční výdej a následně i TK. To vede k poklesu průtoku v koronárních tepnách, prohloubení ischemie a uzavření bludného kruhu.
Definice hemodynamicky závažné PE – srdeční zástava nebo sTK < 90 mmHg nebo jeho pokles o 40 mmHg po dobu delší než 15 min (samozřejmě při vyloučení ostatních příčin) s nebo bez hypoperfúze ostatních orgánů.
II. Diagnostika
Ke klinickému podezření na PE vede přítomnost dušností, bolestí na hrudi, presynkopy/synkopy nebo hemoptýzy. Známkou těžké plicní embolie je hemodynamická nestabilita. EKG známky PE (inverze vln T ve svodech V1–V4, QR ve V1, S1Q3T3, RBBB) jsou přítomny u těžších forem PE, u méně závažných forem může být přítomna pouze sinusová tachykardie (i tato ale jen u 40 % pacientů s plicní embolií).

Stanovení předtestové pravděpodobnosti – k předtestové pravděpodobnosti se používá:
- Ženevské skóre – posuzuje tepovou frekvenci, hemoptýzu, VTE v anamnéze, otoku a bolestivosti DKK, anamnézu malignity a chirurgického zákroku a věk. Online lze stanovit zde: https://www.mdcalc.com/geneva-score-revised-pulmonary-embolism. Popř. shrnutí:
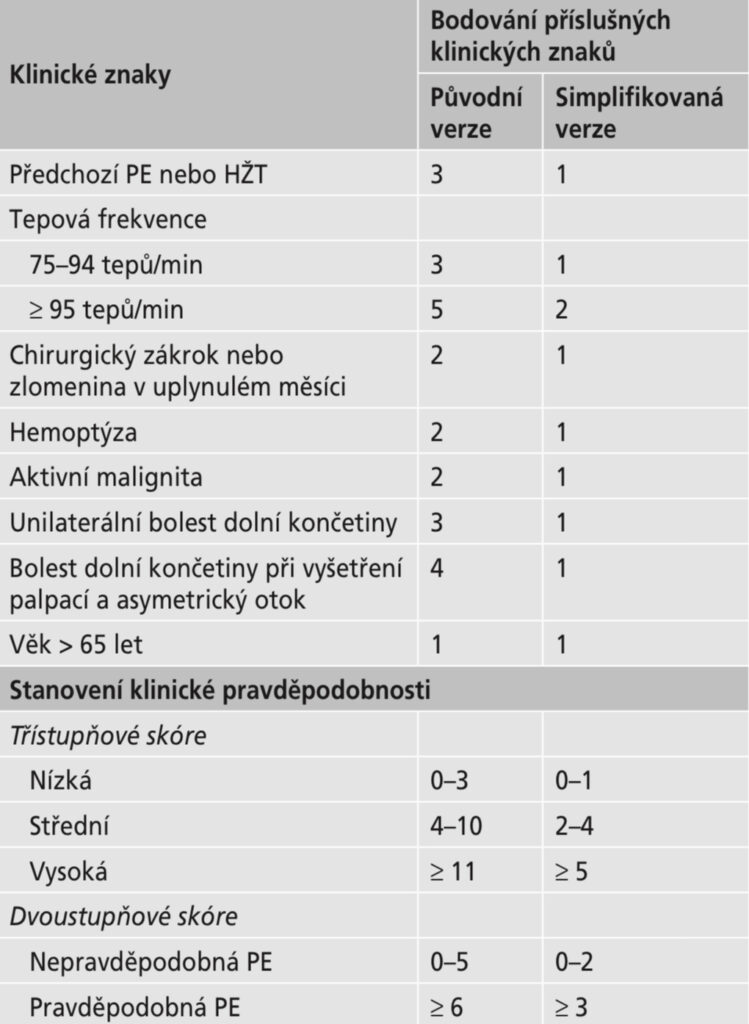
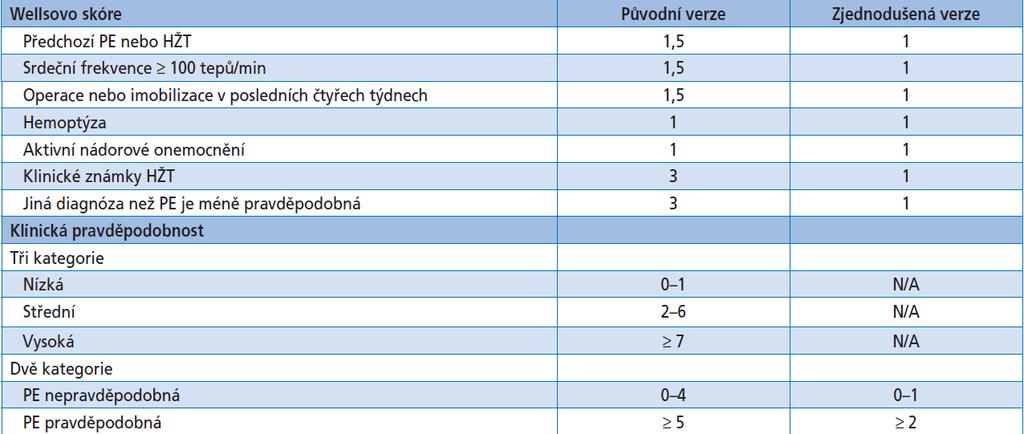
- Wellsovo skóre – posuzuje tepovou frekvenci, hemoptýzu, VTE v anamnéze, otoku a bolestivosti DKK, anamnézu malignity a chirurgického zákroku a přítomnost alternativní diagnózy. Online zde: https://www.mdcalc.com/wells-criteria-pulmonary-embolism
…Ženevská kritéria se od Wellsových obecně řečeno liší pouze body uvedenými kurzívou…
- PERC (pulmonary embolism rule-out criteria) – puls < 100/min, absence hemoptýzy, absence VTE v anamnéze, absence asymetrického otoku dolní končetiny, absence traumatu či chirurgického zákroku, věk < 50 let, SpO2 < 94 %, neužívání perorální hormonální antikoncepce + pokud mají nízkou klinickou pravděpodobnost dle Ženevských nebo Wellsových kritérií, lze považovat diagnózu plicní embolie za vyloučenou.
…obecně a jednoduše řečeno: pokud je pacient mladý, normotenzní, nemá tachykardii, má normální saturaci, je bez hemoptýzy, nemá anamnézu VTE, nemá otoky a bolestivost DKK, neužívá HAK, nemá anamnézu imobilizace, traumatu a chirurgického výkonu v posledním měsíci nebo malignity, lze u něj dle doporučených postupů PE vyloučit…přesto jsem se několikrát setkal s pacientem, který i při absenci všech těchto faktoru PE měl. Je nutné užívat selský a klinický rozum…
- D dimery – mají vysokou negativní prediktivní hodnotu trombembolie. Lze použít přizpůsobení D dimerů na věk: cut off = věk × 10 μg/l u pacientů > 50 let (což může pomoci u pacientů v této věkové skupině).
CT angiografie plicnice – je optimální metoda k průkazu PE. Při hodnocení by mělo být vždy pomýšleno na event. přítomnost chronické trombembolické plicní hypertenze CTEPH. MR angiografie plícnice se k diagnostice PE nedoporučuje.
Ventilačně perfúzní scintigrafie plic – také zavedený test, který má nižší radiační zátěž (vhodné spíše u jedinců s nižší pravděpodobností PE, u mladých pacientů, těhotných žen, alergiků na jodovou kontrastní látku a nefropatů).
Echokardiografie – senzitivita vyšetření je pouze 40 – 50 % (k vyloučení PE se nedoporučuje). Mezi typické známky patří:
- dilatace pravé komory
- znak 60/60 – ACT < 60 ms/gradient trikuspidální regurgitace > 60 mmHg (u 12 % pacientů)
- McConnelovo znamení – snížená kontraktilita volné stěny pravé komory v porovnání s hrotem (u 20 % pacientů)
- snížení vlny s‘ < 9,5 cm/s v TDI zobrazení pohybu trikuspidálního anulu

- dále D shape mezikomorového septa, snížení TAPSE, rozšíření dolní duté žíly
- přítomnost mobilních trombů v pravostranných srdečních oddílech v podstatě potvrzuje diagnózu PE
Provedení echokardiografického vyšetření není nezbytně nutnou součástí diagnostického postupu při podezření na plicní embolii u hemodynamicky stabilních pacientů, má ale význam při diferenciální diagnostice akutní dušnosti. Naopak, u hemodynamicky nestabilních pacientů normální echokardiografický obraz prakticky vylučuje PE jako příčinu nestability. Při současné hypertrofii volné stěny levé komory a vysokém gradientu při trikuspidální regurgitaci je nutné zároveň vyloučit CTEPH.

Ultrazvuk žil – ve většině případů je zdrojem PE DVT dolní končetiny. Nález proximální DVT má vysokou pozitivní prediktivní hodnotu pro PE (lze ji považovat za potvrzenou při nálezu proximální trombózy u pacienta s klinickými známkami PE).
Problémem jsou drobné subsegmentální defekty perfúze na CTAg. Dle současných guidelines je u nich přípustné požadovat další potvrzení diagnózy PE (vyvarování se zbytečné antikoagulační terapie). Diagnózu PE lze považovat za vyloučenou, pokud je nález na V/P scintigrafii plic negativní.
III. Stanovení závažnosti plicní embolie
Obecně lze říct, že tachykardie, hypotenze, respirační insuficience (tachypnoe a/nebo nízká SaO2) a synkopa jsou spojeny s nepříznivou krátkodobou prognózou akutní PE. Dále jsou nepříznivé hladina laktátu > 2,0 mmol/l, vyšší hladina NTproBNP a troponinu.
Ke stanovení 30 denní mortality bylo vyvinut index závažnosti PE (PESI) nebo jeho simplifikovaná varianta (sPESI). Dostupné online: https://www.mdcalc.com/pulmonary-embolism-severity-index-pesi nebo zde:

Všechny tyto údaje je nakonec doporučeno použít zejména k identifikaci jedinců s vysokým rizikem. Stanovení rizika tedy probíhá následně:
- nízké riziko – jsou hemodynamicky stabilní, patří do třídy PESI I – II, není přítomna dysfunkce PK a hodnoty troponinů jsou nízké.
- nižší střední riziko – jsou hemodynamicky stabilní, ale patří do třídy PESI III – V a není přítomna dysfunkce PK ani zvýšené hodnoty troponinů nebo pouze jedna z těchto dvou hodnot je pozitivní (-/- nebo +/-).
- vyšší střední riziko– jsou hemodynamicky stabilní, patří do třídy PESI III – V, a je přítomna dysfunkce PK i vysoké hodnoty troponinů.
- vysoké riziko – pacienti jsou hemodynamicky nestabilní, patří do třídy PESI III – V, a je přítomna dysfunkce PK i vysoké hodnoty troponinů.
Pokud je pacient hemodynamicky nestabilní je základem transthorakální echokardiografie (TTE), pokud je přítomno přetížení pravostranných oddílů a není k dispozici CT, je možné okamžité zahájení léčby (pokud je k dispozici CT, je možné diagnózu PE ověřit).
U pacientů s vysokou klinickou pravděpodobností PE je doporučeno se nezdržovat stanovováním hladiny D dimerů a rovnou indikovat CT Ag plicnice.
CAVE Dle doporučených postupů se CT Ag plicnice diagnostické, pokud se prokáže plicní embolie alespoň na segmentální úrovni.
IV. Terapie
Obecné zásady:
- oxygenoterapie je indikována při hypoxémii (zvýšení poměru V/P) při SpO2 < 90 %. CAVE Pokud je použita umělá plicní ventilace dochází dochází ke zhoršení plnění pravé komory s dalším snížením srdečního výdeje (je tedy vhodné nastavení co nejnižšího PEEP a dechových objemů, cca 6 ml/kg).
- farmakoterapie akutního selhání pravé komory srdeční
- tekutiny – hodnocení šířky dolní duté žíly (VCI) pomocí echokardiografie může pomoci v rozhodnutí o indikaci tekutin. Pokud je i přes plicní embolii normální nebo dokonce snížená šířka VCI, lze velmi opatrně podat cca 500 ml krystaloidů. Je ale třeba počítat s rizikem další distenze pravé komory a zhoršení hemodynamiky.
- Inotropní podpora – noradrenalin by měl být omezen pro pacienty v kardiogenním šoku. Dobutamin může být zvážen u pacientů s nízkým srdečním výdejem a normálním TK.
- Mechanická podpora oběhu a oxygenace – většinou venoarteriální ECMO, může být užitečné u pacientů s vysoce rizikovou PE a hemodynamickým zhroucením nebo srdeční zástavou. Bývá ale zatíženo celou řadou komplikací a lze o ní uvažovat pouze v centrech, které mají s touto metodou bohaté zkušenosti.
- Kardiopulmonální resuscitace – při zástavě oběhu s nedefibrilovatelným rytmem je metodou volby časná trombolýza. Pokud je podána, měla by kardiopulmonální resuscitace pokračovat alespoň 60–90 minut.
1. Úvodní antikoagulační léčba – antikoagulační léčba by měla být při střední nebo vysoké pravděpodobnosti zahájena již při čekání na výsledek vyšetření. Lze použít:
- LMWH, fondaparinux s.c. – preferenčně u lehkých a středně závažných PE.
- NOAC preferenčně upředňostnovaný před warfarinem (VKA). Při použití VKA je cílové INR 2,5 – 3. NOAC jsou KI v těhotenství, kojení a u antifosfolipidového syndromu.
- nefrakcionovaný heparin jako bolus 80 mg/kg i.v. – v případě těžké plicní embolie s následnou pravděpodobnou trombolýzou, nebo u závažného postižení ledvin CKD IV – V.
2. Trombolytická léčba – taková na pouze při PE s vysokým rizikem. Největší přínos trombolýzy je při použití do dvou dnů od začátků symptomů. Je přítomno cca 10 % riziko závažného krvácení (1,7 % nitrolebního krvácení). Nejčastěji se používá rekombinantní tkáňový aktivátor plazminogenu (rtPA), ve dvou schématech:
- 100 mg během 2 hodin – standardní
- 0,6 mg/kg během 15 min (maximální dávka 50 mg) – při extrémní hemodynamické nestabilitě, např. při srdeční zástavě
Absolutní kontraindikace trombolýzy:
- CNS
- hemoragická CMP kdykoliv v anamnéze
- ischemická CMP v posledních 6 měsících
- tumor CNS
- trauma/operace hlavy v posledních třech týdnech
- hemoragická diatéza nebo aktivní krvácení
Relativní kontraindikace trombolýzy – TIA v posledních 6 měsících, perorální antikoagulační léčba, těhotenství nebo první týden po porodu, nestlačitelná místa vpichu, traumatická resuscitace, sTK > 180 mm Hg, pokročilé jaterní onemocnění, infekční endokarditida, aktivní peptický vřed).
3. Perkutánní mechanická trombektomie – intervenční léčba pomocí mechanické fragmentace trombu, aspirační trombektomie nebo častěji farmakomechanické postupy (fragmentace trombu + redukované dávka trombolytika). Není dostatek studií přímo srovnávajících mechanickou trombektomii se systémovou trombolýzou.
4. Chirurgická embolektomie – vhodná u vysoce rizikové PE (lze zkombinovat ECMO s chirurgickou embolektomií).
5. Kavální filtry – vhodné u pacientů s akutní PE a absolutní kontraindikací antikoagulace.
V. Jak tedy postupovat…?
- Pokud je přítomna vysoce riziková plicní embolie (s hypotenzí, popř. hemodynamickou nestabilitou) je indikováno podání nefrakcionovaného heparinu (UHF) v dávce 80 IU/kg, poté natočení EKG, echo na přetížení pravé komory, v případě potřeby inotropika UPV apod.
- Pokud se pacienta podaří stabilizovat doplníme CT Ag plicnice, pokud ne, na nic nečekáme a indikujeme ECMO. Pokud je pacient hemodynamicky nestabilní a na echu je jasné přetížení PK nelze považovat za chybu zahájení trombolýzy bez výsledku CT Ag. K diagnostice může pomoci i přítomnost proximální žilní trombózy dolních končetin. Po hemodynamické stabilizaci je možné pacienta převést na perorální léčbu (u rizikových pacientů je vhodné s převedením počkat 3 dny).
- Pokud je trombolýza kontraindikována a pacient je nestabilní je nutné zavedení ECMO a popř. doplnění chirurgické/katetrové trombektomie.
- Pokud je pacient hemodynamicky stabilní, je vhodné zvážit V/P scintigrafii místo CT Ag plicnice (zejména u mladších pacientů a žen, u nichž by CTPA mohlo zvýšit celoživotní riziko vzniku karcinomu prsu).
- Pokud je pacient hemodynamicky stabilní zahajujeme parenterální nebo perorální antikoagulační léčbu a klasicky stratifikujeme pacienta dle rizika, v případě středního a vysokého rizika pacienta samozřejmě hospitalizujeme. Pokud je nízké riziko, je přítomno dobré rodinné i sociální zázemí a snadno dostupná lékařská péče, lze pacienta časně propustit. K tomuto zvážení lze použít i on-line kalkulaci Hestia kritérií: https://www.mdcalc.com/hestia-criteria-outpatient-pulmonary-embolism-treatment. Toto je ale vždy důležité dobře zvážit a porovnat s např. kritérii PESI a závěry zobrazovacích metod (…např. nebudeme pouštět domů pacienta se sice lehkou PE, ale rozsáhlou proximální DVT).
- U pacienta ve vyšším středním riziku je nejméně několik dnů vhodná observace za hospitalizace k časnému zachycení hemodynamické destabilizace. V tomto případě je nutné zvážit trombolýzu a akutní postupy (viz výše). Tyto rizikové pacienty je vhodné ponechat tři dny na LMWH a převést na NOAC (při kontraindikaci na VKA) až pří perzistenci hemodynamické stability.
- Pokud je antikoagulace zcela kontraindikovaná, je indikována implantace kaválního filtru.
VI. Délka antikoagulační terapie
Cílem antikoagulační léčby u pacientů s PE je zabránit recidivy TEN v dlouhodobém horizontu (v případě PE asociované s přechodnými rizikovými faktory je po vysazení antikoagulace riziko recidivy TEN přibližně 2,5 % za rok).
Riziko krvácení je nejvyšší v prvním měsící antikoagulace (…pravděpodobně se projeví co je skryto nebo jsme přehlédli…). Mezi rizikové faktory patří věk > 75 let, předchozí anémie nebo krvácení, aktivní nádor, CMP v anamnéze, hepatopatie/nefropatie, souběžné užívání antiagregace nebo NSAID, nedostatečná kontrola antikoagulace (zejména INR u VKA). Antikoagulace dle délky:
- 3 měsíce – nezbytné minimum. Po této době je vhodné ukončit u pacientů, kteří měli v anamnéze závažnou okolnost predisponující ke vzniku PE (…samozřejmě u těchto pacientů o této tendenci víme a při jejím příštím objevení, např. fraktura s imobilizací, chirurgický výkon, si u nich dáme hodně záležet na profylaxi VTE). Tyto faktory viz výše.
- dlouhodobá antikoagulace
- při recidivě PE (pokud tato recidiva nebyla vyvolána opět velkým a přechodným rizikovým faktorem (např. opětovná PE při opětovné zlomenině DKK s imobilizací).
- při první PE
- v případě vrozeného trombofilního stavu (deficit antitrombinu, proteinu C nebo S, homozygot faktoru V Leiden nebo homozygot genu pro protrombin G20210A) je indikována trvalá antikoagulace i při první manifestace PE. Toto hematologické došetření je vhodné zejména u jedinců < 50 let a při pozitivní rodinné anamnéze trombembolie. Trvalá antikoagulace není indikována heterozygotů Leyden a genu pro protrombin G20210A.
- pokud nebyl přítomen rizikový vyvolávající faktor nebo tento faktor byl malý a nevýznamný (…zde je nutné zdůraznit důležitost kvalitně odebrané anamnézy…), nebo naopak vyvolávající faktor perzistuje (např. pacient má aktivní nádor).
- pokud není přítomen nádor a je rozhodnuto o prodloužené antikoagulaci, měl by po 6 měsících proběhnout switch na redukovanou dávku NOAC (apixaban 2x 2,5 mg / rivoraxaban 10 mg denně)
- pokud pacient netoleruje nebo odmítá jakoukoliv formu antikoagulace lze zvážit použití ASA nebo sulodexidu.
- v případě závažné renální insuficience nebo antifosfolipidového syndromu jsou NOAC kontraindikovány.
- pokud je antikoagulace zcela kontraindikovaná, je indikována implantace kaválního filtru.
VII. Antikoagulační léčba u jedinců s aktivním nádorem
LMWH jsou základem léčby u pacientů s nádory GIT a při významnné chronické renální insuficienci. Ve všech ostatních případech lze se stejným rizikem použít NOAC (edoxaban, rivaroxaban). Antikoagulace je samozřejmě indikována tak dlouho, dokud perzistuje aktivní malignita.
VIII. Plicní embolie v graviditě
Akutní PE je jednou z hlavních příčin mateřské mortality. Statisticky je u cca 5 % pacientek, u kterých je PE vylučována nakonec tato diagnóza potvrzena. Určitou překážkou v diagnostice je fakt, že D dimery během těhotenství rostou a u cca 25 % ve třetím trimestru přesahují 0,5 mg/l. Algoritmus:
- Pokud jsou D dimery negativní, je situace jednoduchá a plicní embolii lze vyloučit.
- Pokud jsou pozitivní nebo je přítomna vysoká předtestová pravděpodobnost je indikována antikoagulační terapie LMWH i bez defintiivního potvrzení diagnózy a doplní se RTG S+P a při příznacích DVT i duplexní sono žil dolních končetin.
- Pokud je přítomna proximální DVT je indikováno pokračování v LMWH a rozvaha co dál dle „multidisciplinárního týmu“.
- Pokud proximální DVT přítomna není:
- Při normálním RTG S+P indikován V/P scintigrafie plic (dávka pro plod cca 0,2 mGy).
- Pokud je abnormální RTG S+P je indikováno CT Ag plicnice (dávka pro plod cca 0,3 mGy, ale pro prsa matky cca 6 mGy).
- Dle výsledku pokračování v LMWH nebo jeho přerušení při vyloučení PE.
- Antikoagulace má pokračovat alespoň šest týdnů po porodu v celkové délce nejméně tři měsíce. LMWH a war- farin lze podávat během laktace, podání NOAC při laktaci není doporučeno.
Lékem volby v těhotenství jsou LMWH, při alergii fondaparinux. Warfarin je spojen s poškozením plodu v prvním trimestru a fetálním krvácením a abrupcí placenty ve třetím trimestru. V léčbě vysoce rizikové PE je indikován nefrakcionovaný heparin a v případě potřeby i trombolýza nebo chirurgická embolektomie.
Epidurální punkce není doporučena, pokud neuplynulo alespoň 24 hodin od poslední terapeutické dávky LMWH a naopak, aplikace LMWH není doporučena dříve než 4 h po odstranění epidurální katétru.
Na embolii plodovou vodou by mělo být pomýšleno v těhotenství nebo
v poporodním období při nevysvětlitelné srdeční zástavě, hypotenzi, dušnosti a hypoxemii, zejména je-li současně přítomna diseminovaná intravaskulární koagulace.
IX. Chronické důsledky plicní embolie
I. Funkční limitace po PE – cca 20 – 75 % pacientů referuje po 6 měsících od PE perzistenci zhoršeného stavu ve srovnání se stavem před PE. Ve většině případů ale nejde o hemodynamické důsledky PE.
II. Chronická tromboembolická plicní hypertenze (CTEPH) – vzniká do dvou let po PE u 0,1 – 9,1 % pacientů a je způsobena perzistující obstrukcí plicnice, která vede k redistribuci perfuze a k sekundární periferní cévní remodelaci. Úvodem jsou projevy CTEPH nespecifické, v pokročilých stádiích jsou přítomny známky pokročilého pravostranného srdečního selhání. Je definována jako zvýšení středního tlaku v plicnici ≥ 25 mm Hg, při normálním tlaku v zaklínění (≤ 15 mm Hg) a při přítomnosti primárně perfuzních defektů na V/Q scintigrafii po alespoň tříměsíční účinné antikoagulaci. Metodou volby je V/P scintigrafie, (V/P SPECT se zdá méně senzitivní, ale stále vyhovující). Samotná CT Ag plicnice by se jako samotná metoda k vyloučení CTEPH používat neměla (nedokáže postihnout malé cévy). U operabilních pacientů je léčbou volby plicní endarterektomie s nutností následné dlouhodobé observace, u inoperabilních pacientů balonková plicní angioplastika. Vždy je indikována doživotní léčba warfarinem (pro NOAC zatím nejsou k dispozici data). Z farmakoterapie je u inoperabilních pacientů dostupný riociguat (stimulátor solubilní guanylátcyklázy).
X. Follow-up po plicní embolii
Stav pacienta po plicní embolii je doporučené zhodnotit po 3 – 6 měsících:
- Ptáme se na dušnost nebo funkční limitaci.
- Pokud je přítomna musíme indikujeme echokardiografické vyšetření. k vyloučení CTEPH. Při vysoké pravděpodobnosti CTEPH nebo zvýšení NTproBNP indikujeme rovnou V/P scintigrafii plic.
- Pokud prokážeme CTEPH, odešleme pacienta do centra pro plicní hypertenzi. Pokud je přítomno zvýšené riziko vzniku CTEPH (např. recidivující PE, rozsáhlý nález na CT Ag plicnice), dispenzarizace by měla pokračovat.
Zjednodušeně: dušnost/funkční limitace…echo/NTproBNP…V/P scinti plic…specializované centrum.