Vitamíny a stopové prvky
Vitamíny rozpustné ve vodě
Vitamín B1 (thiamin) – význam v energetickém metabolismu (účastní se dekarboxylace α-ketokyselin) a periferním nervovém přenosu. Obsažen v masu, luštěninách, celozrnném pečivu, ořeších a kvasnicích. DDD 1,1 mg/den.
Deficit (alkoholici, nádorové onemocnění, potrava s nízkým obsahem thiaminu v rozvojových zemích – pouze rýže v jídelníčku):
- lehký deficit – anorexie, úbytek hmotnosti, svalová slabost, poruchy intelektu.
- těžký deficit – beri-beri
- vlhká forma – srdeční selhání s otoky.
- suchá forma – periferní senzomotorická polyneuropatie s výraznou hyporeflexií.
- Wernickeho encefalopatie – u alkoholiků (oftalmoplegie, horizontální nystagmus, ataxie, porucha mentálních funkcí).
Vitamín B2 (riboflavin) – hlavní funkce je v oxidativním metabolismu (součást flavinmono- a flavindinukleotidu). Obsažen v mléčných výrobcích. DDD 1,3 mg/den.
Deficit je dán nedostatečným příjmem v potravě. Projevuje se kožními změnami (angulární stomatitida, seboroická dermatitida) a anémií.
Vitamín B3 (niacin) – hlavní funkce je v oxidativním metabolismu (prekurzor nikotinamidnukleotidu a nikotinamiddinukleotidu). Obsažen v mléčných výrobcích, luštěninách a vejcích. DDD je 16 mg/den
Deficit – pellagra – vzácné, u alkoholiků, karcinoidu, vrozené poruchy absorbce tryptofanu. Projevuje se „3D“ – dermatitida, diarhea, demence.
Vitamín B6 (pyridoxin) – hlavní funkce je v metabolismu aminokyselin, funkci enzymů a účastní se syntézy hemu. Je obsažen ve všech typech potravy. DDD je 1,3 – 1,7 mg/den. Deficit se projevuje kožními změnami (dermatitida, cheilitida), neurologickými problémy (neuropatie, bolest, zmatenost) a mikrocytární hypochromní anémií.
Vitamín B12 (kobalamin) – po navázání na vnitřní faktor v žaludku dochází k absorpci v terminálním ileu. Obsažen je v potravinách živočišného původu. DDD je 2,4 μg/den. Deficit se projevuje megaloblastovou anémií.
Kyselina listová – hlavní funkce je v metabolismu aminokyselin a nukleových kyselin, účastní se reakce s přenosem methylových skupin. DDD je 400 μg/den. Deficit se projevuje megaloblastovou anémií a hyperhomocysteinémií.
Biotin – je kofaktorem enzymů karboxyláz. DDD je 30 μg/den. Deficit může být u pacientů s krátkým střevem na parenterální výživě bez biotinu, projevuje konjunktivitidou, dermatitidou, alopecií, paresteziemi, depresemi, nauzeou a zvracením.
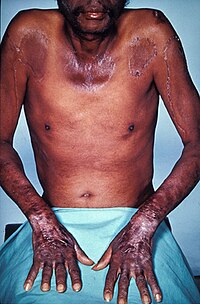
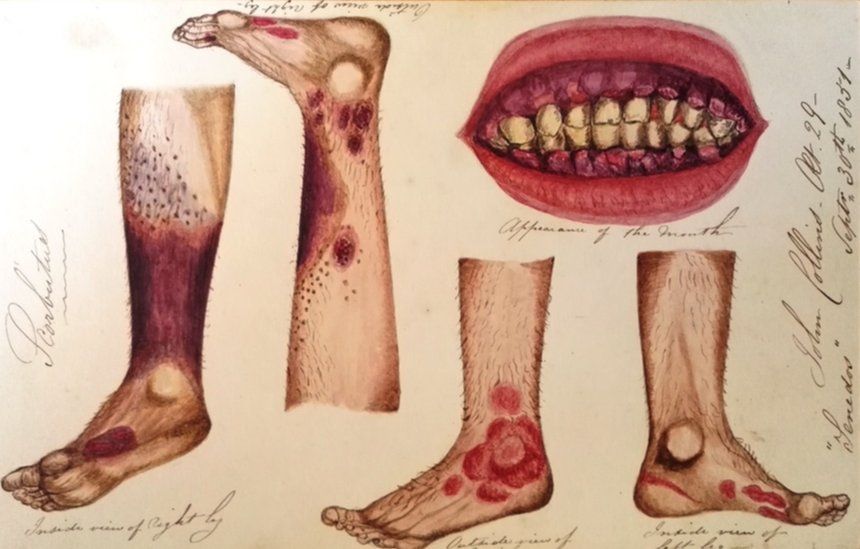
Vitamín C (kyselina askorbová) – je důležitým antioxidantem a donorem redukčních ekvivalentů, kofaktor syntézy kolagenu a karnitinu, zvyšuje resorpci železa, blokuje tvorbu karcinogenních nitrosaminů a podporuje imunitní procesy. DDD je 90 mg/den. Bohatým zdrojem vitamínu C je šípek rakytník, citrusy, brambory, rajčata, jahody kiwi apod. Lehký deficit se projevuje únavou a depresemi, při těžkém deficitu vznikají kurděje se vznikem petechií a sufuzí a krvácivosti dásní.
Vitamíny rozpustné v tucích
Vitamín A (retinol) – do skupiny vitamínů patří retinol, retinaldehyd (nezbytný pro normální vidění), kyselina retinová (regulátor pro řadu genů, nezbytná pro buněčný růst). Největší obsah je v játrech, rybím masu, dalším zdrojem jsou provitamíny retinoidy (β-karoten), které se metabolizují na vitamín A. DDD je 1 mg/den.
Deficit – lehký deficit se projevuje xeroftalmem a noční slepotou, těžký deficit poškozením rohovky a slepotou, při dlouhém trvání i jaterní cirhózou s portální hypertenzí.
Předávkování – Maximální povolená denní dávka je 3 mg/den, nebezpečným zdrojem předávkování mohou být masti s retinoidy (na psoriázu apod.), velmi vysoké množství vitamínu A obsahují i játra polárních zvířat. Vitamín A je teratogenní, těhotné ženy by proto v průběhu prvního trimestru těhotenství neměly konzumovat játra (nejbohatší zdroj vitaminu A), jinak je zvýšené riziko vývojových vad a spontánních potratů.
- akutní hypervitaminóza se projevuje intrakraniální hypertenzí (zvracení, spavost, vyklenutí velké fontanely) a/nebo obrazem jako při intrakraniálním tumoru (edém papily, obrny hlavových nervů). Nejčastějším zdrojem intoxikace jsou potravinové doplňky a konzumace játer ledního medvěda nebo žraloka). Zejména děti jsou citlivé k předávkování a dojde k němu při požití jednorázové dávky > 5 mg/kg.
- chronická hypervitaminóza vzniká při příjmu vitamínu A > 30 mg/den po dobu 6 měsíců. Vzniká nechuť k jídlu, nauzea, zvracení, hubnutí, průjmy, alopecie, krvácení, fragilita kostí, hepatotoxicita (hepatomegalie a další příznaky poruchy jater).
Vitamín D3 (cholekalciferol) – je hlavní formou vitamínu D u člověka. Je syntetizován v kůži za účasti UV záření, biologickou aktivitu získává až po hydroxylaci v játrech a ledvinách (regulováno parathormonem). Reguluje koncentraci kalcia v plazmě ovlivněním jeho resorpce v tenkém střevě a exkrece ledvinami. DDD je 5 μg/den. Deficit se projevuje křivicí u dětí a osteomalácií u dospělých.
Vitamín E (α-tokoferol) – nespecifický antioxidant, který brání lipoperoxidaci polynenasycených mastných kyselin. Je obsažen hlavně v rostlinných tucích. DDD je 10 mg/den. Deficit vzniká vzácně u pacientů s malabsorpcí, projevuje se oftalmoplegií, polyneuropatií, ataxií, hemolytickou anémií, myopatií a poruchami fertility.
Vitamín K – 2 formy – vitamín K1 (fytochinon) z rostlinné stravy, vitamín K2 (metachinon) produkován bakteriemi v tlustém střevě. Jsou zásadní ve funkci koagulačních faktorů a dále proteinů pojiva (umožňuje posttranslační karboxylaci kyseliny glutamové. DDD je 150 μg/den,. Vyskytuje se zejména v listové zelenině. Jeho deficit vzniká při malabsorpci a při léčbě širokospektrými antibiotiky a projevuje se zvýšením krvácivosti (↑ INR).
Stopové prvky
Zinek – nutný pro funkci cca 100 enzymů (syntéza bílkovin, RNA, DNA, vazba transkripčních faktorů na DNA), normální spermatogenezi a vývoj plodu. DDD je 9 mg/den. Je obsažen nejvíce v mase, luštěninách, ořeších. Deficitem jsou ohroženi nejvíce diabetici, alkoholici, cirhotici a pacienti s nespecifickými střevními záněty, malabsorpčními syndromy a rozsáhlými popáleninami. Projevuje se dermatitidou v obličeji a na flexorových stranách končetin, alopecií, špatným hojením ran a zhoršením imunity, opožděným růstem, nástupem puberty u dětí, snížením vnímání chuti a a průjmy.

Měď – součástí metaloenzymů, jejichž reakce katalyzuje (cytochromoxidáza, ceruloplasmin, superoxiddismutáza apod.). DDD 1 mg/den. Je přítomna v játrech, luštěninách, ořeších, ovesných vločkách, čokoládě, kakau, čaji, kokosu a mořských rybách. Deficit je vzácně pozorován u pacientů na dlouhodobé parenterální výživě a projevuje se anémií, neutropenií a poruchami pojiva.
Železo – transportuje kyslík hemoglobinem, nezbytné pro funkci myoglobinu ve svalech (deficit viz anémie).
Selen – součástí selenoproteinů (glutathionperoxidáza, tyronindejodáza). DDD je 50 μg/den. Je obsažen v mořských živočiších, masu, obilovinách (záleží na obsahu selenu v půdě). Deficit je poměrně častý a projevuje se kardiomyopatií (Keshanská nemoc) a kosterní myopatií. Součástí patofyziologie Keshanské nemoci je pravděpodobně současná infekce mutovaným kmenem coxsackievirů. Současný výskyt deficience jódu a selenu vede k výrazné únavě a oba deficity se vzájemně potencují.


Malnutrice
Definice – stav, kdy deficit energie a nutrientů (cukry tuky, bílkoviny, vitamíny, stopové prvky) má měřitelné vedlejší účinky. Selektivní deficit se označuje jako karence. V nejvyšším riziku jsou pacienti s akutní komplikací chronického onemocnění, upoutaní na lůžko a kriticky nemocní.
Epidemiologie – podvýživa je přítomna u 30 – 60 % hospitalizovaných (v závislosti na oddělení) a u 30 % se vyvine až v nemocnici. Ambulantně nejčastěji u onkologických pacientů a při některých chorobách GIT.
Klasifikace
- Marasmus je nedostatek energie s postupným symetrickým váhovým úbytkem. Vyskytuje se při prostém hladovění u jinak zdravých jedinců, kdy v potravě není výrazný deficit proteinů. Normálně živený člověk dokáže ze svých zásob vyžít cca 2 měsíce.
- Kwashiorkor je závažnější forma způsobená rychlým odbouráváním bílkovin, tedy zejména svalové hmoty se vznikem hypoproteinémie a otoků. Za tento typ je odpovědná především systémová zánětlivá odpověď s vyplavením prozánětlivých cytokinů.
CAVE Podle vzhledu nelze usuzovat na nepřítomnost kwashiorkorové malnutrice.
Patofyziologie – adaptace organismu na hladovění:
- První 3 dny – spotřebovává se svalový a jaterní glykogen a zvyšuje se hladina stresových hormonů (glukagon, katecholaminy, kortizol), což vede ke stimulaci lipolýzy a proteolýzy a vzniklý glycerol a aminokyseliny se se užijí při glukoneogenezi.
- Po 3 dnech – klesá tělesná aktivita a energetický výdej, snižuje se dejodace T4 na T3 i hladina zmíněných stresových hormonů. Postupně se zvyšuje lipolýza a z mastných kyselin vznikají ketogenenzí ketony, které jsou alternativním energetickým substrátem ve snaze ochránit proteiny před katabolismem.
- CAVE V případě stresu a zánětlivé odpovědi dochází naopak k rychlé mobilizaci zásob, zvýšení klidového energetického výdeje s cílem za každou cenu udržet funkční organismus…přístup „buď anebo“) s velmi rychlou degradací svalové hmoty (až 0,5 kg denně).
Klinický obraz – nejzávažnějšími důsledky malnutrice je úbytek svalů (zejména dýchacích a kosterních) s rizikem hypoventilace a hypomobility, deficit svalových bílkovin s poklesem onkotického tlaku a pohotovostí ke vzniku otoků, celková orgánová dysfunkce, imunosuprese s rizikem infekčních komplikací a porucha hojení ran.
Diagnostika
- Nutriční screening – součást prvního kontaktu s pacientem formou dotazníku:

- Objektivní hodnocení stavu výživy
- Antropometrické parametry:
- BMI < 16
- úbytek hmotnosti > 5 % za měsíc, > 10 % za půl roku
- kožní řasa nad tricepsem muž < 3,5 mm, žena < 7 mm
- obvod paže muž < 19,5 cm, žena < 15,5 cm
- Laboratorní parametry
- albumin < 30 g/l
- prealbumin < 0,2 g/l
- transferin < 2 g/l
- cholinesteráza < 90 μkat/l (odráží pokles sekrece jater)
- lymfocyty < 1,5 ∙ 109/l
- Pomocné parametry – KO, metabolismus železa, B12, kyselina listová, kreatinin, dynamika minerálů, pokles T3.
Prevence a léčba – zásadní je na malnutrici pomyslet a předcházet ji. Důležitý je dostatečný příjem živin včetně její podpory, aktivní rehabilitace a snaha o co nejdřívější vyléčení pacienta.
Odhad základních složek výživy
Energie – hrubý odhad 25 – 30 kcal/kg nebo:
- REE (resting energy expenditure) v kcal pro muže = 900 + (10 x hmotnost v kg), pro ženy 700 + (7 x hmotnost v kg).
- Poté je REE vynásobeno koeficientem v závislosti na:
- denní aktivitě – 1,2 u sedavého zaměstnání, 1,8 pro velmi aktivní jedince, při rehabilitaci 1,1 – 1,3.
- tělesné teplotě – 1,1 za každý stupeň Celsia nad 37 při horečce.
- stresu – 1,25 za abdominální operace, 1,5 těžká sepse, 2,0 popáleniny
- alkohol má energetickou hodnotu 7 kcal/g.
Proteiny – při neadekvátním příjmu energie lze vyrábět energii z proteinů (vstupují do glukoneogenezy). Doporučený příjem je 1 – 1,2 g/kg/den (pooperačně až 1,5 g/kg/den, při sepsi až 2 g/kg/den) a krytí energetické potřeby z 10 – 15 %. Z 1 gramu proteinů lze získat 4 kcal energie. Aminokyseliny by měly být podávány pomalu (max. utilizační schopnost je 0,1 g/kg/h, tedy cca 7 g/hodinu, tedy 10 % roztok aminokyselin lze podávat maximálně rychlostí 70 ml/h).
Přesnou potřebu bílkovin lze stanovit pomocí dusíkové bilance, kdy lze pozorovat rozdíl příjmu bílkovin a aminokyselin a výdeje katabolického dusíku N (hlavně urey). Pro něj lze použit vzorec:
N (gramy) = odpad urey v moči za 24 hodin x objem moči za 24 hodin x 0,0336 + extrarenální ztráty stolicí a kůží (obvykle cca 1,5 g, při průjmu až 4 g).
Obvykle je N cca 10 – 12 g/den, při těžké, katabolismu desítky gramů denně. 1 gram dusíku = 6,25 g bílkovin = 25 gramů svalové hmoty.
Biologická hodnota bílkovin je nejvyšší u živočišných proteinů, poté u luštěnin, cereálií (rýže, pšenice, kukuřice) a kořenová zelenina. Potřeba proteinů vzrůstá během růstu, těhotenství, kojení a rekonvalescence, naopak je potřeba být velice opatrný u renální (riziko urémie) a jaterní (riziko encefalopatie) insuficience.
Tuky – nejefektivnější zdroj energie (z 1 gramu tuků lze získat 9 kcal energie). Krytí energetické potřeby z tuků by nemělo přesáhnout 30 % (z toho trans a nasycené < 25 %, polynenasycené < 15 %, mononenasycené zbytek, cca 60 %). Jsou zásadním zdrojem energie v umělé výživě. Maximální denní dávka by měla být 50 – 100 g. Tuky by měly být podávány pomalu (max. utilizační schopnost je 0,1 g/kg/h, tedy cca 7 g/hodinu, tedy 20 % emulzi tuků lze podávat maximálně rychlostí 35 ml/h). Výhodou je, že při jejich utilizaci nevzniká velké množství CO2.
Významným je poměr polynenasycených mastných kyselin. Omega-6 agregabilitu tromobocytů zvyšují, omega-3 ji snižují a působí protizánětlivě, antiarytmicky a vazodilatačně v plicním řečišti. Ideální poměr omega-3 : omega 6 = 1 :3.
Tukové emulze pro parenterální výživu jsou izoosmolární a lze je podávat do periferní žíly. Vždy jenpři jejich použití je vhodné sledovat hladinu triacylglycerolů v séru.
Sacharidy – krytí energetické potřeby ze sacharidů by mělo být 40 – 60 %, cca 200 – 300 g/den. Z 1 gramu sacharidů lze získat 4 kcal energie. Pokud je nedostatek sacharidů, tělo umí přeměňovat proteiny (ze 100 g proteinů lze vyprodukovat 56 g sacharidů). Glukóza by měla být podávána pomalu (max. utilizační schopnost jater je 0,2 – 0,5 g/kg/h, tedy 15 – 35 g/hodinu, tedy 10 % G lze podávat rychlostí max. 150 – 350 ml/h). Při zvýšeném příjmu glukózy dochází ke zvýšení produkce CO2 a zejména při respirační insuficienci k hyperkapnii.
Voda – lidské tělo je složeno z 50 % vody u žen a 60 % u mužů. Ta je rozdělena do několika kompartmentů:
- Intracelulární tekutina (ICT, 55 – 75 % celkové vody)
- Extracelulární tekutina (ECT, 25 – 45 % celkové vody), ta je rozdělena na intravaskulární (IVT) a intersticiální (IST) vodu v poměru 1:3. Oba tyto kompartmenty jsou odděleny kapilární stěnou a pohyb vody mezi nimi je řízen Starlingovými silami (hydrostatický a onkotický tlak).
Průměrný normální příjem tekutin je 30 – 40 ml/kg hmotnosti. Bilance tekutin cca:
- příjem 2100 ml potravou, 200 ml voda produkovaná metabolismem.
- výdej tekutiny má více složek – 1400 ml moč, 700 ml perspiratio insensibilis (neměřitelné ztráty) plícemi (350 ml) a kůží (350 ml), perspiratio sensibilis potem (100 ml), stolicí (100 ml). Horečka zvyšuje ztráty tekutin o cca 200 ml na stupeň Celsia. Během kojení je potřeba navýšit příjem tekutin o cca 1000 ml.
Mikroživiny – viz výše. Při podávání v parenterální výživě je jejich ideální množství premixovánou v samostatném preparátu (pro stopové prvky Addamel, Tracutil, pro vitamíny Cernevit).
Nutriční podpora
Nutriční podpora je indikována v případě rizika nebo vzniku malnutrice (mimo terminální stavy) a měla by být zahájena nejpozději do 3 dnů od vzniku stavu, při kterém je zvýšené riziko jejího vzniku. Zásadou je, že vždy, když je to možné, je upřednostňována enterální výživa před parenterální.
Pokud je plně funkční GIT a pacient přijímá ústy je k běžné stravě možné podávat fortifikovanou stravu (obohacená o určitou živinu), pokud to nestačí, tak sipping. Pokud pacient nezvládá perorální příjem a lze předpokládat, že toto omezení bude pouze krátkodobé, je vhodné zavést nazogastrickou/nazojejunální sondu, v případě dlouhodobého omezení gastro/jejunostomii a podávat enterální umělou výživu. K této výživě je samozřejmě možné podávat doplňkovou parenterální výživu. Pokud je GIT nefunkční, je indikována kompletní parenterální výživa.
CAVE Při zahájení nutriční podpory v době rekonvalescence dochází k tvorbě nových makroergních fosfátových vazeb a přesunu kalia do buněk. Pokud nedochází k těsné monitoraci iontů a jejich substituci, může vzniknout těžká hypofosfatémie a hypokalémie které mohou být fatální. Stav se označuje jako refeeding syndrom.
Enterální výživa
Podávání výživových roztoků do GIT, většinou 50 – 60 % energie je ze sacharidů, 30 – 40 % z lipidů, zbytek proteiny, po naředění pokrývají i denní potřebu tekutin. Lze rozdělit na dva základní typy:
- polymerní – je využitelná ve všech běžných případech. Obsahuje proteiny (nejčastěji kasein), polysacharidy a tuky (nejčastěji triglyceridy s dlouhým řetězcem). Je určena k podání do žaludku pomocí NGS/PEG. Pokud není kontraindikace, měla by obsahovat vlákninu.
- oligomerní – ve speciálních případech (průjem/zácpa, pankreatická insuficience, malabsorpce), kdy polymerní výživa není tolerována. Často používány i u syndromu krátkého střeva a akutní pankreatitidy. Živiny jsou již rozštěpené a nízkomolekulární, nevyžadují tedy přítomnost trávících enzymů.
Mezi absolutní KI patří náhlá příhoda břišní, krvácení do GIT, mechanický ileus, šok, těžká hypoxie. Při akutní pankreatitidě je nutné enterální výživu podávat do jejuna.
Výživu lze podávat formou:
- popíjení (sipping) – doplňková výživa k běžné dietě. Je vhodné popíjet 2 – 3x denně mezi jednotlivými jídly. K dispozici jsou preparáty pro diabetiky, bez tuku i s vlákninou (nejčastěji 1,5 kcal/ml, ale rozmezí až 0,7 – 3,2 kcal/ml).. K dispozici je řada chutí a je vhodné respektovat pacientovy preference.
- sondové výživy – sondou zavedenou přes nos do žaludku nebo za první kličku duodena (NGS – nazogastrická/nazojejunální). Nazojejunální je vhodná při akutní pankreatitidě nebo při riziku aspirace. Do žaludku lze podávat pouze polymerní, do jejuna je vhodná oligomerní výživa. Při nutnosti enterální výživy > 6 týdnů, je vhodné zavedení perkutánní endoskopická gastrostomie (PEG) popř. se zavedením až do jejuna (J-PEG). Nejčastěji izokalorické (1 kcal/ml s celkovou dávkou cca 2000 ml/den).
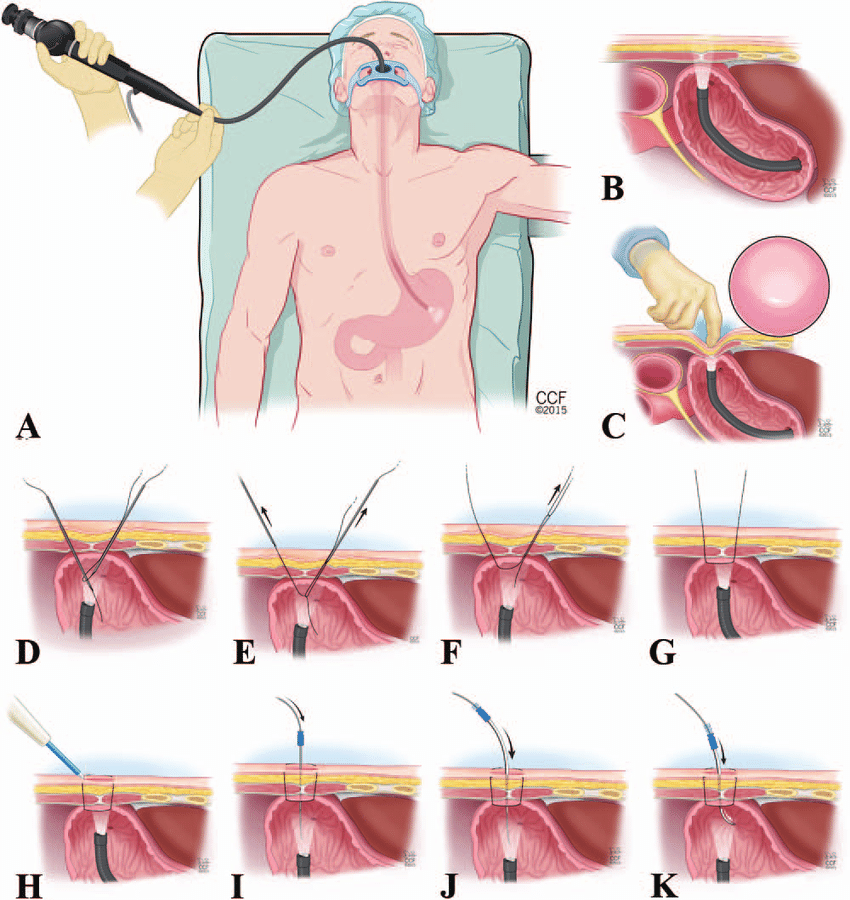
Podávání enterální výživy – výživu do sondy lze podávat dvěma způsoby:
- bolusově – zahajuje se 4 – 6x denně 50 ml a zvyšuje se o 50 – 100 ml/bolus na cílových 250 – 400 ml/bolus.
- kontinuálně – dávka se zvyšuje od 20 ml/h o cca 20 ml/h na konečných 100 – 150 ml/h. V noci je vhodné aplikaci na cca 6 hodin zastavit (simulace metabolického klidu, dle některých zdrojů zabránění bakteriálního přerůstání).
Před každou další aplikací je vždy vhodné vyloučit reziduum.
Komplikace:
- intolerance výživy – nauzea, zvracení, GERD, dyspepsie apod.
- metabolické komplikace – poruchy hydratace, iontové poruchy, overfeeding/refeeding syndrom.
- komplikace související se vstupy – infekce, poranění, krvácení, dekubitus, zavedení NGS do dýchacích cest apod.
Parenterální výživa
Definice – při parenterální výživě se podávají živiny přímo do krevního řečiště. Jde o nefyziologický způsob výživy a měl by být volen, až v případě selhání nebo kontraindikace enterální výživy. Nejčastěji se používá all-in-one systém formou firemně připravených vaků (dvoukomorové – sacharidy a proteiny, tříkomorové – sacharidy, proteiny a tuky). Při potřebě je možné připravit magistraliter vaky ušité přímo na míru.
Indikace – nemožnost přijímat enterální výživu, choroba střeva nebo nedostatečná resorpce (syndrom krátkého střeva, ileus, střevní píštěl, stav po střevních operacích, akutní pankreatitida, nespecifické střevní záněty, postradiační enterokolitida, kritický stav doprovázený ileem).
Technika podávání
- periferní parenterální výživa – výhodou je, že ji není potřeba podávat do centrální žíly, na druhou stranu maximální možná osmolalita je 900 mmol/l, je zde proto méně živin, a proto ji lze užít pouze doplňkově a po poměrně krátkou dobu (max. 10 dnů).
- centrální parenterální výživa – je sice nutnost kanylace centrální žíly, ale poté je sem možné podávat i roztoky, které parenterálně pokryjí všechny nutriční nároky a mají tak i osmolalitu až 1200 mmol/l. Dle doby podávání je vhodné zvolit i adekvátní žilní přístup:
- krátkodobá výživa – centrální žíla (v. subclavia, v. jugularis interna).
- střednědobá výživa – PICC (periphery inserted central catheter).
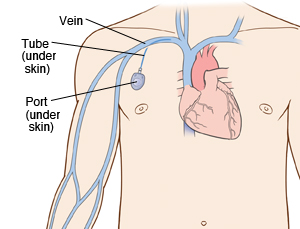
- dlouhodobá výživa – venózní port (centrální žilní katetr, který končí komůrkou zašitou pod kůži, do které se zavádí transdermálně jehla) nebo tunelizovaný katetr (jeho část je vedena dlouhým podkožním tunelem).
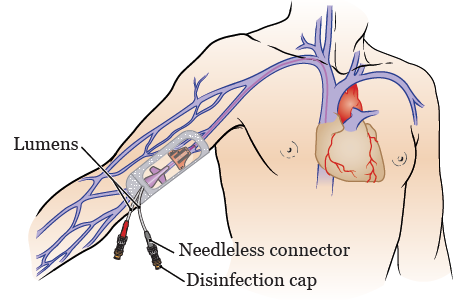
![PDF] Ultrasound assessment of thrombotic complications in pediatric patients with tunneled central venous catheters | Semantic Scholar](https://d3i71xaburhd42.cloudfront.net/46dd5d0e567beee25afdb0eacf5fec185dd23cdf/3-Figure1-1.png)
U kriticky nemocných je vhodné podávání non-stop, u stabilních hospitalizovaných nemocných je vhodné respektovat noční metabolický klid, při domácí aplikaci je naopak vhodné noční podávání, protože denní činnost pacienta je tak méně narušena.
Mezi komplikace patří problémy při zavádění centrálního katetru, související s přítomností katetru a metabolické komplikace:
- minerálové dysbalance
- přetížení glukózou a následná hypertriglyceridémie
- zvýšené příjem bílkovin vede k urémii (téměř výhradně u renálního selhání)
- fat overload syndrome – bývá pozorován při překročení dávky 2 g tuku/kg/den. Projevuje se pancytopenií s poklesem protrombinu a krvácením, hepatosplenomegalií se zvýšením jaterních testů a dechovou tísní. Příznaky mizí po přerušení podávání tukové emulze.
- koloidní syndrom – příliš rychlou infuzí tukové emulze. Projevuje se bolestí hlavy, zrudnutím, třesem, zvýšenou teplotou a bolestmi na prsou. Po přerušení infúze příznaky vymizí.
Péče o vnitřní prostředí
U některých pacientů (zejména geriatrických) je snadné dosáhnout dobré nutrice, ale jsou chronicky dehydratovaní (z důvodu sníženého pocitu žíně a nízkého perorálního příjmu, zvýšených ztrát při horečkách, průjmech, zvracení a polyurie nebo nemožnosti perorálního příjmu např. při nevolnosti). Řešením je parenterální infuzní terapie. Zásady:
- 1. Vysoký příjem krystaloidů – 500 ml 0,9 % NaCl obsahuje 4,5 g soli, při podávání 2000 ml fyziologického roztoku tedy pacient dostane 18 g soli s rizikem oběhového přetížení. Řešením je podání 500 – 1000 ml fyziologického roztoku a zbytku ve formě 5 % glukózy (podání samotné vody by vedlo k osmotické hemolýze).
- 2. Podání 10 % glukózy nelze považovat za energeticky dostačující. Pokud je pacient malnutrický, vždy by se měla podat i umělá výživa.
- 3. Není vhodné podávat paušálně inzulín do glukózy nu nediabetiků. Je ale racionální počítat s faktem, že u pacienta s premorbidně přítomnou inzulinovou rezistencí se tato při chorobě (zánětlivá reakce apod.) dále zvyšuje a po podání nevykryté glukózy dojde ke zvýšení glykémie do diabetických hodnot. Záleží proto na konkrétním pacientovi a u každého pacienta je při podání glukózy nutné sledování glykémií. Podobně není vhodné došetřovat přítomnost diabetu při akutním onemocnění.
- 4. Je nutné respektovat maximální rychlost podání draslíku (max. 20 mmol/h), řídit se kalémií a předvídat (pacient v rekonvalescenci, při užívání diuretik, při podávání glukózy bývají potřebné dávky draslíku vysoké).
- 5. Monitorace ostatních iontů:
- při těžké pankreatitidě bývá hyperkalcémie.
- při renální insuficienci hyperfosfatémie.
- při rekonvalescenci a zahájení nutriční podpory v rámci refeeding syndromu hypokalémie, hypofosfatémie, hypomagnezémie.
Infúze se podávají nejčastěji do periferní žíly, při jejich nedostupnosti a zejména u terminálních pacientů lze roztoky podávat i subkutánně do oblastí břicha nebo stehna.
Dietní systém
Obvyklý je následující systém (každá nemocnice může mít své vlastní specifika):
- Dieta NPO (N) – Nic Per Os (Nic) – nemocný bude o hladu.
- Dieta 0S – čajová – čaj neslazený nebo slazený; u nemocných s nemožností příjmu per os.
- Dieta 2 – šetřící; u nemocných s poruchami trávicího traktu, u nemocných ve stresových a zátěžových stavech, např. při akutním cévním onemocnění.
- Dieta 3 – základní, racionální strava; u dospělých pacientů a starších dětí, kteří nevyžadují dietní omezení.
- Dieta 4S – s vyloučením volného tuku; u nemocných s akutním zánětem slinivky břišní a záněty žlučníku v období převodu na příjem ústy.
- Dieta 4 – s omezením tuku; u chronických onemocnění jater, slinivky a žlučníku, obvykle po převodu z přísnější 4S.
- Dieta 5 – bezezbytková – při onemocnění dolní části GIT.
- Dieta 6 – nízkobílkovinná; u nemocných s chronickým selháváním ledvin.
- Dieta 8 – redukční; u nemocných s obezitou nevyžadujících šetřící úpravu diety, u nemocných s hyperlipoproteinemií, u obézních diabetiků 1. a 2. typu, obvykle obsahuje stále přes 5 000kJ na den a je tedy poměrně málo přísná.
- Dieta 9 – diabetická; u nemocných s DM 1. typu a u diabetiků 2. typu bez potřeby redukovat. Lze ještě specifikovat přísnost omezení sacharidů.
- Dieta 9S – diabetická šetřící; diabetická varianta šetřící diety.
- Dieta 10 – neslaná; obvykle již není součástí dietního systému, neboť všechny diety se primárně připravují bez příměsi soli a dle potřeby se dosolují.
- Dieta 11 – výživná; u nemocných s vyšší energetickou potřebou a snahou o vzestup hmotnosti.
- Dieta 12 – batolecí; u dětí od 1,5–3 let věku.
- Dieta 13 – dětská; u dětí od 3–15 let.
- Dieta BLP – bezlepková; u nemocných, kteří trpí nesnášenlivostí lepku (celiakie).
- Dieta dialyzační s nízkým obsahem fosforu; u nemocných léčených hemodialýzou nebo peritoneální dialýzou.