Fyziologie hemokoagulace
Trombocyty – bezjaderné a velmi malé buňky, které vznikají z megakaryocytů, mají životnost 7 – 10 dnů a zanikají ve slezině. Cca 1/3 trombocytů je alokováno ve slezině a tento poměr je tím vyšší, čím je slezina větší. Hlavním stimulátorem produkce je trombopoetin (TPO), dále je jejich uvolnění stimulováno zánětem (zejména IL-6). Trombocyty obsahují dva typy granul:
- alfa granula – obsahují zejména koagulační faktory a kofaktory (von Willebrandův faktor, destičkový faktor 4, PDGF, fibrinogen, faktor V).
- denzní granula – obsahují zejména aktivátory trombocytů (ADP, Ca2+, serotonin).
- lysozomy
Koagulace krve je určena k udržení integrity krevního oběhu a skládá se ze tří fází:
1. Reflexní, později humorální stimulací vazokonstrikce.
2. Aktivaci a adheze destiček – při poškození cévní stěny vnějšími (např. traumatem) nebo vnitřními faktory (např. zánět) dochází k odkrytí její subendoteliální vrstvy, která obsahuje kolagen a von Willebrandův faktor (vWF, který se mimo subendoteliální prostor nachází i v plazmě) a adhezi krevních destiček. Tyto destičky se poté aktivují a agregují faktory humorálními (epinefrin, trombin), destičkovými (ADP, tromboxan TxA2, serotonin) a cévními (vWF, kolagen). Během této aktivace jsou v místě poškození endotelu vázány další trombocyty a tvoří destičkový trombus. Každý trombocyt je pokrytý cca 50 tisíci GpIIb/IIIa receptory pro fibrinogen a vWf, které zprostředkují zpevnění trombu fibrinovými vlákny, dále obsahuje GpIb/IX pro samotný vWF.
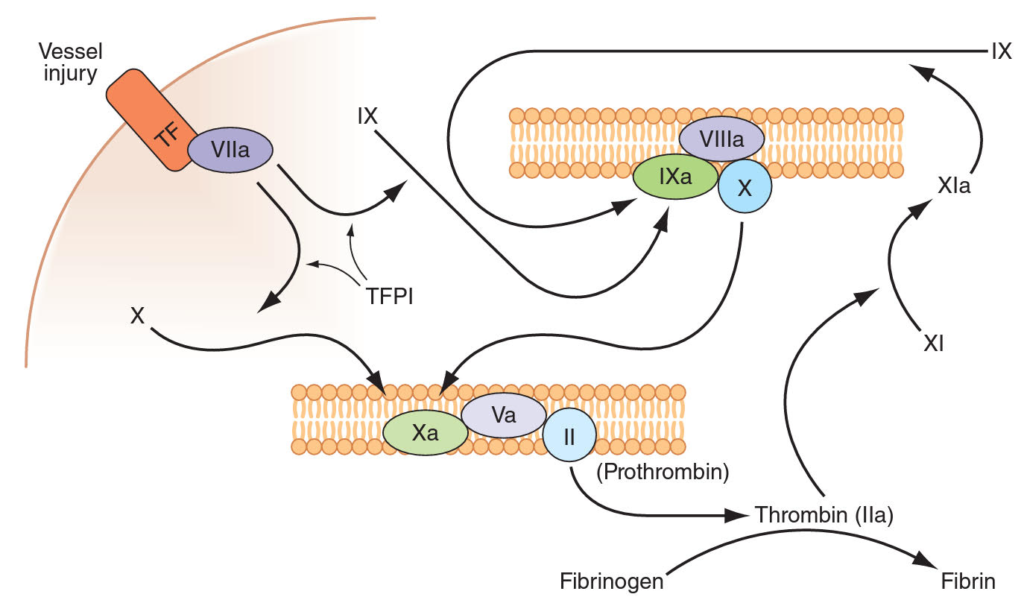
3. Koagulační kaskáda – koagulační faktory normálně cirkulují v inaktivní podobě, po jejich aktivaci dochází ke spuštění kaskády, která vrcholí vznikem vláken fibrinu. Lze říci, že vlastní koagulační kaskádou je vnější koagulační cesta, která je kriticky závislá na amplifikaci vnitřní koagulační cestou. Samotná vnitřní cesta není výrazně účinná, ale hraje významnou roli zejména při kontaktu s nebiologickými povrchy např. při mimotělním oběhu.
Iniciačním signálem vnější cesty je poškození cévní stěny s obnažením tkáňového faktoru (glykoprotein CD142 nacházející se subendotelilálně), který aktivuje faktor VII na VIIa a ten aktivuje faktor X na Xa dvěma způsoby:
- přímo aktivací na faktor Xa.
- nepřímo aktivací faktoru IX na IXa, který spolu s faktorem VIIIa aktivují X na Xa. Celá tato nepřímá aktivace je amplifikována faktorem XIa, který je aktivován trombinem (vnitřní koagulační cesta).
Při zmíněném kontaktu krve s nebiologickými povrchy zejména negativně nabitými (např. plast nebo sklo) nebo poškozením endotelu a obnažením fosfolipidů se aktivuje vnitřní cesta, kdy se v přítomnosti vysokomolekulárního kininogenu (HMWK) prekalikrein aktivuje na kalikrein a v přítomnosti Ca2+ a fosfolipidů pak velmi rychle aktivuje faktor XII. Faktor XIIa pak aktivuje faktor XI na XIa (lze jej tedy aktivovat jak trombinem, tak faktorem XII). Faktor XIa aktivuje faktor IX na IXa a ten spolu s faktorem VIIIa aktivují faktor X na Xa. Vnitřní cesta tedy koagulaci jak amplifikuje, tak sama o sobě aktivuje koagulační kaskádu.
Vzniklý faktor Xa spolu se svým kofaktorem Va (je aktivován trombinem) aktivuje faktor II na IIa (trombin). Trombin je proteáza konvertující rozpustný fibrinogen na nerozpustný fibrin a dále aktivuje faktor XIII na XIIIa, který tvoří příčné můstky mezi jednotlivými fibrinovými vlákny a tak fibrinovou zátku dále stabilizuje.
Antitrombotické mechanismy – fyziologický endotel je za normálních okolností:
- antitrombotický, protože produkuje prostacyklin, NO, TF pathway inhibitor, trombomodulin (po vazbě trombinu aktivuje protein C a protein S spolu s deaktivací faktoru V a VIII), heparan sulfát a
- fibrinolytický, protože produkuje urokinazu, TPA (tissue plasminogen activator), ale na druhou stranu i PAI (plasminogen activator inhibitor) s prokoagulačním efektem.
Antitrombin – hlavní deaktivátor trombinu. Jeho aktivitu několik tisíckrát zesiluje přítomnost heparinu.
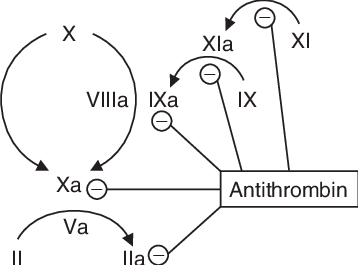
Protein C – plazmatický glykoprotein, který je aktivován trombinem a následně za pomocí svého kofaktoru proteinu S deaktivuje faktor V a VIII. Aktivace proteinu C se výrazně zesiluje vazbou trombinu na endoteliální glykoprotein trombomodulin.
TFPI (tissue factor pathway inhibitor) – deaktivuje úvodní krok vnější koagulační cesty (komplex TF-faktor VIIa).
Fibrinolytický systém – rozpouští již vzniklé tromby:
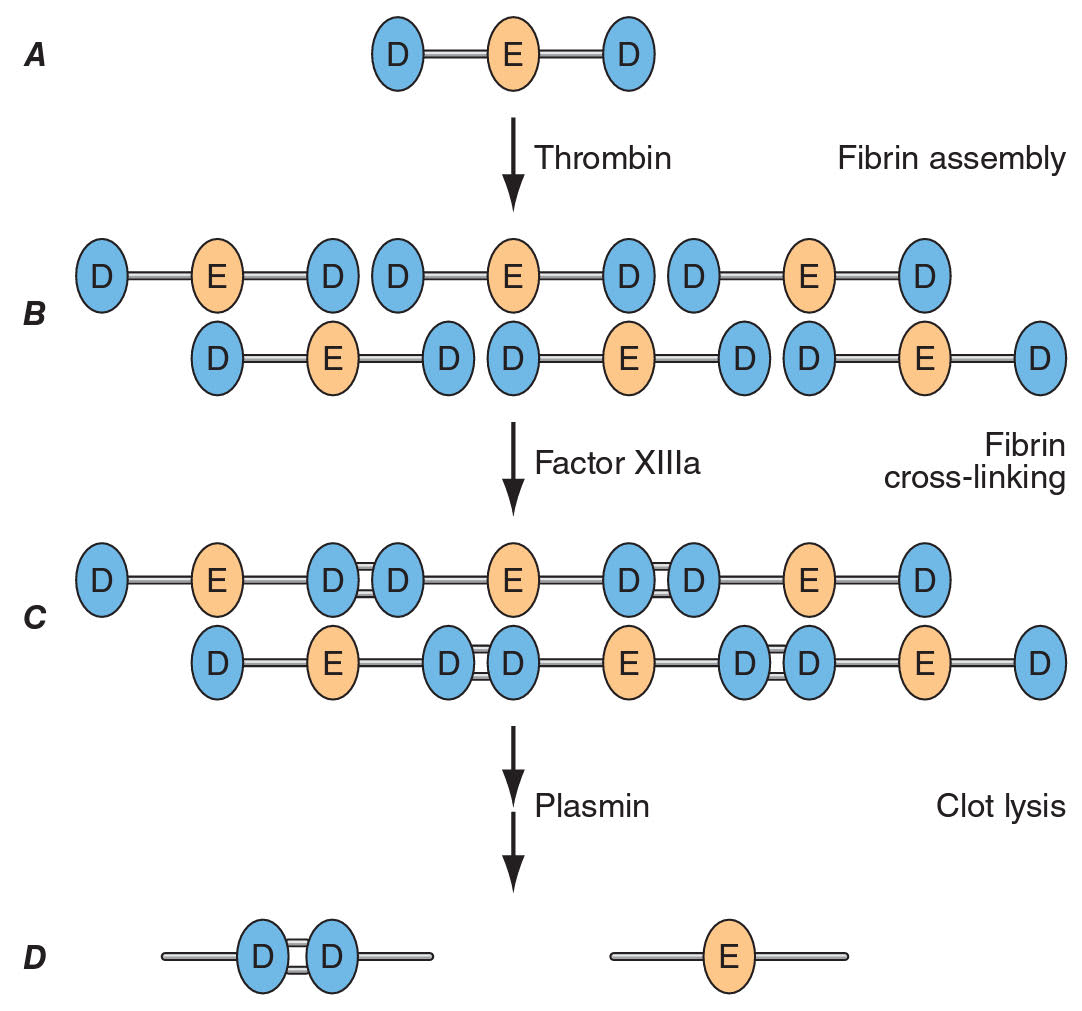
Plazmin – hlavní proteáza štěpící fibrin na degradační produkty. Aktivita plazminu je omezena výhradně na krevní sraženinu, protože jsou jednak vazebná místa specifická pro fibrin, jednak mimo trombus je plazmin inaktivován α2 antiplazminem. K aktivaci plazminogenu je potřeba rozštěpení proteázou tPA (tissue plasminogen activator) nebo uPA (urokinase plasminogen activator) za vzniku plazminu. Po štěpení fibrinu vznikají specifické degradační produkty, jejichž přítomnost je možné prokázat laboratorními
testy a jsou citlivým markerem přítomné trombózy.
Působením plazminu se fibrinogen a rozpustný fibrin rozpadají na vysokomolekulární fragmenty X a Y (přechodné meziprodukty) a nízkomolekulární fragmenty D a E (konečné produkty). Fibrin se štěpí déle než fibrinogen. Fragmenty X a Y brání polymeraci fibrinových monomerů i jejich vazbě na Gp IIb/IIIa a působí tak antikoagulačně. Odbourávání nízkomolekulárních fragmentů D a E zajišťuje
monocyto-makrofágový systém. Konečným specifickým produktem degradace fibrinu jsou fragmenty o molekulové hmotnosti 182 kDa, tzv. D-dimery, které se skládají ze dvou domén, které jsou odolné vůči štěpení plazminem. D-dimery jsou specifickou podmnožinou FDP, která se od ostatních FDP liší přítomností jedné vazby navíc (stabilizační vazby způsobené faktorem XIIIa) → D-dimery jsou uvolňovány pouze při rozpadu skutečných sraženin (nikoli při rozpadu fibrinogenu), zatímco FDP se vyskytují při jakékoli fibrinolytické příhodě a jejich zvýšená koncentrace může být pozorována u mnoha reaktivních
stavů včetně onemocnění jater, cirhózy, nádorů, těhotenské eklampsie a akutních trombotických příhod. D-dimery jsou tak specifičtějším markerem pro vyloučení trombotické příhody, plicní embolie nebo DIC.
K fyziologické regulaci fibrinolýzy dochází na třech úrovních:
- PAI (plasminogen activator inhibitor) – 3 podtypy, v krvi se nachází zejména PAI-I, který je také proteinem akutní fáze. Hlavním účinkem je inhibice tPA a uPA.
- TAFI (thrombin-activatable fibrinolysis inhibitor) – inhibuje fibrinolýzu odštěpením plazmin vázajících řetězců z fibrinu.
- α2 antiplazmin – inhibitor plazminu.
K posouzení, zda si pacient zasluhuje „pozornost“ hematologa lze použít dotazník International Society on Thrombosis and Haaemostasis Bleeding Assesment Tool, online: https://bleedingscore.certe.nl/).
Vyšetření koagulačních funkcí
Vyšetření destičkových funkcí
Krevní obraz – normální počet trombocytů je 150-450×109/l bez závislosti na věku a doba jejich života v cirkulaci 7-10 dní.
MPV (mean platelet volume) – normální objem destiček je 6–9 fl. Velké destičky nacházíme u některých trombocytopatií.
PFA-100 – analyzátor ke stanovení funkce tromboytů. Simuluje adhezi a agregaci trombocytů v případě poranění krevních vlásečnic. Původně byl navržen k diagnostice vWF choroby, lze použít i při podezření na Bernardův-Soulierův syndrom, Glanzmannova trombocytopatie, při urémii, nebo po užití kyselinyacetylsalicylové apod. Odráží schopnost testovaných trombocytů uzavřít otvor v membráně testovací cartridge. Tato membrána obsahuje kolagen v kombinaci s adenosindifosfátem, nebo epinefrinem. Všechny tyto látky jsou aktivátory trombocytů v organismu.
Doba krvácivosti podle Dukea – testuje schopnost tvorby trombocytové zátky. Provádí se vpich do ušního lalůčku. Krvácení by se mělo v normě zastavit do 2 – 4 minut.
Vyšetření koagulační kaskády
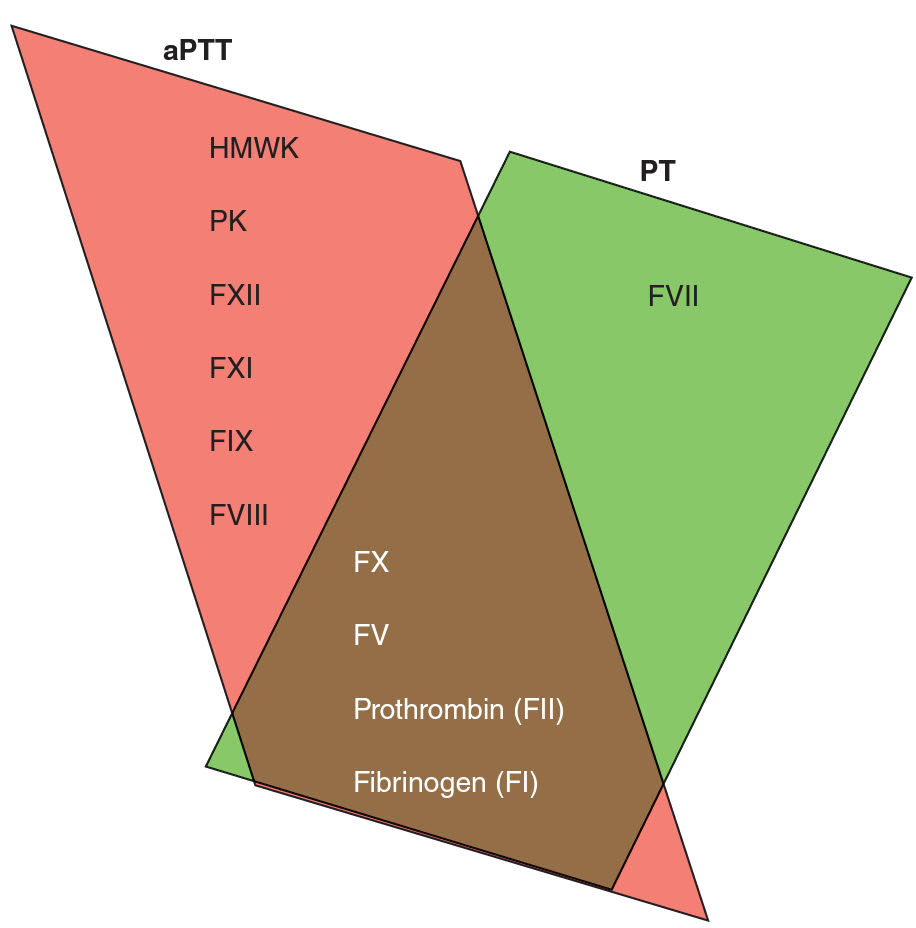
APTT (activated partial thromboplastin time – aktivovaný částečný tromboplastinový čas) je test vnitřní a společné koagulační cesty. Norma je 26 – 40 s. Hodnota je závislá především na počátečních dějích hemokoagulace ve vnitřní cestě (f. XII, XI, IX a VIII), protože tato část koagulace probíhá pomaleji, teprve v druhé řadě zachycuje účinnost faktorů společné cesty, X, V, II a I.
Při teplotě 37°C je do dekalcifikované plazmy přidán kaolin – kefalinový komplex (kaolin představuje záporně nabitý povrch, kefalin = fosfolipid z králičího mozku, kefalin funguje jako parciální tromboplastin který nemá nic společného s tkáňovým tromboplastinem! a nahrazuje destičkový fosfolipid, nutný k aktivaci faktoru X. Tímto způsobem se aktivuje vnitřní a poté společná cesta a měří se čas do vzniku fibrinové sraženiny.
PT (prothrombin time, protrombinový čas) – je test vnější a společné cesty. Měří čas vzniku koagula po přidání tkáňového tromboplastinu (faktor III) s následnou aktivací vnější cesty. Norma je 12 – 15 s. Měří se čas do vzniku prvního vlákna fibrinové sraženiny. Výsledky testu se uvádí obvykle indexem INR (international normalized ratio, mezinárodní normalizovaný poměr), tedy poměrem naměřeného času pacienta a normální hodnoty kontrolní plazmy.
Do dekalcifikované plazmy je přidán tkáňový tromboplastin spolu s přebytkem vápenatých iontů. Tímto způsobem se aktivuje vnější a poté společná cesta.Komerčně dodávané typy tkáňového tromboplastinu (tkáňového faktoru III) se mezi sebou liší. Proto se do rovnice pro výpočet INR přidává faktor účinnosti použitého tromboplastinu.
TT ( thrombin time, trombinový čas) – je přímé vyšetření konverze fibrinogenu na fibrin. Norma je 17 – 24 s. Do dekalcifikované plazmy je přidán trombin spolu s nadbytkem kalcia a měří se čas do vzniku fibrinové sraženiny.
Ostatní
Celkové degradační produkty fibrinu – zejména D-dimery jsou specifické pro stabilizovaný fibrin (norma pod 160 μg/l) a tak i přítomnost trombózy v těle.
Koncentrace fibrinogenu – norma je mezi 1,5–4,5 g/l. CAVE Jde o protein akutní fáze, který se zvyšuje u zánětu.
Antitrombin III – stanovení funkční aktivity v plazmě ve srovnání s kontrolní plazmou (norma je 70–100 %).
Euglobulinová metoda stanovení fibrinolytické aktivity – stanovuje aktivitu plazminu. Z plazmy se kyselinou octovou vysráží euglobulinová frakce (obsahující plazminogen), která se oddělí a opět vysráží. Přítomný plazmin se tedy zbaví α2-antiplazminu a lyzuje vzniklou sraženinu. Norma je 120–240 minut. Kratší časy signalizují zvýšenou aktivaci fibrinolytického systému.
ACT (aktivovaný koagulační čas) – krev odebraná bez antikoagulancia se umístí do zkumavky s kontaktním aktivátorem (kaolin) a v přístroji je při 37 °C míchána do odečtení času koagulace. Jde o rutinní metodu pro kontrolu heparinizace při mimotělním oběhu a hemodialýze. Norma je cca 150 s, při heparinizaci pro dlouhodobý mimotělní oběh nebo hemodialýzu 180−300 s, při mimotělní oběh v kardiochirurgii > 600 s.
Dále možné hladinu proteinu C a proteinu S, vyšetření APC rezistence (geneticky podmíněná rezistence faktoru V vůči aktivovanému proteinu C), vyšetření antifosfolipidových protilátek, vyšetření fibrinolytického systému s aktivátory plazminogenu (tPA, uPA, PAI-1), plazminogenu, aktivity jednotlivých faktorů koagulační a fibrinolytické kaskády apod.
– dg. např. hemofilie A, B, C.
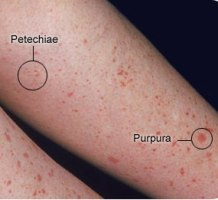
I. Trombocytopenie
Vznikají ze snížené produkce, zvýšené sekvestrace (zejména ve slezině) a zvýšené destrukce. U každého pacienta s trombocytopenií by měl být proveden nátěr periferní krve k vyloučení pseudotrombocytopenie. Nejcharakterističtějším rysem je krvácení do kůže a sliznic: petechie → purpura → hematomy. Klinické projevy vznikají až při počtu trombocytů cca < 30 x 109/l krve (krvácivost při vyšším počtu budí podezření na současnou trombocytopatii). Mezi další projevy patří epistaxe, krvácení z dásní, gynekologické krvácení, hematurie, enteroragie a nejvážnější krvácení do sítnice a CNS.


Základní algoritmus došetření trombocytopenie:
- Vyloučení pseudotrombocytopenie – při standardním odběru krve do EDTA dochází k vyvázání vápníku s následnou spontánní aglutinací trombocytů. K jejímu vyloučení je nutné zopakovat odběr do citrátu nebo heparinu.
- Odběr krevního obrazu analyzátorem – pokud je abnormální i počet erytrocytů nebo leukocytů, pak je potřeba došetřit kostní dřeň.
- Vyšetření periferního krevního obrazu manuálně – přítomny schistocyty, pak jde pravděpodobně u mikroangiopatickou hemolytickou anémii (DIC, TTP apod.).
- Pokud je vše negativní, došetřujeme specifickou příčinu:
1. Pseudotrombocytopenie – in vitro artefakt vznikající z aglutinace destiček díky poklesu Ca2+ při odběru do klasické EDTA zkumavky. Trombocyty jsou poté mylně automatickým analyzátorem vyhodnoceny jako snížené (shluk trombocytů je vyhodnocen jako jeden trombocyt). K odlišení od pravé trombocytopenie je nutné zopakovat odběr do zkumavky s citrátem nebo heparinem.
2. Trombocytopenie ze snížené tvorby destiček
- amegakaryocytární – kvantitativně nižší počet nebo chybění megakaryocytů. Primární jsou vzácnější, sekundární vznikají v důsledku expozice myelotoxickým látkám, ionizujícímu záření, dále virové infekce a infiltrace kostní dřeně malignitou.
- megakaryocytární – normální počet kvalitativně odlišných megakaryocytů. Patří sem trombocytopenie u megaloblastických anemií, paroxyzmální noční hemoglobinurie, myelodysplastického syndromu, Bernard – Soulierův syndrom apod.
Ke stanovení diagnózy je potřeba vyšetření kostní dřeně. Základem léčby sekundárních trombocytopenií je odstranění primární příčiny. U primárních pak imunosupresivní léčba nebo alogenní transplantace kostní dřeně. Při krvácení inhibitory fibrinolýzy (PAMBA), v extrémním případě převod trombocytů. Prognóza hluboké trombocytopenie je vážná s největším rizikem krvácení do CNS.
3. Infekcí indukovaná trombocytopenie
- nejčastější příčinou imunitní trombocytopenie u dětí je předchozí virová infekce a většinou odezní spontánně.
- HIV zejména v pozdějších stádiích.
- trombocytopenie spojená s DIC, zejména při G- infekcích.
4. Léky indukovaná trombocytopenie – téměř každý lék může indukovat trombocytopenii. Vzniká typicky po cca 21 dnech od nasazení nového léku a přetrvává ještě 7 – 10 dnů po jeho vysazení. Pomocí může být www stránka platelets: https://www.ouhsc.edu/platelets/WEB%20Table%20Lab%202018.pdf. Z nejběžnějších léků působí trombocytopenii:
- ATB – beta laktamy (ampicilin, penicilin, piperacilin, ceftriaxon), ciprofloxacin, trimetoprin – sulfametoxazol, vankomycin.
- antiarytmika – amiodaron, chinidin.
- analgetika – paracetamol, ibuprofen.
- ostatní kardiální léky – furosemid, amlodipin.
- fenytoin.
5. Heparinem indukovaná trombocytopenie (HIT) – oproti ostatním lékovým trombocytopeniím má dvě základní zvláštnosti (většinou nebývá těžká a pacienty obvykle neohrožuje krvácením, ale spíše vznikem trombózy). Vzniká u 0,1 – 7 % pacientů léčených heparinem (častěji při použití nefrakcionovaného heparinu, vzácně i u LMWH). Její patogeneze je komplexní. Typy:
- Typ I – důsledkem nespecifické schopnosti mukopolysacharidové molekuly heparinu aglutinovat destičky. Trombocytopenie je jen mírná (okolo 100), asymptomatická a většinou nevyžaduje přerušení léčby heparinem.
- Typ II – její příčinou je vznik protilátek proti komplexu destičkový faktor 4 (PF4)-heparin, který aktivuje jednak trombocyty, ale i endotelie a monocyty. Dochází k aglutinaci trombocytů a vzniku mikrotrombóz a ischemie. Vzniká obvykle po 5 – 14 dnech od zahájení léčby heparinem, < 5 dnů pokud byl pacient již dříve heparinem léčen (nejvíce to platí do 100 dnů) a protilátky jsou již preformované. K diagnostice lze využít:
- 4T (Trombocytopenie, Timing od zahájení léčby heparinem, Trombóza (např. kožní změny apod.) a nepřítomnost osTatních příčin trombocytopenie). Online kalkulátor zde: https://www.mdcalc.com/calc/1787/4ts-score-heparin-induced-thrombocytopenia
- detekce anti-heparin/PF4 protilátek. Senzitivita těchto protilátek je nízká, protože ne všichni , diagnóza přesto zůstává zejména klinická.
Základem léčby je včasné odhalení HIT a okamžité nahrazení heparinu (popř. LMWH) jiným antikoagulačním lékem (např. přímé inhibitory trombinu, fondaparinux). Ještě jednou CAVE LMWH jsou zcela nevhodné pro zkříženou reaktivitu. Vzhledem k tendenci ke vzniku trombóz je u každého pacienta s HIT indikováno nejméně ultrazvukové vyšetření žil dolních končetin. Riziko trombózy přetrvává zvýšené ještě jeden měsíc po vysazení heparinu.
6. Autoimunitní trombocytopenie
Definice – Porucha, která vzniká na základě přítomnosti autoprotilátek proti trombocytům, které jsou poté zvýšeně vychytávány buňkami monocyto-makrofágového systému RES (zejména slezině méně játrech). Je odlišná manifestace na základě věku:
- dětský věk – často prudký průběh většinou se spontánní úpravou. Nejčastěji navazuje na virovou infekci s prudkým poklesem trombocytů a rozvojem krvácivých příznaků.
- dospělý věk – častěji plíživý a protrahovaný průběh.
Klasifikace
- Primární – po vyloučení ostatních příčin.
- Sekundární – bývá součástí obrazu jiné choroby (např. SLE, HIV, CVID…).
Klinický obraz – běžné je kožní a slizniční krvácení (v ústech, GIT, silné menstruační krvácení). Purpura a krvavé puchýře mohou předznamenávat život závažné krvácení (do sítnice, CNS).
Diagnostika – diagnóza je většinou stanovena vyloučením jiných příčin trombocytopenie (per exclusionem) i pseudotrombocytopenie. Průkaz protilátek proti trombocytům není většinou průkazný pro nízkou senzitivitu i specificitu. Nejčastěji se projevuje izolovanou trombocytopenií s krvácivými příznaky. Základním vyšetřením v době diagnózy je:
- krevní skupina, krevní obraz a retikulocyty
- přímým antiglobulinový (Coombsův test) – vyloučení protilátek vázaných na erytrocyty
- základní biochemické a koagulační vyšetření
- serologické vyšetření na HBV, HCV, HIV
- hladina IgA, IgM a IgG
- neinvazivní stanovení infekce Helicobacter pylori (průkaz antigenu ve stolici nebo ureázový dechový test)
- těhotenský test u žen ve fertilním věku
- RTG S+P a sono břicha
- doplňkově ANA, ENA, revmatoidní faktor, antifosfolipidové protilátky (ACLA IgG a IgM, lupus antikoagulans, TSH, fT4, anti TGO, anti CMV/PCR CMV, PCR parvoviru B19. Dále je ke zvážení průtoková cytometrie k vyloučení počínající lymfoproliferace.
- antitrombocytární protilátky nejsou rutinně doporučeny vyšetřovat pro jejich nízkou senzitivitu i specificitu.
Terapie – vhodná při poklesu trombocytů < 20 – 30 x 109/l krve, v případě závažnějších krvácivých projevů i dříve:
- Léčbou první linie jsou kortikosteroidy (prednison, methylprednisolon, dexametazon), v případě nutnosti rychlejšího nástupu účinku IVIG, při závažném krvácení trombonáplavy.
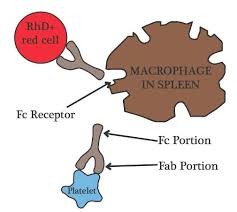
- U Rh pozitivních pacientů lze použít Rh0(D) imunoglobulin – makrofágy ve slezině jsou zahlceny Rh+erytrocyty označenými Rh0 protilátkami, k likvidaci trombocytů tedy již nejsou k dispozici. Cenou za tento účinek je přítomnost limitované hemolýzy.
- Při selhání jsou indikovány agonisté TPO receptoru (eltrombopag, romiplostin), popřípadě jiné např. imunosupresivní léky (mykofenolát mofetil).
- V případě selhání a při průkazu sleziny jako hlavního místa destrukce trombocytů je ke zvážení splenektomie jako poslední možnost (před ní je vhodné provedení vakcinace proti obaleným mikroorganismům (pneumokoky, meningokoky, hemofily).
7. Trombotické trombocytopenické mikroangiopatie
Skupina trombocytopenií, pro které je typická trombocytopenie, mikroangiopatická hemolytická anémie s přítomností schistocytů a laboratorní známky mikrovaskulární trombózy a hemolýzy.
Trombotická trombocytopenická purpura – poprvé byla popsána v roce 1924 Eli Moschcowitzem.
Patogeneze – von Willebrandův faktor (vWF) je obvykle produkován ve formě ultravelkých multimerů (ULMvWF), které jsou za normálních okolností štěpeny metaloproteinázou ADAMTS13. Podstatou choroby je vrozený nedostatek nebo přítomnost protilátek proti ADAMTS13 (vrozený nebo získaný, např. polékově tiklopidin, cyklosporin apod.). Perzistence ultravelkých multimerů vWF se pravděpodobně podílí na zvýšené adhezi a aktivaci trombocytů se vznikem mikrotrombů. Pro TTP je typický pokles aktivity ADAMTS13 pod 10 %.
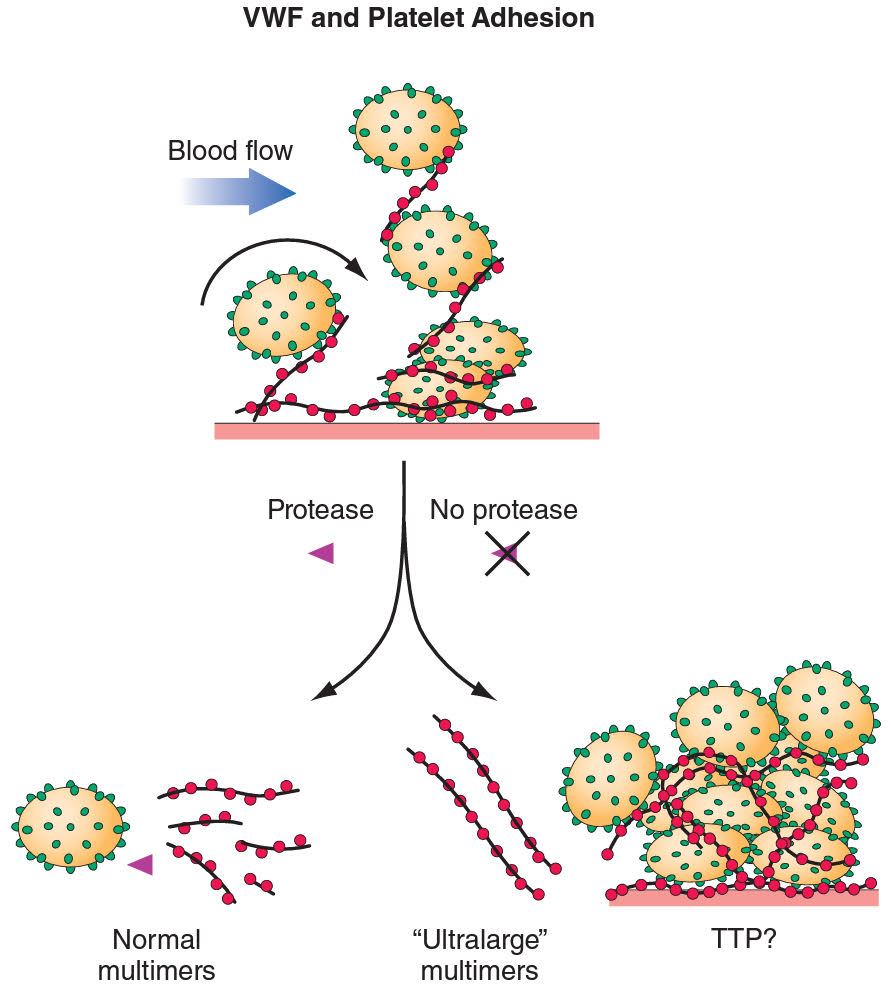
Epidemiologie – TTP vzniká častěji u žen, nezávisle na rase nebo geografické poloze. Častěji je přítomna u pacientů s HIV.
Klinický obraz – plně rozvinutá se TTP projevuje přítomností horečky, mikroangiopatické hemolytické anémie, trombocytopenie a postižením CNS a ledvin.
Diagnostika – zásadním je stanovení aktivity ADAMTS13 a protilátek proti této metaloproteináze. K odlišení od HUS je vhodné provedení kultivace E. coli O157:H7 a stanovení C3 a C4. Mezi další laboratorní nálezy patří přítomnost schistocytů v periferním náteru, zvýšení retikulocytů, LDH a nepřímého bilirubinu, pokles haptoglobinu a negativní nepřímý Coombsův test (nejsou volné protilátky proti erytrocytům). Histologicky lze prokázat mnohočetné hyalinní mikrotromby v arteriolách s nekrózou jejich stěn (hlavně CNS a ledviny).
Terapie – základem léčby je plazmaferéza podpořená kortikoterapií. V případě relapsů nebo selhání je vhodné přidat rituximab a ke snížení mortality i morbidity caplazimumab (Caplivi) při průkazu aktivity ADAMTS13 < 10 %. U sekundární příčiny je zásadní odstranit vyvolávající faktor (např. lék).
Hemolyticko-uremický syndrom – typické je trias: mikroangiopatická hemolytická anémie + akutní renální selhání + trombocytopenie. Lze rozlišit dvě formy:
- Epidemická forma – vázaná na enterohemoragickou infekci E. coli. Rezervoárem je zejména dobytek a člověk se nakazí nejčastěji konzumací nedostatečně upraveného masa, ale i nepasterizovaným mlékem a neupravenou vodou. Tvoří shiga-like toxin, nejčastějším sérovarem je O157:H7. Projevuje se křečovitými bolestmi břicha s vodnatými stolicemi a krví ve stolici. CAVE Léčba ATB zvyšuje riziko HUS.
- Sporadická forma – skupina vzácných chorob, postihujících zejména děti, projevujících se mikroangiopatickou hemolytickou anémií s přítomností fragmentovaných erytrocytů + akutním renálním selháním + trombocytopenií (většinou mírnou). Naproti tomu, typický HUS je způsoben infekcí kmenem Escherichia coli, který produkuje Shiga toxin. Příčina je genetická, byly prokázany mutace genů kódujících proteiny regulující komplement – faktor H (gen CFH), faktor I (gen CFI), faktor B (gen CFB), C3 složku komplementu, trombomodulin a CD46 (gen MCP). Vzhledem k fyziologickému nadbytku regulačních proteinů komplementu se jejich nedostatek projevuje pouze při nadměrné aktivaci komplementu (např. interkurentní infekce) a dochází k poškození endoteliálních buněk (zejména v ledvinách) a erytrocytů se vznikem hemolýzy. Následná ataka atypického HUS má 15 % mortalitu a 50 % nemocných progreduje do end-stage renálního selhání. Stav se často upravuje ad integrum, ovšem s velkým nebezpečím recidivy při objevení se dalšího triggeru aktivace komplementu. Choroba má vážnou prognózu. Základem léčby jsou plazmaferézy, které doplňují chybějící regulační protein. Ke zlepšení stavu vede eculizumab, anti-C5 protilátka inhibující komplement. Otázkou zatím zůstává, jak dlouho eculizumab podávat a jak výrazně ovlivňuje prognózu transplantace jater a ledvin u vybraných pacientů.
8. Zvýšená sekvestrace trombocytů – vzniká zvýšením zadržovaného poolu destiček při splenomegalii (zejména při portální hypertenzi). Nejsou krvácivé projevy, nevyžaduje léčbu.
II. Trombocytopatie
1. Vrozené
Bernardův-Soulierův syndrom – porucha adheze trombocytů způsobená vrozenými odchylkami povrchové membrány (defekt glykoproteinového komplexu GPIb/IX, V). Charakteristický je snížený počet abnormálně velkých trombocytů.

Glanzmannova trombastenie – AR dědičná, chybí agregační schopnost trombocytů defektem GPIIb/IIIa.
Destičkový typ von Willebrandovy choroby – je přítomna zvýšená afinita GPIb pro vWF. Tyto trombocyty jsou poté urychleně odbourávány s následnou trombocytopenií a deficitem vWF.
Heřmanského – Pudlákův syndrom – porucha skladovacích granul v trombocytech. Diagnostické trias: porucha agregace trombocytů + pigmentofágy v kostní dření + albinismus.
2. Získané
- myeloproliferativní choroby.
- monoklonální gamapatie s vysokou koncentrací paraproteinu.
- chronické selhání ledvin – upravuje se po dialýze.
- farmakologicky navozené – NSAID (kyselina acetylsalicylová, indometacin, ibuprofen).
III. Krvácivé projevy z cévních příčin
Hlavní příčinou je porucha cévní stěny. Krvácení většinou nebývají závažná, manifestují se purpurou a stejnými projevy na sliznicích. Klinicky nejvýznamnější jsou vaskulitidy.
Vaskulitidy – krvácení není nejzávažnější manifestací (tou je ischemie cílových orgánů – viz kapitola revmatologie).
Hereditární hemoragická teleangiektazie (m. Rendu-Osler-Weber) – AD dědičná dysplázie pojivové tkáně stěn kapilár se vznikem teleangiektázií, které bývají při narození malé, ale s věkem přibývají na velikosti a počtu. Nejčastěji jsou přítomny na obličeji a sliznici nosu a úst. Krvácení vzniká jejich rupturou. Laboratorní nález bývá většinou normální. Diagnóza se opírá o typický klinický nález. Specifická léčba neexistuje, často je nutné operační řešení a substituce železa po opakovaném krvácení.
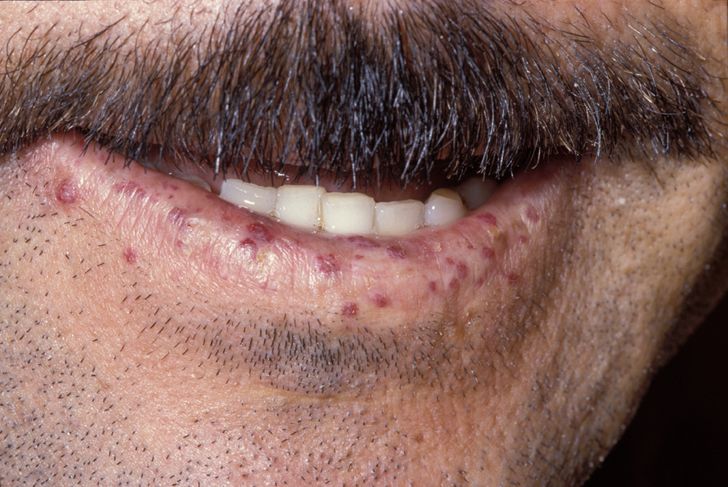
Kurděje (avitaminóza C) – v současnosti pouze u starých zanedbaných, popř. sociálně slabých osob. Typickým nálezem je perifolikulární krvácení na končetinách, na dásních a do svalů dolních končetin, někdy až formou vážných hematomů. Příčinou je oslabení cévní stěny díky poruše tvorby kolagenních vláken. Základem léčby je podávání vysokých dávek vitamínu C.

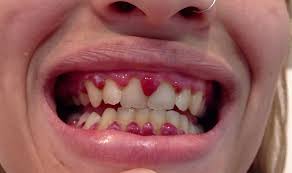
Další příčiny
- dysproteinémie např. při kryoglobulinémii.
- senilní purpura díky atrofii kůže ve stáří.
- purpura simplex – benigní tvorba četných hematomků, častěji u žen.
- Cushingův syndrom – hyperkortikalismus působí zrychlení katabolismu pojivové tkáně, včetně její cévní složky.
IV. Krvácivé stavy z plazmatických příčin
Vzniká nedostatkem nebo poruchou plamnatických koagulačních faktorů. Přístup:
- Základní koagulační screening – izolované prodloužení PT odpovídá nedostatku faktoru VII, izolované prodloužení aPTT znamená nejčastěji hemofilii A nebo B. Prodloužení aPTT i PT znamená nedostatek faktorů V, X, V nebo fibrinogenu.
- Test smíšení s normální plazmou – pokud dojde po smíšení s normální plazmou ke korekci koagulačních časů, je příčinou nedostatek koagulačních faktorů, pokud nadále přetrvává jejich prodloužení, je pravděpodobná přítomnost inhibitoru nebo antikoagulace.
1. von Willebrandova choroba
Epidemiologie a patogeneze – prevalence von Willebrandovy choroba (vWD) je 1:10 tisíc. Většina postižených, má nějakým způsobem vWF se vyskytuje v plazmě, megakaryocytech i endoteliích a subendoteliální tkáni a zajišťuje:
- adhezi mezi endotelem a trombocyty v místě poškození. Děje se tak vazbou na receptor GpIb/IX trombocytů.
- vazbu faktoru VIII, což prodlužuje plazmatický poločas faktoru VIII z cca 1,5 h na cca 10 h.
Klasifikace
vWD typ 1 (cca 30 % případů) – AD dědičnost (může být AR), částečný kvantitativní deficit vWF a většinou se projevuje mírným mukokutánním krvácením.
vWD typ 2 (cca 60 % případů) – kvalitativní porucha vWF. Má 4 subtypy.
- 2A – AD dědičnost (může být AR), nevznikají ultravelké multimery vWF – v podstatě opak TTP s porušením agregace trombocytů.
- 2B – AD dědičnost, abnormálně velká afinita vWF k GpIb/IX, dochází tak ke spontánní agregaci trombocytů (proto je současně trombocytopenie), zvýšení jeho clearance a následnému deficitu ultravelkých multimerů. Tento typ může imitovat destičkový typ vWD.
- 2M – AD dědičnost, sice vzniká dostatečné množství ultravelkých multimerů vWF, ale mají sníženou afinitu k GpIb/IX.
- 2N – AR dědičnost, je snížená afinita vWF k faktoru VIII (klinicky může být podobný lehké hemofilii A).
vWD typ 3 (< 10 % případů) – AR dědičnost, kompletní kvantitativní deficit vWF.
Klinický obraz – projevuje se lehkým až středně těžkým krvácením do sliznic a u žen v rámci menstruace, dále spontánní epistaxe a abnormální krvácení po extrakci zubů, časté jsou i krvácení do GIT. Na rozdíl od hemofilie je krvácení do kloubů velmi vzácné.
Diagnostický postup – laboratorní odběr:
- krevní obraz – často v normě, trombocyty mohou být snížené u typu 2B.
- aPTT může být prodloužené při poklesu faktoru VIII (typy 1, 2N, 3), INR bývá normální.
- dále je vhodná analýza multimerů vWF (typ 2), ristocetinem indukovaná agregace trombocytů (2B), vazba vWF na kolagen (odlišení typu 1 a 2).
Terapie – čtyři terapeutické postupy:
- Indukce vyplavení zásob vWF pomocí desmopressinu, který stimuluje uvolnění vWF a faktoru VIII u typu 1. Opakované aplikace ale vedou k poklesu efektu terapie díky vyplavení zásob obou faktorů. U typu 2 není efekt, u podtypu 2B je desmopresin kontraindikovaný (vzhledem ke zvýšené vazbě vWF na trombocyty dochází k přechodné trombocytopenii).
- Substituční léčba vWF je základem terapie typu 3 a u ostatních typu při selhání desmopressinu. Podává se koncentrát vWF a faktoru VIII z plazmy. Alternativou je rekombinantní faktor VII (NovoSeven).
- Antifibrinolytika (kyselina tranexamová, kyselina eta-aminokapronová) při menším krvácení (kontraindikováno u krvácení do močového traktu).
- Estrogeny – zcela okrajově, zejména u žen s typem 1 k redukci hypermenoragie.
2. Hemofilie
Definice – X recesivně dědičné choroby, pro které je typický deficit koagulačního faktoru VIII (hemofilie A) nebo IX (hemofilie B). Obě choroby jsou si poměrně podobné.
Epidemiologie – ženy jsou obvykle přenašečky a u mužů se choroba manifestuje (mají pouze jeden X chromozóm), zásadní je proto důsledná rodinná anamnéza ze strany matky. Incidence hemofilie je 1:10 tisíc (80 % je hemofilie A). U 30 % dochází ke vzniku hereditárních mutací de novo (negativní rodinná anamnéza), dosud bylo identifikováno > 500 příčinných mutací (gen pro FVIII je větší, než pro FIX). Faktor VIII má krátký plazmatický poločas (cca 30 min), ovše, prodlužuje se na cca 12 hodin při vazbě FVIII na vWF.
Klinický obraz – hlavním projevem je krvácení, jehož intenzita závisí na hloubce deficitu koagulačního faktoru:
- lehká forma (aktivita faktoru > 5 % normy) – krvácení při větších úrazech a chirurgických výkonech.
- středně těžká (1 – 5 %) – ojediněle spontánní a po úrazech a chirurgických výkonech.
- těžká (< 1 %) – často spontánní a při minimálních úrazech a chirurgických výkonech.
Většina krvácení probíhá do:
- kloubů (nejčastěji kolena a lokty) s poškozením synovie, chrupavek a kosti až ztrátou funkce kloubu. Krvácení se projevuje bolestivostí, otokem, kloub je teplý s postupným vznikem funkčního deficitu až ankylózy.
- svalstva, které probíhá bez následků, pouze pokud dojde ke krvácení do uzavřených prostor může vzniknout kompartment syndrom s ischemizací a neuropatií.
- u těžkých forem do
- urogenitálního traktu – CAVE Nesmí se podávat antifibrinolytika pro vysoké riziko obstrukce vývodných cest močovými koaguly.
- GIT
- CNS (často smrtelné)
Diagnostika – typické je prodloužení aPTT, lze přímo stanovit hladinu jednotlivých koagulačních faktorů. Vlastní mutaci lze odhalit DNA analýzou.
Terapie – podstatou je:
1. Substituce chybějícího faktoru ve dvou modalitách:
- profylaxe – hladina chybějícího faktoru nesmí poklesnou pod 2 %. Před chirurgickým výkonem je potřeba udržovat hladinu na 70 – 100 % po dobu 7 – 10 dnů.
- při krvácení – včasné podání koagulačních faktorů vedlo k zavedení domácí léčby, kdy si edukovaný pacient sám aplikuje koagulační faktory. V dnešní době jsou dostupné i preparáty s prodlouženým účinkem. Platí:
dávka FVIII (IU) = (cílová aktivita FVIII – bazální aktivita FVIII) x hmotnost v kg x 0,5 IU/kg
dávka FIX (IU) = (cílová aktivita FIX – bazální aktivita FVIX) x hmotnost v kg x 1 IU/kg
2. U pacientů s lehkou a střední formou lze použít desmopressin.
3. Jako podpůrná léčba při krvácení je vhodné podání antifibrinolytik (CAVE mimo krvácení do urogenitálního traktu – riziko tamponády močového mechýře a postrenální selhání) – aminokapronová kyselina, tranexamová kyselina.
4. Emicizumab – asymetrická bispecifická protilátka, která váže FIXa a FXa a umožní jim tedy těsný kontakt. Proto k aktivaci vnitřní koagulační cesty není potřeba faktor VIII. Logické je, že je protilátka použitelná pouze u hemofilie A.
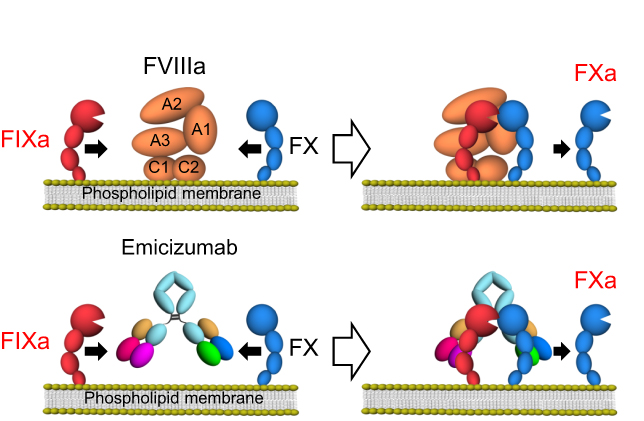
Komplikace
- Tvorba inhibitoru – hlavní komplikací léčby hemofilie je tvorba inhibitoru (aloprotilátky proti FVIII nebo FIX), který vzniká u cca 30 % pacientů s těžkou hemofilií A a 3 – 5 % u hemofilie B, obvykle v dětství a po cca 10 kumulativních dnech expozice. K podezření na přítomnost inhibitoru vede nedostatečná odpověď na substituci vypočtenou terapeutickou dávkou. Aktivita inhibitoru se udává v BU (Bethesda unit – 1 BU snižuje aktivitu koagulačního faktoru na 50 %). K úspěšné eradikaci inhibitoru dochází u 60 % pacientů po ITI (induci imunotolerance). U pacientů, kteří neodpovídají na ITI je situace obtížnější lze k ITI přidat antiCD20 (rituximab).
- V dřívějších dobách byla častá současná infekce HCV a HIV.
Prognóza – dobře léčena hemofilie zkracuje průměrnou délku života o cca 10 let oproti zdravým jedincům.
Situace u žen – většina přenašeček choroby má aktivitu faktoru VIII/IX cca 50 % oproti zdravým lidem, ale díky různě vyjádřené inaktivaci X chromozómu může být aktivita velmi variabilní. CAVE Aktivita faktoru VIII se při těhotenství zvyšuje 2 – 3x (u faktoru IX je tento nárůst méně výrazný). Těsně po porodu tato aktivita velmi rychle klesá na původní hodnotu a tedy již nemusí být dostatečná na zastavení krvácení po porodu. U vybraných pacientek je vhodné po dobu 3 dnů po vaginální porodu a 5 dnů po císaři udržovat profylakticky hladinu faktorů na 50 – 70 %.
Dysfibrinogenémie – porucha fibrinogenu vede k defektu tvorby fibrinu. Vrozené nebo sekundární (zejména při hepatopatii). U poloviny asymptomatické, u třetiny zvýšená krvácivost, u zbytku tendence k trombózám. Dochází k prodloužení aPTT, PT i trombinového času (TT je necitlivější), při jehož prodloužení je indikován k odlišení vlivu heparinu reptilázový test, který je také patologický. Hladina fibrinogenu nemá vypovídající hodnotu. Léčba závisí na symptomatologii. Při tendenci ke krvácení je cílem dosažení hladiny 1 g/l pomocí fibrinogenu, při tendenci ke trombózám je indikována běžná antikoagulační léčba jako při trombózách jiné příčiny. Hypo/afibrinogenémie znamená pokles hladiny fibrinogenu, základním opatřením je substituce k dosažení bezpečné hladiny 1 g/l.
Deficit faktorů kontaktní fáze (faktor XII, prekalikrein, vysokomolekulární kininogen) – není spojen se zvýšeným krvácením, někteří autoři považují hluboké deficity spíše za trombofilní. Projevuje se prodloužením aPTT. Substituce není nutná, naopak, při chirurgickém výkonu je doporučena profylaktická antikoagulace, při prokázané trombóze je indikována standardní léčba.
Deficit faktoru XI – AR dědičný deficit přítomný zejména u Aškenázských Židů. Krvácení je obvykle mírné, u žen silnější menstruace. Laboratorně se projevuje prodloužením aPTT při normálním PT a TT, potrvzením je laboratorní průkaz snížené aktivity faktoru XI. U menších krvácení jsou indikována fibrinolytika a DDAVP, u závažných forem substituce faktoru XI (CAVE u 10 % pacientů je tato susbtituce spojena s rizikem trombóz a DIC).
Deficit faktoru X – klinický obraz je podobný hemofilii, k závažnému krvácení dochází při poklesu aktivity faktoru VII < 1 %. Projevuje se prodloužením PT i aPTT. Terapií je substituce plazmy nebo protrombinového komplexu.
Deficit faktoru V – raritní choroba s AR dědičností, která se projevuje pouze u homozygotů tendencí ke krvácení. Typické je prodloužení PT. Terapií je substituce plazmy popřípadě rekombinantní faktor VII (NovoSeven).
Deficit faktoru VII – vrozené nebo sekundární (zejména při hepatopatii nebo poruše resorpce vitamínu K). Klinický obraz je podobný hemofilii, k závažnému krvácení dochází při poklesu aktivity faktoru VII < 1 %. Zvláštností je, že do klinického obrazu patří i trombembolické příhody. Projevuje se prodloužením PT, prokáže se stanovením aktivity faktoru VII. Principem léčby je substituce protrombinového komplexu nebo rekombinantního faktor VII (NovoSeven), který má ale krátkou dobu účinku, proto je nutné podávat opakovaně. Za bezpečnou je považována hladina 15 – 20 %.
Deficit faktoru II (trombin) – raritní choroba s AD dědičností. Heterozygoti jsou bez příznaků, homozygoti s krvácivými příznaky. Lze nalézt prodloužení aPTT a PT a zejména pokles faktoru II. Léčba je indikována při větším krvácení (plazma, protrombinový komplex).
Deficit faktoru XIII – vrozené formy jsou raritní, ke krvácení dochází pouze u homozygotů. Získané deficity byly popsány u hepatopatií, IBD a Henoch-Schönleinovy purpury. Ke krvácení dochází často už od narození. Typickým projevem je špatně se hojící pupečník a dále vznik pooperačního krvácení až s několikadenním odstupem od operace. Běžné koagulační testy jsou v normě, screeningovým testem je rozpustnost koagula v 5M močovině, deficit ověříme přímým stanovením aktivity faktoru XIII. Základem léčby krvácení je substituce plazmy. K
Kombinované deficity (FMFD) – raritní choroby, které jsou buď náhodné nebo geneticky dané s poklesem určitých faktorů:
- FMFD I – deficit 5 + 8
- FMFD II – deficit 8 + 9
- FMFD VI – deficit 9 + 11
- FMFD V – deficit 8 + 9 + 11
- FMFD IV – deficit 7 + 8
- FMFD III – deficit 2 + 7 + 9 + 10
3. Specifické inhibitory koagulačních faktorů
= protilátky proti koagulačním faktorům. V praxi se setkáváme nejčastěji proti faktoru VIII, vzácně proti IX. Vyskytuje se idiopaticky, u autoimunitního/nádorového onemocnění, po porodu a u hemofilie A.
Inhibitory faktoru VIII/IX u pacientů s hemofilií – protilátky vznikají většinou u pacientů se středně těžkým/těžkým průběhem hemofilie jako odpověď na substituci alogenním koagulačním faktorem. Přítomnost inhibitoru se projevuje zkrácením účinku nebo jeho chyběním při dostatečné substituci koagulačními faktory. Laboratorně dochází k dalšímu prodloužení aPTT. Již probíhající lehké krvácení lze zastavit kompresí, ledováním popř. v kombinaci s antifibrinolytiky, u těžších krvácení je vhodná substituční terapie, popřípadě navýšení dávky koagulačního faktoru nebo aplikace přípravku s bypass aktivitou (protrombinového komplexu, rekombinantního faktoru VII). Velkou výhodou posledních let je dostupnost moderních přípravků, které nejsou odvozeny od klasických koagulačních faktorů (nevznikají proti nim protilátky), které jsou určené zejména k profylaktické terapii:
- conicizumab – monoklonální protilátka proti TFPI (tissue factor pathway inhibitor) s následným zvýšením syntézy trombinu.
- emicizumab – viz výše.
- fitusiran – snižuje hladinu antitrombinu se zvýšením produkce trombinu.
Kortikoterapie je méně efektivní než u jiných autoimunitních chorob, někteří pacienti zareagují dobře na cyklofosfamid. Další možností je snaha o navození imunitní tolerance, zejména u dětí s čerstvým záchytem inhibitoru.
Získané inhibitory faktoru VIII (u pacientů bez hemofilie) – velice vzácná choroba s roční incidencí 1:1 milión, nejčastěji u osob > 60 let věku. V polovině případů je idiopatický, u zbytku provází autoimunitní/nádorové onemocnění nebo poporodní období. Klinický obraz je podobný hemofilii, pouze nedochází ke krvácení do kloubů. Laboratorně je výrazně prodloužené aPTT, které nelze korigovat podáním plazmy, výrazně snížená hladina faktoru VIII a přítomnost specifického inhibitoru. U třetiny může inhibitor spontánně vymizet. Léčba je založena na:
- terapii krvácivých epizod – podání aktivovaného protrombinového komplexu nebo rekombinantního faktoru VII. Je zároveň vhodné se vyvarovat i.m. injekcí.
- snížení hladiny inhibitoru – imunosupresivní léčba prednison + cyklofosfamid, při rezistenci místo cyklofosfamidu podat cyklosporin nebo azathioprin, popř. IVIG nebo rituximab. Při vysokém titru inhibitoru je vhodná plazmaferéza.
4. Syndrom diseminované intravaskulární koagulace
Definice – stav, při kterém dochází ke vzniku mnohočetných mikrotrombů s vyčerpáním koagulačních faktorů a následným krvácením.
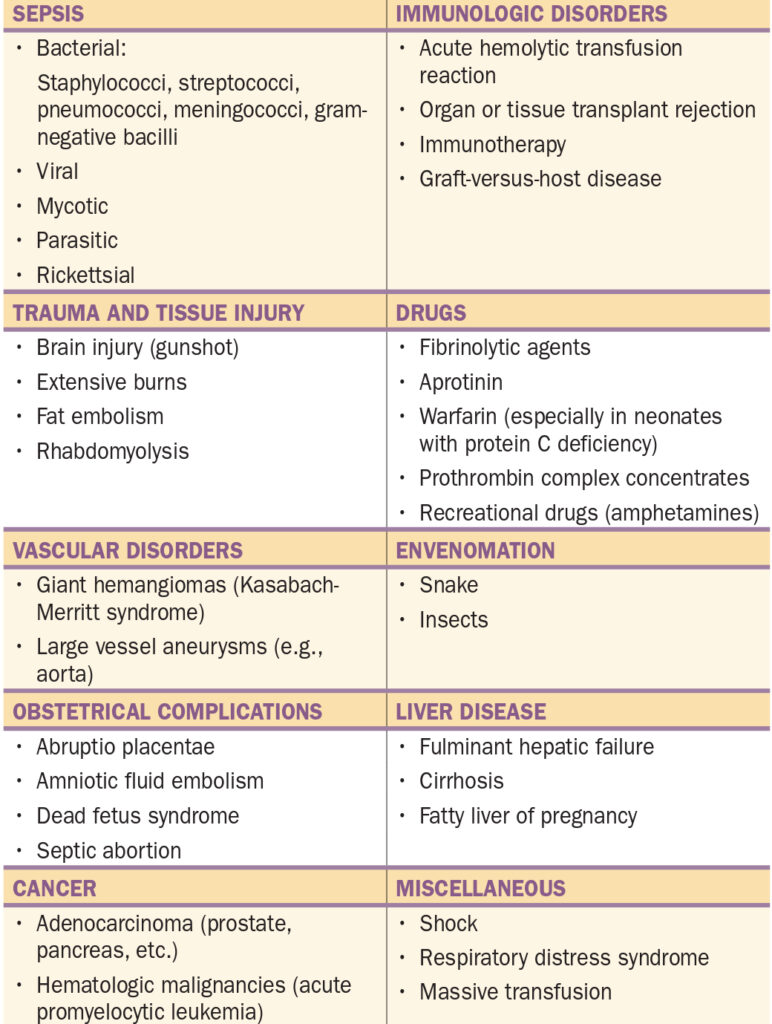
Etiologie – syndrom, který bývá většinou vyvolán jinou závažnou chorobou nebo komplikací (polytrauma, popáleniny, komplikace těhotenství, G- sepse, nádorová onemocnění).
Patogeneze – závažná vyvolávající choroba vede k celkové zánětlivé reakci a následnému uvolnění tkáňového faktoru z poškozených tkáních a současným selháním hemostatických mechanismů. Dochází k intravaskulární antikoagulaci se vznikem četných mikrotrombů, vyčerpáním a poklesem množství trombocytů i části koagulačních faktorů (II, V, VIII, XIII a fibrinogenu) a rozvojem krvácivého stavu s možností prokrvácení ischemických ložisek. Dále:
- sekundární fibrinolýza trombů vede k štěpení fibrinogenu a faktorů V a VIII s prohloubením krvácivého stavu.
- fibrin-degradační produkty inhibují trombocyty a narušují změnu fibrinogenu na fibrin.
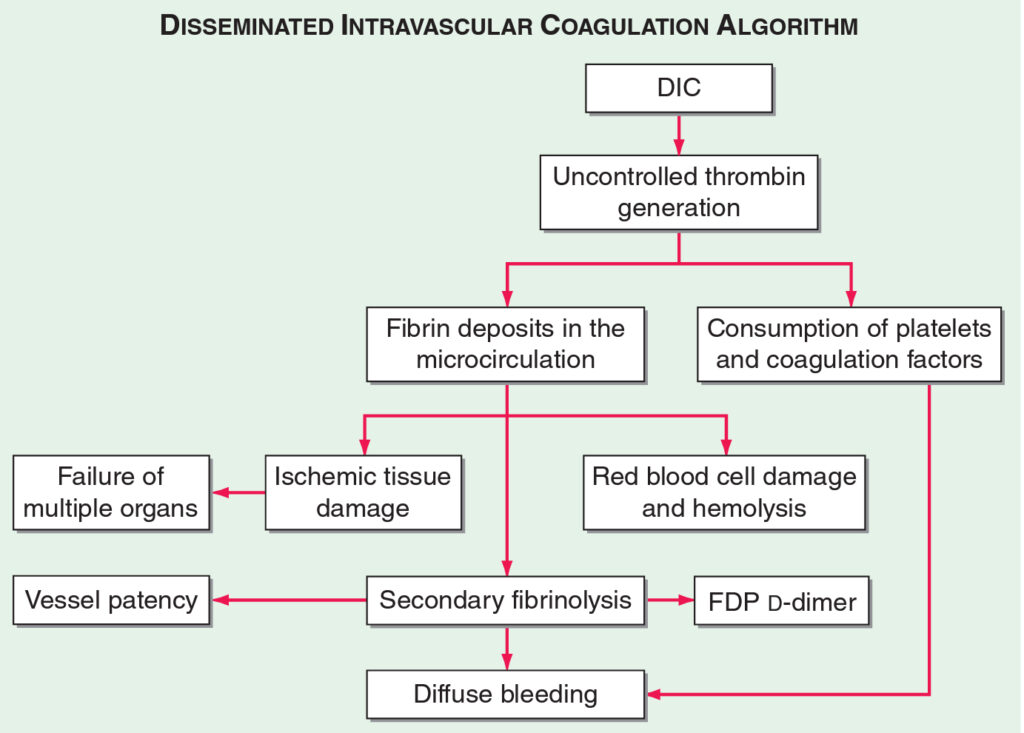
Klinický obraz – je výrazně ovlivněn vyvolávající chorobou. Může probíhat pouze laboratorně, akutně i chronicky (při chronickém průběhu se může projevovat orgánovou ischémií). U lehkých forem mohou vznikat petechie a krvácení po vpichu, u závažnějších forem i výrazné sufuze a neztišitelná krvácení. Výraznou komplikací je krvácení do zásadních orgánů (CNS, nadledviny – Waterhouse-Friderichsenův syndrom) nebo selhání orgánů na základě ischémie a/nebo hypovolémie.
Laboratorně je základním projevem zvýšení D dimerů (vzniká mnohočetná mikrotrombotizace) a solubilních fibrinových monomerů, poté dochází ke konzumpci všech složek koagulace (klesají trombocyty, fibrinogen, prodlužuje se PT i aPTT), je spotřebováván i antitrombin. Stoupá hladina FDP a D dimerů, doba euglobulinové fibrinolýzy se zkracuje (je aktivovaná fibrinolýza). Nález schistocytů v periferním obraze ukazuje na podíl mikroangiopatické hemolytické anémie.
Diagnostika – na DIC je potřeba myslet zejména u všech vyvolávajících faktorů spolu s přítomností zvýšené hladiny D dimerů a solubilních fibrinových komplexů.
Terapie – základem je na DIC pomyslet. U všech je prvním a nejdůležitějším opatřením odstranit vyvolávající faktor, dále je zásadní podpůrná léčba (korekce hypovolémie a anémie spolu s monitorací základních životních funkcí). Specifickým opatřením je:
- substituce koagulačních faktorů (úvodem 15 ml/kg plazmy, při nutnosti volumové restrikce protrombinový komplex).
- fibrinogen při poklesu jeho hladiny < 1 g/l.
- substituce trombocytů při poklesu < 50 – 100 x 109/l krve
- při vysokém riziku je indikován rekombinantní faktoru VII.
- substituce antitrombinu při jeho poklesu s cílem neutralizace trombinu (1 IU/kg tělesné hmotnosti zvýší aktivitu jeho aktivitu o 1 %).
- antikoagulační terapie je velice kontroverzní a je indikována k přerušení tvorby fibrinu a zabránit jednak ischemické mikrotrombotizaci, jednak zabránění vyčerpání koagulačních faktorů (dávka obvykle 4 – 10 j/kg/h). Při rozsáhlém krvácení nebo krvácení do preformovaných dutin s životně důležitými orgány (lebka, perikard apod.) je antikoagulační léčba kontraindikována.
5. Syndrom primární hyperfibrinolýzy – stav s klinicko-laboratorním obrazem vystupňované fibrinolýzy s hypofibrinogenémií. Lze prokázat u pokročilého karcinomu prostaty nebo tlustého střeva, které vyplavují látky aktivující přímo fibrinolýzu. Vytvořený plazmin odbourává přímo fibrinogen a faktory V a VIII, hladina fibrinogenu je velice nízká (na rozdíl od DIC jsou D dimery normální, není velká trombocytopenie a nejsou přítomny solubilní fibrinové monomery – v.s. solidní fibrinová síť ještě nestihne vzniknout). Terapeuticky lze podat antifibrinolytika (PAMBA, EACA) a inhibitor pankreatického trypsinu aprotinin.
6. Koagulační poruchy spojené hepatopatií – v játrech je syntetizována většina koagulačních faktorů. Koagulopatie má několik příčin:
- trombocytopenie – díky poolování tromboytů ve zvětšené slezině při portální hypertenzi, dále sníženou produkcí TPO játry a při hepatitidě C je běžná i autoimunitní trombocytopenie. Při jaterním selhání je běžná i trombocytopatie.
- porucha syntézy koagulačních faktorů – od počátku faktorů II, V, VII, X, při pokročilejší hepatopatii i faktoru IX, XI, XII.
- pokles syntézy proteinů C a S.
V. Trombofilní stavy
Stav zvýšené pohotovosti ke tvorbě trombů, která je vyvolána spouštěcím faktorem (operace, imobilizace, hormonální antikoncepce, dehydratace, nádor apod.). Predispozice k trombóze je dále zvýšena věkem > 60 let. Typy:
Dědičné trombofilie
Některou z dědičných trombofilií lze prokázat u cca 70 % pacientů s hlubokou žilní trombózou (DVT). Nejčastější typy:
I. Zvýšení aktivity prokoagulačního faktoru
- mutace protrombinu (FII 20210G→A), která vede ke zvýšení produkce protrombinu.
- zvýšení aktivity faktoru VIII (> 150 % normálu) zvyšuje riziko DVT 6x.
- zvýšení aktivity faktoru IX zvyšuje riziko DVT 2 – 3x.
- zvýšení aktivity faktoru XI.
II. Snížení aktivity inhibitorů koagulace
- FV Leydenská mutace (FV:R 506Q) – rezistence k aktivovanému proteinu C. U homozygotů je riziko DVT až 7x vyšší, u heterozygotů je pravděpodobně zvýšené pouze pokud se přidá další vyvolávající faktor.
- snížení aktivity antitrombinu, proteinu C nebo proteinu S.
III. Ostatní
Hyperhomocysteinémie – primárně mutací genu pro cystathionbeta-syntházu nebo methylentetrahydrofolátreduktázu (MTHFR). Zvyšuje riziko tromboembolie zejména v těhotenství a šestinedělí. V současnosti se při pátrání po příčině DVT tato mutace již nevyšetřuje. Sekundárně lze hyperhomocyteinémii nalézt u jedinců s nedostatkem vitamínu B6, B12, kyseliny listové a dále při renální insuficienci.
Získané trombofilie
- těhotenství – ve II. a III. trimestru je u všech těhotných žen zvýšena hladina faktoru VII, VIII, IX, X, XI (7 – 11), protrombinu a fibrinogenu, dále PAI-1 i -2 a TAFI (inhibitor fibrinolýzy indukovaný trombinem). Toto je ale kompenzováno celou řadou mechanizmů, takže při fyziologickém těhotenství ke vzniku trombů nedochází. Při současném výskytu některých trombofilních stavů nebo antifosfolipidového syndromu je nutné nemocné dispenzarizovat a během celého těhotenství a šestinedělí event. podávat 1x denně profylaktické dávky LMWH s.c.
- perorální antikoncepce – zvyšuje faktor VIII, vWF a fibrinogen a např. při FV Leiden se riziko DVT zvyšuje až 30x.
- zánět – zánětlivé cytokiny aktivují endotel, který poté na svém povrchu exprimuje tkáňový faktor a adhezivní molekuly (P selektiny), ICAM, VCAM), které působí protrombogenně.
- antifosfolipidový syndrom – viz kapitola 350.
- nádor – i zde má pravděpodobně velkou roli systémová zánětlivá reakce (mezi paraneoplastické znaky patří např. Trousseaův příznak migrující tromboflebitidy).
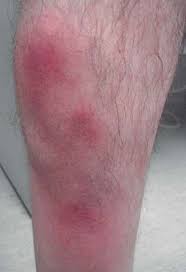
Prevence trombembolismu
Vhodná u pacientů se srdečním selháním, respirační insuficiencí a imobilních rizikových pacientů (aktivní nádor, systémový zánět, st.p. CMP, anamnéza DVT apod.).
- eliminace venostázy – brzká mobilizace, bandáže (imobilizace > 3 dny již výrazně zvyšuje riziko DVT).
- profylace – LMWH, fondaparinux po dobu cca 10 dnů po operaci (samozřejmě dle závažnosti operace). V případě ortopedických zákroků lze použít rivoraxaban a dabigatran v případě náhrady kolene 10 – 14 dnů po operaci, v případě náhrady kyčelního kloubu až 35 dnů po operaci.
114. Antitrombotická terapie
I. Antiagregační terapie
1. Inhibice syntézy TxA2
Kyselina acetylsalicylová
Mechanismus účinku – kyselina acetylsalicylová (ASA) ireverzibilně acetyluje a inhibuje cyklooxygenázu I (COX I), která je zásadní pro syntézu tromboxanu (Tx) A2. Ve vysokých dávkách (> 1g) inhibuje i COX II a má tedy protizánětlivý efekt.
Nežádoucí účinky – nejčastějším nežádoucím účinkem (NÚ) je GIT intolerance sahající od dyspepie po žaludeční vředy (roční riziko 1 – 3 %). Tyto NÚ jsou závislé na dávce a výrazně ho redukuje současné podávání PPI. Dalším NÚ alergie na ASA s bronchospasmem (častěji u pacientů s asthmatem a chronickou kopřivkou).
Chirurgické výkony – ASA měla být vysazena 7 dní před chirurgickým výkonem.
Interakce – farmakodynamické interakce vznikají kombinací jednotlivých antiagregancií, což vede k vyšší antiagregaci a zároveň k vyššímu riziku krvácení. Důležité jsou i následující:
- ASA + ibuprofen – při současném podání vyblokuje krátkodobější ibuprofen COX-1, po cca 8 hodinách dochází k jejímu odblokování, ale zároveň již poklesla hladina ASA pod účinnou hladinu, proto dojde k poklesu antiagregačního účinku. Při nutnosti současného podání je proto nutné ASA podat cca 2 hodiny před ibuprofenem. Ostatní NSAID nesoupeří o stejné vazebné místo, proto k interakci nedochází.
- ASA/klopidogrel + SSRI – zvýšení rizika krvácení nejasné etiologie.
Z farmakokinetických jsou důležité:
- ASA + PPI – ASA je slabá hydrofilní kyselina s pK 3,5, k optimální resorpci proto dochází ve výrazně kyselém prostředí (pH < 3,5). Při podávání PPI dochází k vzestupu pH > 3,5 a proto zhoršení resorpce ASA. Přesto je PPI indikováno při jakékoliv zvýšení rizika krvácení nad normu.
- U některých byla zjištěna i rezistence k ASA na základě genetických polymorfismů.
2. Inhibice receptoru pro ADP P2Y12
Thienopyridiny
Mechanismus účinku – strukturálně příbuzné léky, které ireverzibilně blokují P2Y12 receptor pro ADP. Patří mezi ně clopidogrel (C) a prasugrel (P) a oba vyžadují ke své aktivaci enzym CYP 450. P má cca 10x silnější antiagregační účinek než C.
Nežádoucí účinky – nejčastějším NÚ je krvácení, které je častější po P.
Chirurgické výkony – C by měl být vysazen 5 dní a P 7 dní před chirurgickým výkonem.
Interakce clopidogrelu – klopidogrel + PPI – lansoprazol a omeprazol inhibují CYP2C19, pantoprazol a esomeprazol méně, rabeprazol ji neinhibuje. Zejména kombinace s omeprazolem vede ke snížení biokonverze na aktivní metabolit a tak i snížení účinnosti. CAVE Snížení kyselého prostředí po PPI vede zároveň ke snížení resorpce.
Interakce prasugrelu – velmi nízký interakční potenciál.
Ticagrelor
Na rozdíl od thienopyridinů nevyžaduje ticagrelor (T) metabolickou aktivaci a má významnější a předvídatelnější účinek než C.
Nežádoucí účinky – nejčastějším NÚ je krvácení, dále se u 15 % pacientů objevuje mírná a postupně ustupující dušnost nejasné etiologie.
Chirurgické výkony – T C by měl být vysazen 5 dní před chirurgickým výkonem.
Cangrelor
Rychle působící (nástup účinku 3 – 5 minut) a reverzibilní inhibitor P2Y12, který je podáván i.v. a jehož účinek ustupuje po cca 1 hodině od ukončení aplikace.
3. Antagonisté receptoru GpIIb/IIIa
Mechanismus účinku – každý trombocyt obsahuje cca 50 tisíc molekul GpIIb/IIIa, které jsou složeny z heterodimeru a jsou aktivní pouze u aktivovaných trombocytů. jejich úlohou je vazba fibrinogenu a vWF. Antagonisté GpIIb/IIIa jsou indikovány při průkazu intrakoronární trombózy u pacientů s akutním koronárním syndromem jako součást bail-out (záchranné) strategie. Mechanismus účinku jednotlivých látek je odlišný.
Nežádoucí účinky – nejčastějším nežádoucím účinkem je krvácení a trombocytopenie (u 5 % pacientů léčených abciximabem, u cca 1 % pacientů léčených eptifibatidem a tirofibanem).
Abciximab – Fab fragment humanizované myší protilátky proti aktivované formě GpIIb/IIIa, který jej blokuje.
Eptifibatid – cyklický heptapeptid, který se váže na GpIIb/IIIa a brání tak jeho vazbě na Arg-Gly-Asp (RGD) sekvenci α řetězce fibrinogenu.
Tirofiban – nepeptidová molekula, která se váže na GpIIb/IIIa a brání tak jeho vazbě na Lys-Gly-Asp (KGD) sekvenci γ řetězce fibrinogenu.
Další skupinou léků jsou antagonisté PAR-1 receptorů pro trombin, které jsou také aktivují trombocyty. Jediným zástupcem je voraparax, který je schválen FDA, ale již nikoliv EMA a není tak v EU dostupný. Jeho hlavním nežádoucím účinkem je dvojnásobné riziko vzniku krvácení do mozku ve srovnání s placebem.
II. Antikoagulační terapie
1. Heparin
Mechanismus účinku – nefrakcionovaný heparin (UHF) je sulfatovaný polysacharid, který se přirozeně vyskytuje v organismu v mastocytech. Váže se na antitrombin (α2 globulinu antiplazmin) a nejméně stonásobně zvyšuje jeho aktivitu (tedy inhibici trombinu a faktoru Xa). Obsahuje unikátní pentasacharidovou doménu, která je klíčová ke změně konformace a tedy v aktivaci antitrombinu (zvyšuje jeho vazbu na faktor Xa a trombin), navíc celá molekula UHF přemosťuje a váže antitrombin spolu s trombinem a zvyšuje tak jeho účinek. UHF dále uvolňuje inhibitor vnější cesty TFPI z endotelu.
UHF musí být podán paranterálně, po aplikaci se váže na endotel a plazmatické proteiny (např. vysokomolekulární multimery vWF, PF4, apod.) Při nízké dávce je jeho clearance velmi rychlá, protože dochází k vazbě na endotel (při dávce 25 IU/kg je plazmatický poločas 30 min), při vyšších dávkách jsou vazebná místa na endotelu již zaplněna a clearance je tedy pomalejší (při dávce 100 IU/kg je plazmatický poločas 60 min),
Dávkování – profylakticky se podává nejčastěji subkutánně 2 – 3x denně 5000 IU s.c., terapeuticky jako bolus 5000 – 10000 IU a poté kontinuálně 18 – 20 IU/kg/h.
Monitorace terapie – ke stanovení účinnosti terapie lze užít aPTT a anti-Xa aktivitu. Ve většině případů je vhodné prodloužení aPTT na 2 – 3 násobek normy. U 30 % pacientů nevede ani vysoká dávka UHF k potřebnému zvýšení aPTT a tito pacienti se označují jako heparin rezistentní a místo aPTT je u nich vhodné stanovení anti-Xa adjustované na UHF.
Nežádoucí účinky
- krvácení.
- HIT (viz výše).
- snížení kostní denzity u 30 % pacientů léčených > 1 měsíc.
2. LMWH
Mechanismus účinku – nízkomolekulární hepariny (LMWH) jsou malé fragmenty UHF z něj získané enzymatickou nebo chemickou depolymerizací. Průměrná délka řetězce LMWH je 17 sacharidových jednotek, které jsou schopny stimulací antitrombinu inaktivovat faktor Xa, ale jsou příliš krátké na přiblížení antitrombinu k trombinu a jeho inaktivaci (resp. inaktivují trombin pouze v malé míře). Po s.c. podání (lze podat i i.v.) se nevážou na endotel ani na plazmatické proteiny. Mají tak mnohem předvídatelnější farmakokinetiku a účinek závislý na dávce. Jejich plazmatický poločas je cca 4 hodiny a jsou eliminovány ledvinami.
Dávkování a monitorace léčby – u většiny pacientů není potřeba monitorace dávky. Toto neplatí u pacientů s renální insuficienci (zde je vhodná redukce dávky o cca 1/3) nebo morbidně obézních, u kterých je vhodná kontrola antikoagulačního účinku pomocí anti-Xa odebraného obvykle 4 hodiny po aplikaci. Dávkování a cílová hladina anti-Xa je stanovena podle cíle terapie:
- profylaktické podávání – cílová hladina anti-Xa je 0,2 – 0,4 U/ml, dávkování např. enoxaparinu (Clexane) je 0,4 ml 1x denně.
- terapeutické podávání – cílová hladina anti-Xa je 0,5 – 1,2 U/ml, dávkování např. enoxaparinu (Clexane) je 0,01 ml (1 mg) 2x denně.
Nežádoucí účinky – podobné jako u UHF, ale celkově nižší riziko:
- krvácení – riziko krvácení je celkově nižší než u UHF. I u LMWH lze použít protamin, který sice kompletně ruší antitrombinový účinek (neutralizuje dlouhé fragmenty), ale pouze málo inhibuje anti-Xa účinek, proto má protamin antagonistický účinek proti LMWH pouze částečný (kratší heparinové fragmenty se na protamin nevážou).
- HIT – riziko HIT je až 5x nižší ve srovnání s HIT.
- osteoporóza – menší riziko.
3. Fondaparinux
Mechanismus účinku – syntetický analog pentasacharidové sekvence UHF, která se váže na antitrombin a inaktivuje anti-Xa. Je příliš krátký, aby dokázal spojit antitrombin s trombinem a tak jej inaktivovat. Po s.c. aplikaci je zcela biologicky dostupný, aniž by se vázal na plazmatické proteiny nebo endoteliální buňky. jeho plazmatický poločas je 17 hodin, je nezměněn vylučován ledvinami a proto je kontraindikován u pacientů s GF < 0,5 ml/s.
Dávkování – při prevenci trombembolické choroby se podává dávka 2,5 mg jednou denně, při léčbě již prokázané tromboembolické choroby pak 7,5 mg jednou denně (při tělesné hmotnost < 50 kg se podává 5 mg denně, při tělesné hmotnosti > 100 kg pak 10 mg denně).
Nežádoucí účinky – hlavním nežádoucím účinkem je krvácení a nevýhodou je, že nemá antidotum. Při krvácení lze odstranit účinek fondaparinuxu aktivovaným faktorem VII (Novoseven). Fondaparinux nepůsobí HIT, protože se neváže na PF4 (a je tedy indikován jako antikoagulační terapie při vzniku HIT).
4. Bivalirudin
Syntetický analog hirudinu o velikosti 20 aminokyselin, který divalentně přímo inhibuje trombin. Po i.v. aplikaci má plazmatický poločas 25 minut, je degradován peptidázami a částečně vylučován ledvinami. Při nižších dávkách je vhodnější monitorace účinku pomocí aPTT, u vyšších dávek pomocí ACT.
5. Warfarin
Antagonista účinku vitamínu K rozpustný ve vodě, který byl původně užívaný k hubení hlodavců.
Mechanismus účinku – warfarin inhibuje VKOR, který redukuje vitamín K tak aby mohl být kofaktorem vitamín K dependentní karboxylázy, která karboxyluje kyselinu glutamovou na N-konci koagulačních faktorů II, VII, IX a X, bez kterých nemohou být tyto koagulační faktory aktivovány. K odeznění účinku warfarinu dojde až poté, co jsou syntetizovány nové koagulační faktory. Začátek terapie warfarinem musí být překryt nejméně prvních 5 dnů UHF, LMHW nebo fondaparinuxem, jelikož k nástupu účinku dochází pozvolně a dochází také ke snížení hladiny proteinu C a S (tedy úvodem vzniká hyperkoagulační stav). Racemický warfarin (izomery R a S) je po p.o. podání rychle a téměř úplně vstřebán, k maximální plazmatické koncentraci dochází po 90 minutách od podání, v plazmě je > 97 % warfarinu vázáno na albumin a má biologický poločas 36 – 42 h.
Metabolismus a interakce – S-warfarin je metabolizován a inaktivován pomocí CYP2C9, R-warfarin pomocí CYP1A1 a CYP1A2. Za některých situací může být k dosažení dostatečného antikoagulačního účinku potřeba i snížené dávky warfarinu:
- cca 25 % bělochů (méně v případě černochů a asiatů) má v genetické výbavě CYP2C9*2 nebo CYP2C9*3, které mají redukovanou metabolickou aktivitu a tedy warfarin degradují pomaleji.
- VKORC1 mohou mít více haplotypů, které mají různou citlivost vůči warfarinu.
- věk – snížená exprese cytochromů vede k větší citlivosti k warfarinu ve vyšším věku.
- chronická renální insuficience – při GF < 0,5 ml/s je nutná redukce warfarinu o 20 %.
- příjem vitamínu K v potravě – omezit popřípadě stabilně dodržovat určité množství vitamínu K v potravě. Na vitamín K je bohatá listová a kořenová zelenina, vnitřnosti.
- lékové interakce:
- snížení resorpce warfarinu při současné léčbě pryskyřicemi.
- ovlivněni CYP2C9 – indukce se snížením efektu warfarinu (karbamazepim, rifampicin, fenobarbital, třezalka), inhibice se zvýšením efektu warfarinu (amiodaron, propafenon, verapamil, klopidogrel, azolová antimykotika, klaritomycin, omeprazol, metronidazol aj.).
- ovlivnění CYP1A1 a CYP1A2 – inhibice a zvýšení nabídky R-warfarinu se zvýšením rizika krvácení (ciprofloxacin, amiodaron).
- warfarin + NSAID – zvýšení rizika krvácení do GIT a zvýšení INR, při potřebě je vhodnější kombinace tramadol a paracetamol.
Monitorace funkce – k monitoraci funkce se nejčastěji užívá protrombinový čas (odráží aktivitu faktoru VII, X a II) a je nejčastěji stanovován ve formě INR (International Normalized Ratio), který porovnává protrombinový čas pacienta s kontrolním sérem (norma je 0,8 – 1,2). Cílovým INR ve většině indikací je hodnota 2 – 3 (u mechanické mitrální chlopně 2,5 – 3,5). Při poklesu < 1,7 je zvýšení reizika trombózy, při vzestupu > 4,5 je zvýšení rizika krvácení.
Dávkování – úvodem je vhodné podat 5 – 10 mg, poté dle INR, které jer vhodné provést za cca 3 dny (mě se osvědčilo 10 mg, poté 5 mg, poté úprava dávky dle INR). Vždy nutné překrýt LMWH, UHF nebo fondaparinuxem.
Těhotenství – CAVE – vždy je třeba si uvědomit, že warfarin přestupuje placentu a může být teratogenní (zejména v 6 – 12 t.g.), proto by neměl být užíván v těhotenství, ale dle ESC guidelines 2018 při péči o těhotné s
- mechanickou chlopenní náhradou lze warfarin podávat po celé těhotenství, pokud je jeho dávka < 5 mg/den (vždy po souhlasu matky), pokud je potřeba vyšších dávek, je v 6 – 12 t.g. vhodné pacienta převést na LMWH nebo UHF. Všechny pacientky je v 36 t.g. vhodné převést na LMWH nebo UHF (při mechanické chlopni jsou doporučeny cílové hodnoty anti-Xa 0,8–1,2 U/ml 4–6 h po podání (aortální náhrady) nebo 1,0–1,2 U/ml (mitrální a pravostranné náhrady) a těsně před podáním pak > 0,6 U/ml). Pokud je porod naplánovaný, je 36 hod před jeho začátkem vhodné pacientky převést z LMWH na UHF a a ten 4 – 6 hodin před porodem vysadit, pokud vše proběhne bez komplikací, tak lze opět UHF nasadit 4 – 6 hodin po porodu. Pokud porod začne při užívání warfarinu nebo < 2 týdny po jeho převodu na LMWH, je vhodnější provést císařský řez (riziko intrakraniálního krvácení při vaginálním porodu). Z důvodu těchto potenciálních komplikací je u každé pacientky, která plánuje mít ještě dítě, vhodná implantace bioprotézy.
- trombembolickou nemocí je u zdravých, ale vysoce rizikových pacientek pro vznik TEN vhodné podávání LMWH v preventivní dávce. Při st.p. plicní embolii nebo trombembolické nemoci jsou lékem volby LMWH, v případě vysokého rizika je příprava na porod stejná v případě chlopenních náhrad, při nízkém riziku je vhodné LMWH vynechat 24h před indukcí porodu. Warfarin lze podávat po celou dobu kojení, protože nepřestupuje do mateřského mléka. NOAC nejsou v těhotenství doporučeny.
Nežádoucí účinky
- krvácení – při INR 3,5 – 10 bez známek krvácení je vhodné warfarin vysadit dokud nedojde k návratu do požadovaného rozmezí. Při INR > 10 lze podat vitamín K v dávce 3 – 5 mg (kapek) Kanavitu, ale nutné si uvědomit, že po podání vyšších dávek 5 – 10 mg (kapek) je dočasně velmi obtížné znovu nastavení terapeutické hladiny. Při krvácení je dle závažnosti podat 5 – 10 mg vitamínu K formou i.v. infúze s podporou protrombinového komplexu (faktory II, VII, IX, X), který neutralizuje efekt warfarinu rychleji než čerstvá mražená plazma.
- kožní nekróza – vzniká po 2 – 5 dnech po zahájení terapie warfarinem, zpočátku jako erytematózní ložisko s nekrózou postupující od středu. Důvodem je přechodný deficit proteinu C a proteinu S a tím hyperkoagulační stav (proto je nerizikovějším nedostatek proteinu C a S ještě před zahájením terapie warfarinem) a dojde k mikrotrombotizaci a vzniku nekrózy. Nutné je přerušení terapie warfarinem, podání LMWH, fondaparinuxu nebo UHF a event. substituce proteinu C. Prevencí je proto dostatečný překryv terapie warfarinem a LMWH.
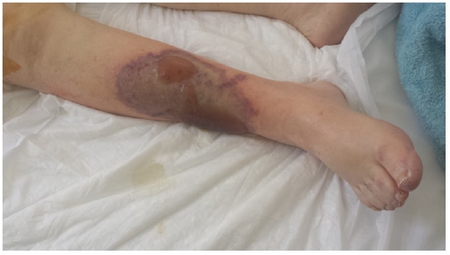
6. DOACs
Definice – DOACs (Direct Oral AntiCoagulants) jsou perorální látky s přímou inhibicí antikoagulační kaskády. Patří mezi ně přímý inhibitor trombinu dabigatran a inhibitory faktoru Xa rivoraxaban, apixaban a edoxaban. Jejich výhodou je, že mají velmi rychlý nástup účinku a není u nich potřeba pravidelná kontrola koagulačních parametrů ani přísná dieta (mimo některých interakcí – viz. níže).
Jednotlivé parametry a proměnné při užívání DOACs:
- indikace
- paroxysmální fibrilace síní – jsou léky první volby při nevalvulární fibrilaci síní (přítomnost nejméně středně významné mitrální stenózy) při skóre CHADS2VASC ≥ 2 u žen a ≥ 1 u mužů.
- trombembolická choroba (hluboká žilní trombóza, plicní embolie).
- CAVE Kontraindikovány u mechanické chlopenní náhrady a valvulární fibrilace síní, naopak, při biologické chlopni je možné použití.
- převádění mezi DOACs, VKA a UHF
- z VKA na DOACs – terapie DOACs může být zahájena okamžitě, při poklesu INR < 2,0, při INR 2,0 – 2,5 ihned, nebo lépe další den, při INR > 2,5 by neměly být DOACs podány a měl by být zvážen biologický poločas VKA k odhadu poklesu INR pod 2,5.
- z DOACs na VKA – DOAC by měly být podávány do dosažení cílového INR, přičemž u warfarinu není (!) doporučeno použití nasycovací dávky. CAVE Vzhledem k tomu, že DOACs mohou ovlivnit INR, je nutné kontrolovat hladinu INR před další dávkou DOACs. Pokud jsou DOACs kontraindikované, lze vysadit ihned, převést na LMWH a z nich na VKA.
- v případě UHF je možné podat DOACs 2 – 4 hodin po vysazení UHF (poločas 2 hodiny), nebo v případě LMWH v době jejich další očekávané aplikace.
- kdy podávat – rivoraxaban by měl být podáván současně s jídlem, ostatní nemají interakce s potravou. Dabigatran zase není možné drtit do NGS, ostatní rozdrtit lze.
- prodrug – dabigatran je podáván jako prodrug, ostatní léky ne.
- při jakémkoliv podezření na riziko krvácení do GIT je nutné současné podání PPI (přestože v případě dabigatranu snižují absorpci o cca 20 %).
- všechny DOACs jsou KI při jaterní cirhóze Child-Pugh C, v případě rivoraxabanu i při B (v této třídě je nutné ostatní DOACs podávat s velkou opatrností zejména s ohledem na nativní INR).
- všechny DOACs jsou kontraindikovány při GF < 0,25 ml/s, v případě dabigatranu již při GF < 0,5 ml/s.
- všechny DOACs jsou kontraindikovány při těhotenství.
- při závažném krvácení při terapii DOACs je indikováno podání antidota a samozřejmě klasické zastavení krvácení, dále podání antifibrinolytik (kontraindikovány při krvácení do urogenitálního traktu), protrombinový komplex nebo aPCC (aktivovaný prokoagulační komplex). Existující antidota a jejich dávkování:
- dabigatran – idarucizumab (Praxbind 2,5 g), podat dvě dávky čase 0 a po nejméně 15 minutách.
- rivaroxaban, apixaban, edoxaban – andexanet (ONDEXXYA 200 mg), dávkování je složitější dle odstupu od poslední dávky DOACs se podává nižší nebo vyšší dávka). pozn. jedno balení léku stojí cca 340 tisíc Kč.
- při plánovaném chirurgickém výkonu je třeba DOACs vysadit 1 den před výkonem v případě nízkého rizika krvácení a 2 dny v případě vysokého rizika krvácení., s tím, že žádný bridging jinými antikoagulačními látkami (jako v případě VKA) není doporučen. Při chronické renální insuficienci je nutné počítat s pomalejší eliminací.
Dabigatran
Přímý inhibitor trombinu, po podání se z 35 % váže na plazmatické proteiny. Má řadu významných interakcí (neměl by být používán s dronedaronem, rifampicinem, azolovými antimykotiky a třezalkou tečkovanou). Doporučená denní dávka je 2x denně 150 mg, redukce dávky na 2x denně 110 mg je doporučeno ve věku > 80 let a při současném podávání verapamilu, při GF 0,5 – 0,9 ml/s lze zvážit redukci dávky, při GF < 0,5 ml/s je podání dabigatranu kontraindikováno (80 % dabigatranu je eliminováno ledvinami). Při koagulačních testech lze prokázat výrazné prodloužení trombinového času (…logicky). K antagonizaci účinku je dostupné antidotum idarucizumab.
Rivoraxaban
Inhibitor faktoru Xa, po podání se z 95 % váže na plazmatické bílkoviny. Má také řadu významných interakcí (neměl by být používán s dronedaronem, rifampicinem, azolovými antimykotiky, třezalkou tečkovanou a HIV proteázovými inhibitory). Antagonistou je andexanet. Doporučená denní dávka u:
- fibrilace síní je 1x denně 20 mg, redukce dávky na 1x denně 15 mg je doporučeno při GF < 0,833 ml/s, při GF< 0,25 ml/s je podání rivoraxabanu kontraindikováno (35 % rivoraxabanu je eliminováno ledvinami). Lék se musí podávat s jídlem (při podání na lačno se resorbce sníží o 39 %).
- trombembolická nemoc – po dobu 21 dnů 15 mg 2x denně, poté 20 mg 1x denně, po 6 měsících redukce na 10 mg 1x denně.
- sekundární prevence u ICHS – po ukončení DAPT chronicky ASA + 2,5 mg 2x denně.
Apixaban
Inhibitor faktoru Xa, po podání se z 87 % váže na plazmatické bílkoviny. Má také řadu významných interakcí (neměl by být používán s klaritromycinem, rifampicinem, azolovými antimykotiky, třezalkou tečkovanou a HIV proteázovými inhibitory). Antagonistou je andexanet. Doporučená denní dávka u:
- fibrilace síní je 2 x denně 5 mg, redukce dávky na 2x denně 2,5 mg je doporučeno v přítomnosti dvou a více faktorů z následujících tří: tělesná hmotnost < 60 kg, věk > 80 let, Skreatinin > 133 μmol/l, při GF< 0,25 ml/s je podání apixabanu kontraindikováno (27 % apixabanu je eliminováno ledvinami).
- trombembolická nemoc – po dobu 7 dnů 10 mg 2x denně, poté 5 mg 2x denně.
Edoxaban
Inhibitor faktoru Xa, po podání se z 55 % váže na plazmatické bílkoviny. Má také řadu významných interakcí (opatrnost je potřeba při podávání dronedaronu, verapamilu, klaritromycinu, azolových antimykotik, neměl by být používán s třezalkou tečkovanou). Antagonistou je andexanet. Doporučená denní dávka u:
- fibrilace síní je 1x denně 60 mg, redukce dávky na 1x denně 30 mg je doporučeno v přítomnosti jednoho z následujících faktorů: tělesná hmotnost < 60 kg, GF< 0,833 ml/s, současná terapii silnými inhibitory P-gp (amiodaron, dronedaron, verapamil, klaritromycin, azolovými antimykotiky). Při GF< 0,25 ml/s je podání edoxabanu kontraindikováno (50 % edoxabanu je eliminováno ledvinami) CAVE U pacientů s velmi vysokou GF (>1,6 ml/s) může být antikoagulační účinek menší a je ke zvážení použití jiného DOAC.
- trombembolická nemoc – 1 x 60 mg.
III. Fibrinolytika
Fibrinolytika jsou látky, jejichž podání má vést k rozpuštění trombu aktivací plazminu. Jejich podání je pouze intravenózní a to buď systémově (akutní infarkt myokardu při nedostupnosti PCI, masivní plicní embolie, ischemická centrální mozková příhoda) nebo lokalizované (arteriální nebo proximální žilní trombóza). Zásadní je znalost kontraindikací fibrinolytické terapie:
- Absolutní kontraindikace
- anamnéza hemoragické CMP nebo CMP neznámé etiologie kdykoliv. .
- ischemická cévní mozková příhoda v předchozích šesti měsících
- těžké trauma, operace nebo poranění hlavy v předchozích třech týdnech.
- tumor CNS.
- hemoragická diatéza nebo aktivní krvácení
- Relativní
- TIA v předchozích šesti měsících.
- perorální antikoagulační léčba.
- těhotenství nebo první týden po porodu.
- nestlačitelná místa vpichu.
- traumatická resuscitace.
- refrakterní hypertenze (systolický TK > 180 mm Hg).
- pokročilé jaterní onemocnění.
- infekční endokarditida.
- aktivní peptický vřed.
Mechanismus účinku – existují fibrin nespecifické (streptokináza, urokináza, anistreptláza) a fibrin specifické aktivátory plazmin (altepláza, retepláza, tenectepláza), které převádí neaktivní zymogen plazminogen na aktivní formu plazmin. V ČR jsou k dispozici následující fibrinolytika:
Altepláza
ACTILYSE (1 mg/1 ml – 10 ml, 20 ml a 50 ml). Rekombinantní forma jednořetězcového tPA, která je plazminem rychle konvertována na dvouřetězcovou formu (v přítomnosti fibrinu mají obě formy stejnou fibrinolytickou aktivitu, při jeho absenci má jednořetezcová forma aktivitu 10x nižší). Altepláza má navíc v přítomnosti fibrinu 100 – 1000x vyšší aktivitu než v přítomnosti fibrinogenu. Má pět domén a jedna z nich (finger domain) je dominantně odpovědná za interakci s fibrinem.
Přestože se původně předpokládalo, že altepláza je striktně fibrin selektivní, ukázalo se, že hlavní solubilní degradační produkt fibrinu (DD)E (D dimer nekovalentně vázaný k fragmentu E) váže s velkou aktivitou alteplázu a plazminogen a takto aktivovaný plazmin výrazně degraduje fibrinogen za vzniku (mimo jiné) fragmentu X, který se váže na trombus v místě vaskulárního poškození a napomáhá k jeho lýze, což můžer napomáhat ke vzniku krvácení.
- masivní plicní embolie – 10 mg jako intravenózní bolus během 1 – 2 minut, ihned poté následuje 90 mg v intravenózní infúzi s konstantní rychlostí během 2 hodin až do maximální celkové dávky 100 mg. Při hemodynamickém zhroucení 0,6 mg/kg během 15 min (maximální dávka 50 mg).
- centrální mozková příhoda – 0,9 mg alteplasy/kg tělesné hmotnosti (max. 90 mg), léčba se zahajuje podáním 10 % celkové dávky ve formě počátečního intravenózního bolusu, ihned poté následuje podání zbytku celkové dávky intravenózní infúzí po dobu 60 minut.
- infarkt myokardu – nebudu uvádět pro širokou dostupnost PCI v ČR (blíže viz SPC).
Tenectepláza (METALYSE) – geneticky produkovaná varianta tPA, která je více fibrin specifická než tPA. Dle SPC schválena pouze pro trombolýzu při AIM. Dávkování viz SPC (nebudu uvádět pro širokou dostupnost PCI v ČR).
Retepláza (RAPILYSIN) – jednořetězcový rekombinantní derivát tPA, který neobsahuje finger domain a váže se proto na fibrin s menší aktivitou než tPA a má delší plazmatický poločas. Dávkování viz SPC.
Antitrombotická terapie u jednotlivých kardiovaskulárních onemocnění
NSTEMI (2020)
U každého pacienta je nutné úvodem stanovit riziko ischémie vs riziko krvácení. Poté:
- 1. Úvodem je nutné podat 250 mg ASA jako loading dose (LD) a poté pokračovat doživotně 100 mg denně.
- 2. Dále je vhodné podání blokátoru P2Y12 receptor pro ADP. Standardní je DAPT na 12 měsíců.
- Pokud budeme postupovat konzervativně (bez PCI – tedy nepravděpodobné), je indikován:
- T 180 mg LD, 90 mg 2x denně jako udržovací dávka.
- pokud není k dispozici T nebo je KI, tak C 300 – 600 mg LD, poté 75 mg 1x denně.
- Pokud je plánována časná PCI a neznáme koronární anatomii, nedoporučuje se rutinní předléčení (tedy podání před PCI). Tedy až po PCI je indikován:
- P 60 mg LD, poté 10 mg 1x denně (5 mg při věku > 75 let nebo hmotnosti < 65 kg).
- T 180 mg LD, 90 mg 2x denně jako udržovací dávka po dobu viz níže (standardně 12 měsíců).
- pokud není k dispozici T nebo je KI, tak C 300 – 600 mg LD, poté 75 mg 1x denně.
- Pokud budeme postupovat konzervativně (bez PCI – tedy nepravděpodobné), je indikován:
Délka trvání DAPT u pacientů bez fibrilace síní – záleží na riziku krvácení vs. trombózy:
- velmi vysoké riziko krvácení – ASA + C po dobu 1 měsíce, poté trvale C.
- vysoké riziko krvácení (= skóre PRECISE DAPT > 25) – A+C po dobu 3 měsíců (popř. 6 měsíců), poté trvale A.
- nízké riziko krvácení i trombózy – A+T po dobu 3 měsíců, poté T dlouhodobě.
- nízké riziko krvácení a vyšší riziko trombózy – A+T/P na 12 měsíců a poté buď pokračovat déle nebo A+R (2,5 mg 2 x denně) dlouhodobě u nejvyššího rizika.
- 3. Při trombotické komplikaci nebo no-reflow by měl být podán GPIIb/IIIa inhibitor.
- 4. Antikoagulační léčba – ve chvíli stanovení diagnózy NSTEMI by měla být spolu s antiagregační podána antikoagulační terapie. Antikoagulační terapie by měla být přerušena ihned po provedení PCI. Možnosti:
- UHF – bolus 70 – 100 IU/kg (není v plánu podání GPIIb/IIIa inhibitoru) nebo 50 – 70 IU/kg (je v plánu podání GPIIb/IIIa inhibitoru) pokud bude pacient podstupovat PCI, popř.
- pokud není plánován okamžitý transport k PCI je alternativou podání fondaparinux 2,5 mg. V tom případě je nutné podat bezprostředně před PCI bolus UHF, popř.
- v selektovaných případech může být UHF nahrazen bivalirudinem, popř.
- enoxaparin i.v., pokud byl pacient předléčen enoxaparinem s.c. Switch mezi enoxaparinem a UHF se nedoporučuje.
Mezi stavy vysokého trombotického rizika patří – komplexní ICHS a nejméně jedno za následujících: věk nemocného s IM < 45 let, multi vessel disease, diabetes mellitus, chronická renální insuficience, anamnéza recidivujícího IM, chronické zánětlivé onemocnění, např. RA, SLE (obecně řečeno tedy většina výrazných rizikových faktorů aterosklerózy). pro střední trombotické riziko platí: nekomplexní léze + většina předchozích rizikových faktorů. Dále lze jako vysoké trombotické riziko označit implantaci 3 a více stentů a celkovou délku stentů > 6 cm. Tedy hlavním kritériem určující, zda jde o vysoké nebo střední trombotické riziko je komplexnost léze a dále přítomnost MVD, rizikových faktorů aterosklerózy a implantaci 3 a více stentů a/nebo celkovou délku stentů > 6 cm.
- 4. Farmakoterapie ischémie – pokud není kontraindikace, je vhodné podání i.v. nitrátů a betablokátorů (pokud nejdou známky srdečního selhání). Při podezření na vazospazmy jsou místo beta blokátorů vhodné blokátory kaciového kanálu (BKK).
- 5. Podání orální antikoagulační terapie u pacientů s fibrilací síní a NSTEMI – záleží na riziku vzniku trombózy v.s. krvácení:
- pacienti bez zvýšeného rizika trombózy i krvácení – standardní je triple terapie po dobu 1 týdne (za hospitalizace), NOAC + SAPT (jeden antiagregační lék) 12 měsíců, poté trvale NOAC (týden – rok).
- pacienti se zvýšeným rizikem krvácení – viz výše, pouze se NOAC a SAPT zkrátí na 6 měsíců (týden – půl roku).
- pacienti se zvýšeným rizikem trombózy – viz výše, pouze se triple terapie prodlouží na 1 měsíc (měsíc – rok)
- pokud medikují pacienti warfarin (VKA), lze PCI provést bez přerušení léčby, pokud je INR < 2,5.
Chronické koronární syndromy (2019)
- ASA – po infarktu myokardu a/nebo revaskularizaci je základem je antiagregační léčba 100 mg acetylsalicylové kyseliny (ASA) denně, při intoleranci ASA 75 mg clopidogrelu (C) denně. C může být před A preferován u jedinci po TIA/CMP a s ICHDKK.
- u jednoznačně prokázané CAD může být zvažována ASA, na druhou stranu u pacientů s vysokým rizikem ischemických příhod (difuzní postižení koronárních tepen + nejméně jedno z následujících: medikamentózně léčený diabetes mellitus, recidivující AIM, onemocnění periferních tepen, CKD III-V) a bez vysokého rizika krvácení by mělo být zváženo přidání druhého antitrombotika k ASA (takto je to v gudielines – opět nutno použít zdravý rozum – při doslovné interpretaci nemusíme pacientovi s obstrukční CAD podat ASA).
- po PCI pro stabilní CAD jednoznačně trvale 100 mg ASA denně + C na 6 měsíců (na 3 měsíce při vysokém riziku krvácení, krajně na 1 měsíc při velmi vysokém riziku krvácení).
- PO AKS DAPT na 12 měsíců, při vysokém riziku krvácení 6 měsíců. Při velmi vysokém riziku nebo KI ASA lze individuálně zvážit prasugrel (P) nebo ticagrelor (T).
- Při současné fibrilaci síní je doporučeno upřednostnit NOAC před warfarinem (VKA) při CHA2DS2-VASc ≥ 1 u mužů a ≥ 2 u žen. Při současném vysokém riziku koronárních syndromů a nízkém riziku krvácení lze zvážit přidání ASA nebo C.
- Při současné fibrilaci síní a PCI je doporučena triple terapie ASA+C+OAC s následnou A/C + OAC (pokud je panuje obava z krvácení, lze redukovat rivoraxaban z 20 na 15 mg, dabigatran ze 150 na 110 mg). Pokud je riziko trombózy ve stentu nízké, lze při triple terapii vysadit ASA (podat OAC + C) již po cca týdnu, naopak, při vysokém riziku lze podávat triple terapii až 6 měsíců (délka podávání by měla být uvedena v propouštěcí zprávě z kardiocentra). Duální terapie OAC + T nebo P lze zvážit při nízkém nebo středním riziku trombózy ve stentu. Triple terapie s T nebo P se nedoporučuje.
- Při vysokém riziku lze i při sinusovém rytmu k ASA přidat rivaroxaban (2,5 mg 2x denně) na základě studie COMPASS (snížení mortality o 23 %).
- Pokud panuje jakékoliv podezření na rizko krvácení při monoterapii, DAPT popř. podávání OAC, jsou indikovány PPI. CAVE Omeprazol (esomeprazol, lansoprazol) zeslabují účinek C – tato kombinace není vhodná.
- Pokud je pacient indikován k elektivnímu kardiochirurgickému výkonu, ASA se ponechá trvale v medikaci a je třeba prasugrel vysadit ≥ 7 dní před; clopidogrel ≥ 5 dní před; ticagrelor ≥ 3 dny před a rivaroxaban, apixaban, edoxaban a dabigatran 1 – 2 dny před výkonem. U nekardiálních výkonů a vysokém riziku krvácení (intrakraniální, TURP, nitrooční) může být i ASA riziková – toto musí posoudit multidisciplinární tým. Pokud věc snese odkladu, je vhodné odložit operaci na dobu optimálně 6 měsíců po PCI (v odůvodněných případech na 3 měsíce od PCI)