Krev je složitá tekutina, která je složená z krevních buněk a plazmy, která je složená z krevních buněk a plazmy:
Kostní dřeň a krvetvorba
Od 7. měsíce i.u. života zde probíhá krvetvorba. Lze ji rozdělit na:
- červená kostní dřeň, kde stále ještě probíhá krvetvorba. Je složena ze sítě retikulárního vaziva, makrofágů a širokých krevních vlásečnic. V okách vaziva jsou uloženy kmenové buňky. V dospělosti zůstává ve sternu, klíční kosti, obratlech, pánevních kostech a proximálních epifýzách dlouhých kosti.
- žlutá kostní dřeň, kde ustala krvetvorba a retikulární vazivo je rostlino tukem. Ve stáří se mění na šedou kostní dřeň, kde již není přítomen ani tuk.

V kostní dření dochází k diferenciaci kmenových buněk do různých buněčných linií v závislosti na specifickém cytokinovém prostředí.

I. Erytrocyty
Bezjaderné krevní elementy bikonkávního tvaru (průměr 8 µm), jejichž nejdůležitější součástí je hemoglobin. Jejich životnost je je cca 120 dnů a jsou odbourávány v RES (zejména slezině).
Jejich vývoj začíná v kmenové buňce, která se diferencuje do červené řady v proerytroblast, poté normoblast (bazofilní, polychromní a ortochromní), poté retikulocyt, který ztrácí své organely a stává se normoblastem.
Hlavním regulačním faktorem erytropoézy je tkáňová hypoxie, která brání hydroxylaci HIF-1α (hypoxia inducible factor 1α) a tím umožní stimulaci exprese genu pro erytropoetin, hlavní regulační hormon erytropoézy. Vzniká zejména v buňkách proximálního tubulu ledvin (méně v játrech). Poločas EPO v cirkulaci je 6 – 9 hodin a váže se na specifické receptory na povrchu progenitorových buněk a stimuluje jejich proliferaci (4 – 5 krát) a brání jejich apoptóze. Po vazbě na receptor přetrvává účinek EPO 1 – 2 týdny. Ke správné erytropoéze je nutný dostatek živin, zejména železa. Průměrný hematokrit muže je 47 %, ženy 42 %.
Faktory nutné k erytropoéze
Metabolismus železa
Ke správné hematopoéze je zcela zásadní dostatečný přísun železa do kostní dřeně. Hlavní rolí železa je být součástí hemoglobinu a umožnění tak transportu kyslíku do tkání, mimo to je i součástí myoglobinu a cytochromů.
Železo, které se vstřebá z potravy nebo uvolní ze starých erytrocytů se váže na transferin, který je jeho hlavní transportní protein (jedna molekula je schopna vázat dva atomy železa). Jeho poločas v cirkulaci je normálně 1 – 1,5 hodiny (při zvýšené krvetvorbě se může zkrátit na 10 – 15 minut, naopak při jejím útlumu se prodlužuje až na několik hodin). Komplex železo – transferin reaguje se specifickými transferinovými receptory na povrchu prekurzorů v kostní dřeni, poté je internalizován, železo je při nízkém pH v endozómu uvolněno a použito ke tvorbě hemoglobinu. Transferin je poté uvolněn zpět do oběhu a jeho receptory navráceny na povrch prekurzoru. Pokud je přítomen nadbytek železa, toto je navázáno na protein apoferitin a vzniká tak zásobní forma železa feritin. Na konci života erytrocytu dochází k určitým strukturním změnám povrchové membrány, na jejichž základě je starý erytrocyt v sinusech sleziny vychytáván a fagocytován. Globin je štěpen na aminokyseliny a železo je vystaveno na povrch makrofágu, kde se naváže na další transferin.
Dospělý muž za normálních okolností potřebuje 1 mg elementárního železa denně, dospělá žena 1,4 mg denně (při výrazně stimulované erytropoéze se tato potřeba může zvýšit 6 – 8x). Fyziologicky se resorbuje 7 – 10 % přijatého železa, toto se může zvýšit až na 25 % při jeho zvýšené potřebě. Dospělý člověk tedy potřebuje ve stravě příjmout cca 10 mg železa, mladé menstruující ženy cca 18 mg denně a těhotné ženy 20 – 25 mg denně. Pokud není tato potřeba uspokojena, nejdříve se snižují zásoby železa v organismu (RES, feritin), po jejich vyčerpání dochází ke zpomalení syntézy hemoglobinu se vznikem malých krvinek (mikrocytární, hypochromní anémie). Právě ztrátou železa se projevuje chronické krvácení.
1 ml erytrocytů (při normálním hematokritu tedy cca 2 ml krve) = 1 mg železa.
Železo se nejvíce vstřebává z potravy v duodenu a proximálním jejunu. V kartáčovém lemu je nejdříve redukován na Fe2+pomocí feroreduktázy, následně je pomocí symportu s Na+ (DMT-1) transportován do enterocytu, kde může byt ve formě feritinu uloženo nebo nebo pomocí feroportinu (jeho aktivita je inhibována hepcidinem) uvolněno na bazolaterální straně a zde opět oxidováno hefestinem.

Metabolismus vitamínu B12 a folátu
Folát se do těla dostáva nejčastěji ve formě pteroylpolyglutamátu, od kterého je nutné odštěpit přebytečné glutamáty hydrolázou a ve formě pteroylmonoglutamátu je poté vstřebávám pomocí nosiče v proximálních částech tenkého střeva. V enterocytech vzniká metyltetrahydrofolát, který je transformován na tetrahydrofolát, který je několika kroky přeměněn na deoxythymidilát nutný k syntéze DNA a dihydrofolát, který je poté recyklován na tetrahydrofolát. Zásoba folátu v organismu stačí na 2- 4 měsíce.
Vitamín B12 člověk přijímá potravou (zejména živočišná strava, žloutek a mléčné výrobky), jeho doporučená dávka je 3 µg denně. V žaludku vytváří komplex s vnitřním faktorem, který je zásadní pro jeho resorpci. Komplex B12 – vnitřní faktor se v distálním ileu váže na specifický receptor (cubilin) a tento komplex pak vstupuje do enterocytu. 75–80 % se váže na transkobalamin III a putuje do hepatocytů, do buněk dalších orgánů vstupuje pouze vitamín B12 navázaný na transkobalamin II, kde se kobalamin přeměňuje na aktivní metabolity metylkobalamin a adenosylkobalamin, které slouží jako kofaktory enzymů. Funkce:
- krvetvorba
- vývoj centrální nervové soustavy v dětském věku
- kofaktor dvou metabolických reakcí
- přeměny homocysteinu na methionin pomocí (porucha této reakce vede ke hromadění homocysteinu);
- přeměny methylmalonyl-CoA na sukcinyl-CoA působením (porucha této reakce vede ke hromadění kyseliny methylmalonové a jejímu zvýšenému vylučování močí).
Nedostatek vitamínu B12 a folátu působí zpomalení buněčného cyklu a hemopoézy, zatímco syntéza hemu funguje dále. Vznikají tak velké krvinky (makrocyty), které mají zkrácenou dobu přežívání.

Struktura erytrocytů
Červené krvinky se skládají ze tří hlavních složek:
1. Hemoglobin – krevní barvivo, které je zásadní pro transport kyslíku krví. Každý hemoglobin je složen ze dvou párů globinových řetězců (helikální sekundární a velmi složitá terciální struktura), které obklopují protoporfyrinový kruh s centrálním atomem Fe2+. Hemoglobinový tetramer je vysoce rozpustný, ale jednotlivé řetězce jsou sami o sobě nerozpustné, mohou precipitovat s indukcí apoptózy erytrocytu. Alfa řetězec je kódován na chromozómu 16, beta na chromozómů 11.
V 6. týdnu gravidity se objevují embryonální typy hemoglobinů Portland (ζ2γ2), Gower I (ζ2ε2) a Gower II (α2ε2). V 10. týdnu se stává dominantní fetální hemoglobin HbF (α2γ2), v 38 týdnů se mění na téměř výhradní produkci HbA (α2β2) a minimální zastoupení HbA2 (α2δ2). I během postnatálního života je produkováno malé množství HbF, které se zvyšuje při větších nárocích na hematopoézou (těžká hemolytické anémie, st. p. transplantaci kostní dřeně, chemoterapie apod.).
Při nízkých hladinách kyslíku je hemoglobin plně deoxygenován, při nárůstu jeho hladiny se hemoglobin začne pomalu oxygenovat, při dalším zvyšování se rychlost oxygenace zvyšuje a následně zase zpomaluje (křivka má tvar S). Tato oxygenace je ovlivněna několika faktory:
- Bohrův efekt – hemoglobin je schopen v kyselém prostředí (hypoxie, zánět) doručit více kyslíku (H+ ionty stabilizují a snadněji se vážou na deoxygenovaný hemoglobin, než na oxygenovaný, který je slabou kyselinou).
- 2,3-bisfosfoglycerát – při vazbě na hemoglobin snižuje jeho afinitu ke kyslíku a zlepšuje tak přísun kyslíku do tkání (posun disociační křivky doprava).

2. Membránový cytoskeletový komplex – cytoplazmatická membrána je složena z lipidové dvojvrstvy z fosfolipidů a cholesterolu, do které jsou inkorporovány membránové proteiny, jejichž domény zasahují jak mimo buňku (extracelulární domény), tak do cytoplazmy (intracelulární domény). Některé jsou uchyceny glykosylfosfatidilinozitolovou (GPI) kotvou, tyto mají pouze extracelulární domény (iontové kanály, receptory pro komplement a receptory pro ligandy). Nejhojněji zastoupené jsou glykoforiny, tzv. band 3 proteiny. U mnoha z těchto proteinů jsou jejich extracelulární domény velmi silně glykosylované a nesou antigenní determinanty odpovídající krevní skupině. Pod cytoplazmatickou membránou se nachází cytoskelet, jehož hlavním proteinem je spektrin (dimer složený z α- a β-spektrinu). Membrána je s cytoskeletem propojena spojovacími proteiny, zejména ankyrinem, band 4.1 a band 4.2 proteiny.

3. Metabolický komplex – jediným zdroje energie a ATP je anaerobní glykolýza, 5 % glukózy je spotřebováno pentosafosfátovou dráhou, při které vzniká NADPH+. To je koenzymem glutathionreduktázy, enzymu nezbytného pro vznik redukovaného glutathionu, který chrání erytrocyty před oxidativním stresem. Vrozené defekty glutahionového metabolismu jsou vzácné a všechny vedou k chronické hemolýze.


II. Trombocyty a hemostáza
Bezjaderné krevní elementy o průměru 2–4 μm, které mají zásadní roli v hemostáze. Jejich normální koncentrace v krvi je 150 – 300 ×109/l. Cca 2/3 trombocytů se nachází v krvi, 1/3 je ve slezině (je to podíl se zvětšuje s velikostí sleziny). Obsahují mitochondrie (tvorba ATP a ADP) a rezidua Golgiho aparátu a endoplazmatického retikula (zásobárna vápenatých iontů). Cytoplazma obsahuje aktin a myozin (konstrikce destiček má význam pro uvolnění obsahu granul). V trombocytech jsou přítomný 3 typy granul:
- alfa granula obsahují von Willebrandův faktor (vWF), destičkový faktor 4, PDGF, fibrinogen, faktor V.
- denzní granula obsahují ADP, ATP, Ca2+, serotonin,
- lyzozomy obsahují lyzozomální enzymy.
Megakaryoblasty v kostní dřeni se transformují na megakaryocyty, jejichž cytoplazma se rozpadá na jednotlivé trombocyty (tedy jsou pouhé fragmenty cytoplazmy megakaryocytů). Trombocyty přežívají v krvi po dobu 7 až 10 dnů a následně zanikají pohlcením endotelem cév.
Produkce trombocytů je regulována trombopoetin, který je tvořen játrech (jeho tvorba je stimulována zánětem, zejména IL-6), a který se váže na své receptory na megakaryocytech. Zásadním krokem je aktivace trombocytů:
- Při poranění endotelu se obnaží subendotelová vlákna kolagenu, na které destičky se trombocyty navážou za pomoci vWF (velký multimerní protein který je přítomen v plazmě i v subendoteliální části cévní stěny). Přitom se uplatňuje jako receptor glykoproteinový komplex Ib/IX na membráně trombocytů.
- Adheze destičky aktivuje a začnou secernovat látky, které podporují adhezi dalších destiček (von Wilebrandův faktor), vazokonstrikci, čímž zpomalí tok krve a způsobí další adhezi (serotonin, PDGF, TxA2) a látky, které zesilují funkci destiček (ADP, PAF, TxA2).
- Aktivované destičky mění svůj tvar na kuličky s pseudopodiemi, které se navzájem proplétají a shlukují se.
- Tuto agregaci podporuje trombin a stabilizují glykoproteiny IIb/IIIa, které jsou změnou tvaru exponovány na povrchu destiček.
- Na ně se naváže fibrinogen, který spojí destičky navzájem. IIb/IIIa zesiluje adhezi i tím, že umožňuje připojení trombocytů na subendoteliální fibronektin.

Koagulační faktory – účastní se hemostázy, kromě Ca2+ jsou to proteiny syntezované v játrech, pro tvorbu některých je důležitý vitamin K (kofaktor posttranslační γ-karboxylace N terminálních glutamátových zbytků těchto faktorů, které jsou silné vazače Ca2+ a jsou potřebné k vazbě faktorů na povrch fosfolipidů, především na membránu trombocytů). Přidání citrátových nebo oxalátových iontů nebo EDTA vyváže Ca2+ a tím zabrání srážení krve.

Aktivace koagulace – většina koagulačních faktorů je normálně v neaktivní podobě (= zymogeny), jejich aktivace probíhá v kaskádě a působí navzájem amplifikačně. bHemokoagulace může odstartovat
- – endogenně (uvnitř cévy)
- exogenně (zvenku)
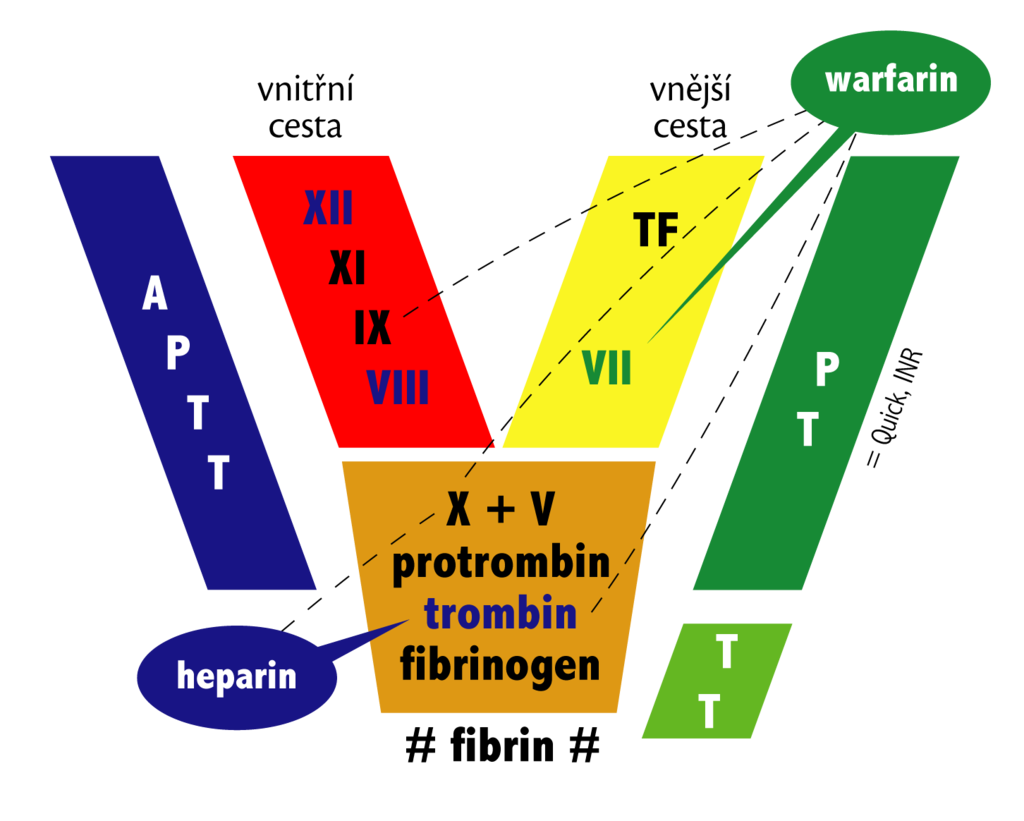
Vnitřní systém – začíná v místě defektu endotelu kontaktní aktivaci XII → XIIa, který aktivuje prekalikrein → kalikrein, který zpětně zesiluje aktivaci XII. XIIa aktivuje XI → XIa, ten IX → IXa, ten VIII → VIIIa, který spolu s Ca2+ a fosfolipidy aktivuje X → Xa. (…12→11→9→8→10)
Vnější systém – při větších zraněních přichází s krví do styku tzv. tkáňová trombokináza – III, která aktivuje VII → VIIa, který spolu s Ca2+ a fosfolipidy aktivuje X → Xa. (…3→7→10)
Společná cesta a tvorba fibrinu – Xa aktivuje V → Va. Va + Xa + Ca2+ + fosfolipidy = protrombináza, která odštěpením N terminálního konce aktivuje II (protrombin) → IIa (trombin), který aktivuje fibrinogen →fibrin. XIII →fibrin stabilizující XIIIa. Mimo jiné V, VIII, XI (pozitivní zpětná vazba). Jednotlivá fibrinová vlákna (monomery) polymerizují na solubilní fibrin, který je stabilizován faktorem XIIIa na nesolubilní fibrin (spojí postranní řetězce fibrinových vláken kovalentními vazbami).(…10→5→2→fibrin→13)

Fibrinolýza – fibrin je rozpouštěn plazminem, který vzniká z plazminogenu, který je aktivován faktory v krvi (kalikrein, XIIa), tkáni (tissue plasminogen activator – tPA) a moči (urokináza). Produkty štěpení fibrinu (fibrinogeny) tlumí tvorbu trombinu a polymerizaci fibrinu (fibrinolýza není komplikována další trombózou). Nadměrné nebo předčasné fibrinolýze fyziologicky zabraňuje α2 – antiplazmin.

Inhibice koagulace
- antitrombin III – v plazmě, chrání před trombózou. Tvoří s trombinem a faktory IXa, Xa, XIIa komplex a tím tlumí jejich aktivitu. Toto zesiluje heparin.
- Další ochranou je vazba trombinu na trombomodulin endotelu.
- Trombin aktivuje protein C → protein Ca, který v komplexu s proteinem S inaktivuje faktor Va a VIIIa. Syntéza proteinu C a proteinu S je vitamin K dependentní.
- Trombin je také inhibován α2-makroglobulinem a α1-antitrypsinem.
- V endotelu se tvoří inhibitor tkáňového tromboplastinu, který tlumí vnější systém.

Vyšetřovací metody koagulace v hematologii – anamnéza – RA – např. hemofilie, von Willebrandova choroba, vrozené trombocytopatie. Pro trombocytopatii je typické protrahované krvácení po poranění, spontánní tvorba petechií, zvýšená tvorba hematomů. Nutné pátrat po protrahovaném krvácení např. při extrakci zubu, úrazu, u žen při menstruaci či porodu. Dále abusus NSAID, cytostatik, imunosupresiv apod. Dále při podezření na trombofilní stav pátrat po anamnéze trombóz nebo recidivujích abortů. Fyzikální vyšetření – krvácivé projevy na kůži, zvětšené mízní uzliny, hepatomegalie, splenomegalie (vylučujeme hematologické malignity).
Laboratorní vyšetření několik úrovní:

- rutinní vyšetření
- aPTT (faktory XII, XI, IX, VIII, 26 – 40 s). T\est vnitřní a společné cesty hemokoagulace. Za přítomnosti vápníku zahajuje parciální tromboplastin spuštění vnitřního koagulačního systému.
- protrombinový čas (faktory II, V, VII, X, fibrinogen, 12 – 15 s, INR 0,8 – 1,2). Test vnější a společné cesty. Udává rychlost přeměny protrombinu na trombin v důsledku působení tkáňového tromboplastinu (koagulační faktor III).
- počet trombocytů (150 – 450 x 109/l krve)
- při podezření na krvácivý stav
- trombinový čas – zjišťuje délku tvorby fibrinu z fibrinogenu (norma 17 – 24 s).
- fibrinogen – norma 2 – 4 g/l
- FDP – štěpné produkty fibrinu a fibrinogenu plazminem (D-dimery).
- vyšetření fibrinolytického systému
- plasminogen
- tkáňový aktivátor plasminu (t-PA)
- inhibitory aktivátoru plasminu (PAI-1, PAI-2)
- plasmin – antiplasminový komplex (PAP)
- inhibitoru fibrinlýzy aktivovatelného plasminem (TAFI)
- vyšetření inhibitorů hemostázy
- protein C
- protein S
- TFPI – inhibitoru zevního systému koagulace
- antitrombin III
- vyšetření genu pro faktor V a protrombin