Sodík a voda
Složení tělesných tekutin
Lidské tělo je složeno z 50 % vody u žen a 60 % u mužů. Ta je rozdělena do několika kompartmentů:
- Intracelulární tekutina (ICT, 55 – 75 % celkové vody).
- Extracelulární tekutina (ECT, 25 – 45 % celkové vody), ta je rozdělena na intravaskulární (IVT) a intersticiální (IST) vodu v poměru 1:3. Oba tyto kompartmenty jsou odděleny kapilární stěnou a pohyb vody mezi nimi je řízen Starlingovými silami (hydrostatický a onkotický tlak).
Osmolalita
Jako osmolalita se označuje koncentrace částic v tekutině a je vyjadřována v miliosmolech na kilogram vody (mOsm/kg). Voda volně difunduje přes plazmatickou membránu se snahou dosažení osmotické rovnováhy (osmolalita ICT = osmolalita ECT). Soluty většinou přes membrány volně nedifundují, ale využívají různé kanály a transportéry. Hlavními soluty ECT jsou Na+, Cl– a HCO3–, v případě ICT to jsou K+ a organické estery fosfátů (ATP, kreatin fosfát a fosfolipidy). Soluty, které nemohou přes membránu volně procházet a jsou tak „uzavřeny“ v daném kompartmentu vytvářejí efektivní osmolalitu. Jiné soluty (např. urea) se nepodílí na ovlivnění proudění vody přes membránu a označují se tak jako inefektivní soluty. Na udržení normální osmolality 280 – 295 mOsm/kg se podílí antidiuretický hormon, příjem čisté vody a vylučování vody a solutů ledvinami.
Antidiuretický hormon
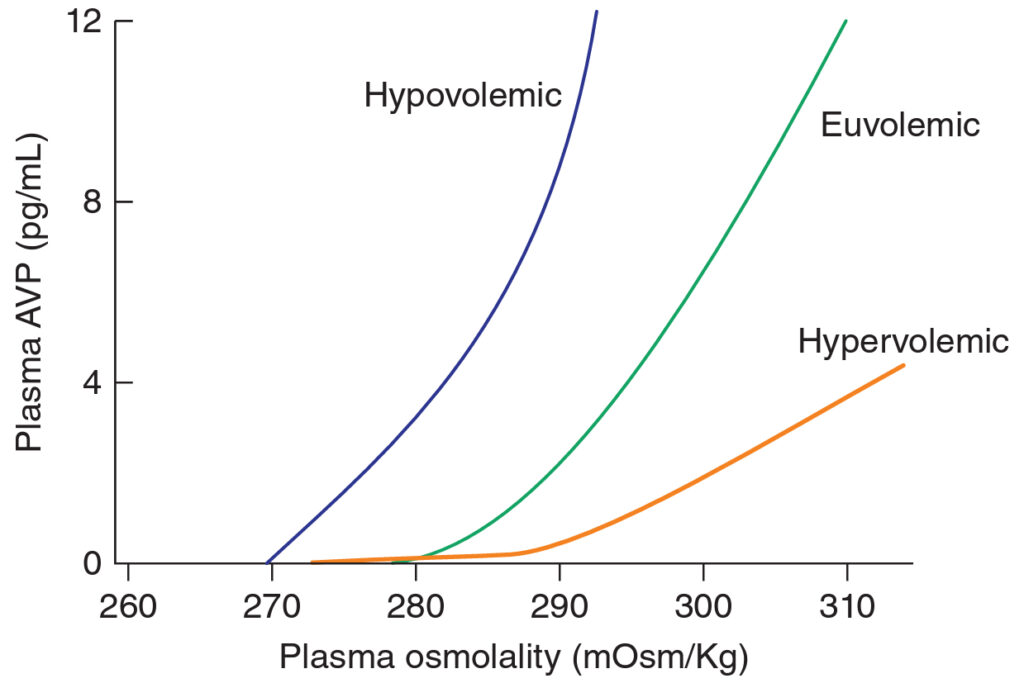
Antidiuretický hormon (ADH, vazopresin) je syntetizován v magnocelulárních neuronech hypotalamu, jejichž distální vlákna končí v neurohypofýze, kde je ADH skladován a odkud je uvolňován do oběhu. Osmoreceptory hypotalamu jsou aktivovány, uvolňují ADH a indukují pocit žízně při zvýšení osmolality krve nad 285 mOsm/kg. Nad touto hranicí je vztah mezi osmolalitou a koncentrací ADH v cirkulaci lineární. Dalším stimulem (slabším než osmolalita) k uvolnění ADH je snížení efektivního cirkulujícího objemu. Výsledkem je, že při hypovolémii dochází k uvolňování ADH již při nižší osmolalitě a křivka koncentrace ADH-osmolalita je strmější. Při hypervolémii dochází k opačné situaci. Organismus umí na změny efektivního cirkulujícího volumu a osmolality rychle reagovat, protože poločas ADH v cirkulaci je pouze 10 – 20 minut. Na základě působení ADH jsou ledviny schopny produkovat vysoce hyperosmolární moč o osmolalitě až 1200 mOsm/l. Naopak, při absenci ADH (diabetes inspidus) je vylučováno velké množství hypoosmolání moči o osmolalitě 50 mOsm/l. K uvolnění ADH vede i řada jiných „neosmotických“ stimulů, např. nauzea, intracerebrální angiotenzin II, serotonin a řada léků.
Hlavním místem účinku ADH je tlustá část vzestupného raménka Henleovy kličky, distální tubulus a hlavní buňky sběracích kanálků, kde se váže na V2 receptory s následnou aktivací cAMP, proteinkinázy A a fosforylací řady transportních proteinů:
- aktivace Na+/Cl– transportéru a K+ kanálu tlusté část vzestupného raménka Henleovy kličky vede k hyperosmolaritě dřeně ledvin, která je základní podmínkou vzniku protiproudového mechanismu. Transport urey dále renální osmotický gradient zvyšuje.
- aktivace akvaporinů 2 a jejich inzerce do plazmatické membrány hlavních buněk sběracích kanálků vede ke zvýšení reabsorpce vody na základě osmotického gradientu.
Voda přechází přes akvaporin 1 v sestupné části Henelovy kličky a podílí se tak na pasivním transportu Na+a Cl–. Transport urey se podílí na vzniku hypertonického intersticia a zvyšuje osmotický gradient.

Po vazbě ADH na receptor se cestou aktivace cAMP a proteinkinázy A zvyšuje fosforylace akvaporinu 2 a jeho umístění na povrch hlavních buněk sběrných kanálků, která se stává propustná pro vodu a a zvyšuje se zde její resorpce:
- při zvýšení hladiny ADH dochází ke zvýšení resorpce vody a vyloučení malého množství hypertonické moči (osmolalita > 1200 mOsm/l).
- při snížení hladiny ADH se snižuje resorpce vody a vylučuje se větší množství hypotonické moči (osmolalita pouze 50 mOsm/l).

Udržení integrity arteriálního oběhu
Vzhledem k tomu, že 85 – 90 % všech Na+ iontů se nachází extracelulárně, je množství extracelulární tekutiny (jedna z determinant efektivního cirkulujícího volumu) funkcí celkového množství Na+ v organismu. Na+ je filtrován v glomerulech a následně reabsorbován v ledvinných tubulech, typicky spolu s Cl–, proto se i tento aniont podílí na homeostáze extracelulární tekutiny. Celková hodnota glomerulární filtrace je 180 litrů/den a při natrémii 140 mmol/l tedy ledviny přefiltrují 25200 mmol Na+ denně, z toho se zpět resorbuje 25100 mmol a pouze 100 mmol Na+ (99,6 %) přechází do definitivní moči. V jednotlivých oddílech nefronu se Na+ reabsorbuje odlišně, ve všech oddílech je bazocelulárně přítomna Na+ K+ ATPáza:
- 67 % v proximálním tubulu paracelulárně i transcelulárně (v luminální membráně symport s glukózou a aminokyselinami a antiport s H+, bazocelulárně symport s HCO3–).
- 25 % v Henleově kličce paracelulárně i transcelulárně (ve vzestupné části je furosemid senzitivní Na+ K+ 2Cl– symport a antiport s H+, bazocelulárně i antiport Cl–/HCO3–).
- 5 % v distálním tubulu transcelulárně (v luminální membráně je Na+ Cl– symport citlivý na thiazidy).
- 3 % ve sběracím kanálku transcelulárně (v luminální membráně je epitelový kanál ENaC citlivý na amilorid). Cl– jsou reabsorbovány ve vmezeřených buňkách na luminální membráně přes antiporty Cl–/HCO3– a Cl–/OH–.

Regulace tubulární reabsorbce Na+ a Cl–:
- v proximálním tubulu ji zvyšuje angiotenzin II a sympatikus, snižuje dopamin.
- v distálním tubulu ji zvyšuje aldosteron (aktivace ENaC hlavních buněk → zvýšení sekrece K+).
Zachování dostatečné volémie je zásadní pro zachování perfúze životně důležitých orgánů. Při hypovolémii se aktivují volumo- a baroreceptory, což vede k neurohumorální aktivaci – sympatiku, RAAS, ADH. Následkem je synergické zvýšení reabsorpce Na+, Cl– i vody a nárůst vaskulární rezistence. Podobná situace se děje i při poklesu srdečního výdeje při srdečním selhání, hypovolémii, snížení onkotického tlaku, zvýšení kapilární permeability nebo excesivní vazodilataci.
Hypovolémie
Etiologie – nejčastěji kombinovanou ztrátou soli a vody, z následujících příčin:
I. Renální příčiny hypovolémie
- 1. Osmotická diuréza – hyperfiltrace endogenních (urea, glukóza) nebo exogenních solutů (manitol) vede k postižení resorpce Na+, Cl– i vody.
- 2. Endokrinologické choroby – deficit nebo rezistence k mineralokortikoidům.
- 3. Vrozené choroby tubulů – Bartterův syndrom a Gittelmannův syndrom.
- 4. Získané choroby tubulů a intersticia – k poruše resorpce Na+, Cl– a vody v distálním nefronu dochází i při akutní a chronické TIN, akutním tubulárním poškození nebo obstrukční uropatii.
- 5. Léky – dle specifického účinku v nefronu:
- proximální tubulus – acetazolamid inhibuje karboanhydrázu a sekundárně resorpci Na+ a Cl–.
- Henleova klička – furosemid inhibuje Na+ K+ 2Cl– symport.
- distální tubulus – thiazidy inhibují Na+ Cl– symport.
- sběrný kanálek – amilorid, trimetoprim a pentamidin inhibují ENaC.
- 6. Zvýšená ztráta čisté vody – méně závažné důsledky než při kombinované ztrátě vody a iontů, protože intravaskulární voda se v tomto případě může doplňovat přesunem z IST nebo ICT. Příkladem je centrální nebo nefrogenní diabetes inspidus.
II. Extrarenální příčiny hypovolémie – průměrný normální příjem tekutin je: 2100 ml potravou, 200 ml voda produkovaná metabolismem. Výdej tekutiny má více složek: 1400 ml moč, 700 ml perspiratio insensibilis (neměřitelné ztráty) plícemi (350 ml) a kůží (350 ml), perspiratio sensibilis potem (100 ml), stolicí (100 ml).
- 1. Ztráty gastrointestinálním traktem – do GIT denně vstupuje cca 9 litrů tekutiny (2 litry potravou a 7 litrů je vylučováno do lumina). V trávicí trubici je absorbováno 98 % vody, stolicí se tedy ztrácí cca 100 – 200 ml. Porucha resorpce vody na jakékoliv úrovni může způsobit nejen hypovolémii, ale i poruchu acidobazické rovnováhy:
- tekutina žaludku je kyselá (nízké pH), její ztráta (zvracení, odsávání ze žaludku) působí metabolickou alkalózu.
- pankreatické šťávy, žluč a střevní sekrece jsou alkalické (vysoké pH), jejich ztráty působí metabolickou acidózu.
- 2. Zvýšení perspiratio insensibilis – ke zvýšení kožní i plicní evaporace dochází při zvýšení teploty organismu (horečka, přehřátí organismu). Evaporace plícemi roste při hyperventilaci (pacienti ventilovaní suchým vzduchem).
- 3. Zvýšení perspiratio sensibilis – při nadměrné námaze se zvýšeným pocením (pot je většinou hypotonický) bez adekvátní úhrady ztrát dochází k hypertonické hypovolémii.
- 4. Hromadění tekutiny ve „třetím prostoru“ – k úniku intravaskulární tekutiny do intersticia dochází při poklesu onkotického tlaku (hypoalbuminémie) a/nebo zvýšení permeability cévní stěny (sepse, těžké popáleniny, akutní pankreatitida), do trávící trubice uniká tekutina při mechanickém nebo paralytickém ileu.
- 5. Krvácení – základní příčina hypovolémie. Krvácení může být vnitřní (do retroperitonea, břišní dutiny, hrudníku, mediastina…) nebo zevní.
Klinický obraz – příznaky hypovolémie jsou nespecifické. Patří sem únava, slabost, žízeň, posturální hypotenze, při těžších formách oligurie, cyanóza, bolesti břicha a hrudníku, kvantitativní a kvalitativní poruchy vědomí.
Při fyzikálním vyšetření jsou přítomny oschlá sliznice dutiny ústní, snížený kožní turgor, ortostatická tachykardie (vzestup TF > 15´ při postavení), ortostatická hypotenze (pokles TK > 15 mm Hg při postavení) a pokles centrálního žilního tlaku. Při těžké hypovolémii dochází k hypovolemickému šoku s hypotenzí a zvýšením periferní cévní rezistence (oligurie, chladná a cyanotická akra, poruchy vědomí).
Diagnostika
1. Biochemické vyšetření krve
- Urea, kreatinin – jsou zvýšeny v důsledku snížení glomerulární filtrace. Koncentrace kreatininu je specifičtější, protože hladina urey může být zvýšena nárůstem její tubulární reabsorpce (prerenální azotémie) nebo syntézy při hyperalimentaci nebo katabolismu. K poklesu syntézy urey dochází při snížení příjmu proteinů. Redukce glomerulární filtrace a koncentrace Na+ v distálním tubulu může vést ke snížení exkrece K+ a hyperkalémii.
- Při hypovolemickém šoku bývají zvýšeny markery jaterního a srdečního poškození a poruchy acidobazické rovnováhy (např. ztráty žaludeční tekutiny vedou k metabolické alkalóze a zvýšená tvorba laktátu k metabolické acidóze).
2. Biochemické vyšetření moče
- Odpad Na+ do moče – u jednotlivých příčin hypovolémie se liší:
- snížení (< 20 mmol/l) – hypovolémie stimuluje renální resorpci Na+ a vody. Při poklesu GF a současné nízké koncentraci Na+ v distálním tubulu (většina Na+ se resorbuje již v proximálnějších částech nefronu), chybí motor pro exkreci K+ s rizikem vzniku hyperkalémie.
- při nerenálních ztrátách je důsledkem snížení koncentrace Na+ v moči a zvýšení její osmolality (> 450 mOsm/l).
- při současné hypochloremické alkalóze (hypovolémie při zvracení, odsávání žaludeční šťávy, průjem, diuretika) dochází ke kompenzatornímu vylučování HCO3– s vyšším pH moče (> 7,0) a tím i koncentrace Na+, která se tímto normalizuje (> 20 mOsm/l). V těchto případech je přesnějším indikátorem močová koncentrace Cl–. Naopak,
- při diabetes inspidus dochází k vylučování velmi naředěné moči (koncentrace Na+ v moči je snížená, ale celkové Na+ vyloučené do moči je normální).
- normální (> 20 mmol/l) bývá při renálních příčinách hypovolémie (např. akutní tubulární poškození).
- snížení (< 20 mmol/l) – hypovolémie stimuluje renální resorpci Na+ a vody. Při poklesu GF a současné nízké koncentraci Na+ v distálním tubulu (většina Na+ se resorbuje již v proximálnějších částech nefronu), chybí motor pro exkreci K+ s rizikem vzniku hyperkalémie.
Terapie – hlavními cíli léčby je náhrada tekutin a zabránění jejich dalších ztrát. Koloidní roztoky nejsou vhodné, protože „nasávají“ vodu z intersticia, kde působí intracelulární dehydrataci. V lehkých případech postačuje perorální rehydratace, v těžších je nutné intravenózní podání:
- fyziologického roztoku při normo- nebo hyponatremické hypovolémii.
- 5 % glukózy při diabetes inspidus (hypernatremická hypovolémie při ztrátě čisté vody).
- polovičního fyziologického roztoku (0,45 %) při hypernatremická hypovolémie (současné ztráty čisté vody i soli).
- bikarbonátu při jeho ztrátě a metabolické acidóze (např. při průjmu).
- krevní transfúze při krvácení.
Hyponatrémie
Definována jako pokles Na+ v krvi < 135 mmol/l. Vyskytuje se u cca 22 % hospitalizovaných pacientů. Základním pravidlem je uvědomit si, že samotná koncentrace Na+ v krvi nic neříká o celkovém množství Na+ v organismu a vždy je nutné současně zohlednit celkový volumový status (u jednotlivých typů hyponatrémie se liší i patofyziologie vzniku poruchy). Nejčastější příčinou je zvýšení hladiny ADH nebo citlivosti na něj.
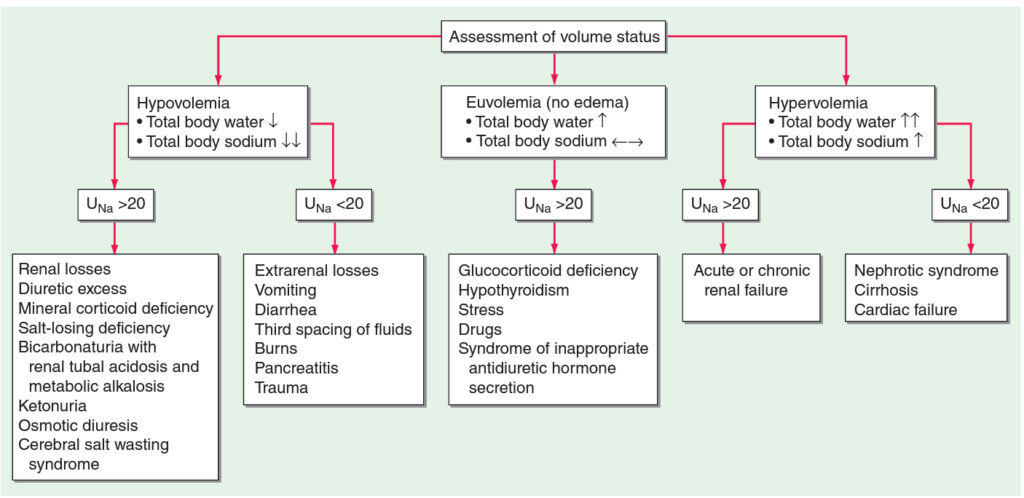
Etiologie a klasifikace
Hypovolemická hyponatrémie
Hypovolémie → ↑ ADH → ↑ resorpce vody v distálním nefronu → diluce. Příčiny:
I. Extrarenální příčiny – tito pacienti se často jeví jako euvolemičtí, hypovolémii lze prokázat pouze nízkým odpadem Na+ do moči (< 20 mmol/l):
- Ztráty gastrointestinálním traktem – zvracení, odsávání nazogastrickou sondou (CAVE zde může být exkrece Na+ v normě – viz výše), průjem.
- Ostatní extrarenální ztráty – zvýšení perspiratio insensibilis (plícemi a kůží) a následné hrazení ztrát hypotonickými roztoky.
II. Renální příčiny – dochází k nadměrným ztrátám Na+ a Cl– ledvinami s následnou volumovou deplecí a opět zvýšením vylučování ADH. Koncentrace Na+ v moči bývá normální (> 20 mmol/l).
- Primární adrenální insuficience – při deficitu glukokortikoidů i mineralokortikoidů, vzniká hypovolémie, hyponatrémie, hyperkalémie.
- „Sůl ztrácející“ nefropatie – poškození tubulárních funkcí a současné neadekvátní hrazení soli vede k hyponatrémii. Nejčastější příčinou je refluxová nefropatie, tubulointersticiální nefritidy, postobstrukční uropatie, houbovitá ledvina a zotavovací fáze akutní tubulární nekrózy.
- Léky – zejména diuretika – thiazidy působí natriurézu (inhibice Na+ Cl– symportu v distálním tubulu) a volumovou depleci s uvolněním ADH a polydipsií. Zároveň neinhibují koncentrační schopnost ledvin, proto je ztracený objem nahrazován pouze čistou vodou, furosemid je spojen s hyponatrémií vzácněji, protože inhibice Na+ K+ 2Cl– symportu ve vzestupném raménku Henleovy kličky zároveň inhibuje protiproudový systém a tedy i koncentrační schopnost ledviny.
- Osmotická diuréza – vede k hypovolémii, uvolnění ADH a hyponatrémii. Působí ji např. glykosurie (diabetes mellitus) nebo bikarbonáturie (renální tubulární acidóza nebo metabolická alkalóza, kdy ztráty HCO3– jsou spojeny se ztrátami Na+).
- CSWS (cerebral salt wasting syndrome) – vzácná jednotka spojená s intrakraniálním postižením (krvácení, tumor, trauma, encefalitida meningitida). Neadekvátní vylučování Na+ spojené s hypovolémií a následnou hyponatrémií. CAVE Zásadní je odlišení od SIADH, protože (na rozdíl od něj) pacienti s CSWS dobře reagují na agresivní substituci soli.
Hypervolemická hyponatrémie
Způsobena vyšším celkovým množstvím Na+ a Cl– v organismu, které je provázeno proporcionálně ještě větším množstvím celkové vody. Jinými slovy, velké množství Na+ je naředěno ještě větším množstvím vody. Příčiny:
- Na+ v moči > 20 mmol/l – akutní a chronické selhání ledvin
- Na+ v moči < 20 mmol/l – patofyziologie vzniku je podobná hypovolemické hyponatrémii, ale efektivní cirkulující volum klesá odlišnými mechanismy (snížený srdeční výdej při srdeční dysfunkci, periferní vazodilatace při jaterní cirhóze). Na+ v moči je typicky velmi nízké (< 10 mmol/l) a to i přes zvýšený příjem soli, natrémie je totiž nepřímo úměrná stupni neurohumorální aktivace, která bývá u těchto chorob značná. Retence sodíku působí navíc otoky. Nejčastějšími příčinami jsou nefrotický syndrom, srdeční selhání, jaterní cirhóza.
Euvolemická hyponatrémie
Deficit sodíku i celkové vody je proporcionální. Příčiny:
1. Hypotyreóza – zejména u těžších deficitů, natrémie se upravuje při hormonální substituci.
2. Sekundární adrenální insuficience – na rozdíl od primární poruchy, při sekundární adrenální insuficienci (poruchy hypotalamu nebo hypopituitarismus) dominuje deficit glukokortikoidů. Kortizol inhibuje uvolnění ADH, substituce glukokortikoidů tedy jeho hladinu rychle normalizuje. Koncentrace mineralokortikoidů bývá normální nebo pouze lehce snížená a volémie je tak normální.
3. SIADH
Definice – Vyvolán patologicky vysokou hladinou sekrecí ADH nejrůznější etiologie. Nejčastější příčina euvolemické hyponatrémie (přísně vzato jsou pacienti mírně hypervolemičtí, protože dochází k retenci volné vody i Na+ a Cl–).
Etiologie – mezi základní příčiny SIADH patří:
- Plicní choroby
- Choroby centrálního nervového systému
- Tumory (paraneoplastický je v 75 % případů odpovědný malobuněčný karcinomem plic)
- Léky (nejčastěji SSRI):

Patofyziologie – hyponatrémie je způsobena neadekvátně vysokou resorpcí volné vody s následným poklesem sérové osmolality. K nižším hodnotám osmolality je posunut i pocit žízně.
SIADH lze rozdělit na čtyři patofyziologické formy: I. U cca 1/3 pacientů je přítomna neregulovaná, kolísavá sekrece ADH, která není závislá ani na osmolalitě, ani na hladině ADH v cirkulaci. II. Selhání suprese ADH při nízké osmolalitě, je zachován nárůst ADH při vysoké osmolalitě. III. Resetovaný osmostat s posunem křivky osmolalita/ADH směrem doleva. IV. Nedetekovatelné hladiny ADH v cirkulaci (pravděpodobně zvýšení funkční renální reabsorpce vody ledvinami nebo přítomnost antidiuretické substance, jiné než ADH). U některých těchto pacientů popsány hyperfunkční mutace V2 receptoru pro ADH.
Zvýšená reabsorpce vody i Na+ a Cl– v distálním nefronu inhibuje tubulární transport v proximálním tubululu, dochází tak ke zvýšenému vylučování kyseliny močové s následnou hypourikémií (< 240 μmol/l). Tím se liší od hypovolemické hyponatrémie, kdy jsou transportní procesy proximálního tubulu aktivovány a dochází zde ke zvýšené reabsorpci Na+, Cl– i urátu s následnou hyperurikémií.
Hyponatrémie při sníženém příjmu sodíku
- „Beer pototmania“ – pivo má velmi nízký obsah sodíku (1 – 2 mmol/l), jeho excesivní konzumace proto může způsobit hyponatrémii.
- Extrémní diety – např. vegani
Předpokládá se, že hladina ADH je výrazně snížena (u této skupiny pacientů nebyla analyzována). Je přítomna hypoosmolální moč (< 100 – 200 mOsm/l) s nízkou koncentrací Na+ (< 10 – 20 mmol/l), což zhoršuje schopnost vylučování vody. I relativně malá polydipsie pak vede k výrazné hyponatrémii. K rychlé normalizaci dochází po zahájení substituce solí.
Hyponatrémie při příjmu hypotonických tekutin ve stavech s vysokou hladinou ADH
- Po dlouhém fyzickém výkonu (např. maratónci), kteří ztráty tekutin hradí vodou.
- Pacienti po chirurgickém výkonu, kteří jsou hrazeni hypotonickými roztoky.
- Uživatelé drog obsahující 3,4-metylendioxymetamfetamin (extáze a Molly).
Patofyziologie – hyponatrémie působí generalizovaný edém buněk, protože na základě osmotického gradientu proudí intersticiální tekutina intracelulárně. Hlavní manifestací hyponatrémie jsou neurologické příznaky s rozvojem edému mozku. Prvním kompenzačním mechanismem je snaha o eflux intersticiální tekutiny a solutů do mozkomíšního moku a odtud do systémové cirkulace, což je spojeno s efluxem Na+, K+ a Cl– z nervových buněk. Ke vzniku akutní hyponatremické encefalopatie dochází při překročení kapacity těchto kompenzačních mechanismů. Druhý kompenzační mechanismus začíná po 48 hodinách trvání poruchy (takto je definována chronická hyponatrémie), kdy organické, osmoticky aktivní molekuly (kreatin, betain, taurin, myozininozitol a glutamát) začínají opouštět nervové buňky. Důsledkem je snížení intracelulární osmolality a tím i osmotického gradientu. Tato druhá kompenzace je zásadní pro strategii léčby (viz níže).

Klinický obraz – prvními příznaky jsou nauzea, zvracení a bolesti hlavy. Závažnější známkou pak křeče s progresí do kómatu až smrt. Obávanou komplikací je herniace mozkového kmene. Akutní hyponatremická encefalopatie je emergentním stavem, kterým jsou ohroženy nejvíce premenopauzální ženy.
CAVE Může dojít k hypoventilaci a respirační acidóze s vazodilatací mozkových cév a dalším zhoršením mozkového edému. Normokapnické respirační selhání se může rozvinout následkem nekardiogenního plicního edému s normálním PCWP.
Při chronické hyponatrémii je zvýšené riziko kostních fraktur (zvýšené riziko pádů při neurologickým symptomech, dále s hyponatremií spojené snížení kostní denzity).
Diagnostika
1. Anamnéza – je nutné se zaměřit na komorbidity, užívané léky a situace spojené s vyšší hladinou ADH (nauzea a zvracení, bolest, anamnéza fyzické zátěže apod.). Zákeřné je, že hyponatrémie (zejména těžká) bývá často multifaktoriální.
2. Zobrazovací metody – užitečné může být CT mozku a plic (RTG S+P může být falešně negativní) ke zjištění příčiny SIADH nebo CSWS.
3. Laboratorní metody – laboratorní diagnostika má několik kroků:
- I. Základní biochemické vyšetření séra
- Osmolalita séra nutná k vyloučení pseudohyponatrémie s normální (hypercholesterolémie, hyperproteinémie) nebo zvýšenou (hyperglykémie) sérovou osmolalitou (osmolalita = 2xNa+ + urea + glykémie). Lze odvodit i efektivní osmolalitu (= 2xNa+ + glykémie), protože urea volně prochází membránami (norma je ˃ 270 mOsm/l).
- Urea, kreatinin jsou zvýšené při renálních příčinách.
- Hyperkalémie může souviset nejen s renálním selháním, ale i primární nebo sekundární adrenální insuficiencí.
- Glykémie, při hyperglykémii dochází k efluxu vody z buněk ven po směru osmotického gradientu s následnou dilucí séra (S-Na+ klesá o 4 mmol/l při každém nárůstu glykémie o 10 mmol/l)
- Kyselina močová je snížena při SIADH (při hyperaktivitě distálního tubulu při zvýšené koncentraci ADH je aktivita proximálního tubulu utlumena).
- Hormonální testy štítné žlázy, nadledvin a hypofýzy (TSH, fT4, ACTH, aldosteron, kortizol, synacthenový test).
- II. Základní biochemické vyšetření moči
- 1. Koncentrace Na+ v moči
- < 20 mmol/l – při hypovolémii odpovídá ztrátám z extrarenálních příčin. Při hypervolémii jde o Na+ avidní chorobu, např. nefrotický syndrom, chronické srdeční selhání nebo jaterní cirhózu.
- > 30 mmol/l – při euvolémii bývá příčinou SIADH nebo thiazidy v medikaci.
- 2. Koncentrace K+ v moči – důležitá ke stanovení poměru elektrolytů moč:plazma, který je zásadní pro předpověď, jak bude pacient reagovat na restrikci tekutin.
- 3. Osmolalita moči
- < 100 mOsm/l – polydipsie, současné nízká koncentrace Na+ v moči (˂ 20 mmol/l) bývá při beer pototmanii (vylučuje se velké množství vody a malé množství solutů).
- > 400 mOsm/l – v patofyziologii hraje důležitou roli i ADH (moč se koncentruje).
- 1. Koncentrace Na+ v moči
Terapie – před zahájením terapie je nutné se zamyslet nad třemi věcmi:
- Jak rychle porucha vznikla a jak moc urgentní terapie musí být. Pacienti s akutně vzniklou poruchou mívají výraznější symptomy, než v případě chronické hyponatrémie (˃ 48 hodin).
- Při rychlé korekci chronické hyponatrémie je vysoké riziko demyelinizačního syndromu.
- Odpověď na léčbu je výrazně nepředpověditelná. I při přesném výpočtu substituce je potřeba časných a častých kontrol natrémie.
Léčba hyponatrémie se skládá ze zvýšení natrémie a léčby vlastní vyvolávající poruchy.
I. Obecné principy
Euvolemická hyponatrémie
- SIADH – léčba vyvolávající příčiny (vysazení léku, léčba tumoru, plicní nebo CNS choroby).
- Sekundární adrenální insuficience, hypotyreóza – hormonální substituce.
Hypovolemická hyponatrémie – dobrá odpověď na hydrataci izotonickými roztoky s rychlým poklesem hladiny ADH a rozvojem diurézy. Rychlost korekce ke vždy potřeba přizpůsobit rychlosti vzniku poruchy.
Hypervolemická hyponatrémie – chronické srdeční selhání často příznivě reaguje na navýšení ACE inhibitorů a kompenzaci kardiální dekompenzace.
Hyponatrémie při sníženém příjmu sodíku
- Beer pototmanie – substituce sodíku, normalizace diety, při beer pototmanii je vysoké riziko demyelinizačního syndromu pro současnou častou hypokalémii, alkoholismus a malnutrici.
- Extrémní diety – substituce sodíku, normalizace diety.
II. Restrikce tekutin – restrikce tekutin je základem terapie chronické hyponatrémie. Čím méně bezelektrolytové vody pacienti vylučují, tím agresivnější restrikci tekutin potřebují (zejména pacienti se SIADH toto špatně tolerují). Snadným indikátorem množství bezelektrolytové vody v moči je poměr elektrolytů v moči a plazmě:
Poměr elektrolytů v moči a plazmě = (Na+moč + K+moč)/(Na+plazma)
- při ˃ 1 je nutná agresivní restrikce (příjem vody < 500 ml/den).
- při ~ 1 je vhodný příjem vody 500 – 700 ml/den.
- při ˂ 1 je vylučováno poměrně malé množství Na+, lze tedy předpokládat hypovolémii a je vhodný příjem vody 700 – 1000 ml/den.
III. Suplementace draslíku – natrémie je nejen funkcí koncentrace Na+, ale i K+ v séru, proto je při současné hypokalémii nutná suplementace draslíku. Při současném podávání draslíku i sodíku je velmi snadné přestřelení do hypernatrémie.
IV. Farmakoterapie
- Furosemid + substituce NaCl u některých pacientů se SIADH (furosemid inhibuje protiproudový mechanismus a tak i koncentrační mechanismus ledvin, NaCl antagonizuje natriurézu navozenou furosemidem).
- Demeclocyklin inhibuje hlavní buňky a lze jej použít, pokud je účinek furosemidu + NaCl nedostatečný. Hlavním nežádoucím účinkem je pokles glomerulární filtrace díky excesivní natriuréze i příma nefrotoxicita demeclocyklinu. V ČR se neužívá.
- Vaptany jsou inhibitory V2 receptorů a zesilují tak vylučování volné vody. Vysoce efektivní u SIADH, indikace u hypervolemické hyponatrémie (jaterní cirhóza, chronické srdeční selhání) není jasná. Zahájení léčby je nutné za hospitalizace, je potřeba zmírnit restrikci tekutin (> 2 litry) a často provádět kontroly natrémie. Látky: tolvaptan (jediný perorální, pro abnormality jaterních testů je vhodné terapii zkrátit na 1 – 2 měsíců), conivaptan (intravenózní, je kombinovaným inhibitorem V1A/V2. Inhibice V1A je odpovědna za riziko mírné hypotenze).
Terapie akutní hyponatrémie (< 48 hodin) – při akutní symptomatické hyponatrémii je indikován 3 % solný roztok tak, aby došlo k vzestupu natrémie rychlostí 1 – 2 mmol/l/hod, celkově o 4 – 6 mmol/l. Toto opatření bývá většinou dostačující k ústupu symptomů (zejména křečí). Celkový deficit Na+ lze spočítat takto:
Celkový deficit Na+ v organismu = f · tělesná hmotnost · (S-Na+cílové – S-Na+skutečné)
f = proměnná závisející na pohlaví (muži = 0,6, ženy = 0,5)
Na vzorec nelze spoléhat a vzestup natrémie je velmi nepředvídatelný. Je proto potřeba kontrolovat natrémii každé 2 – 4 hodiny a podávat maximálně 50 % vypočteného množství.
Při vzniku nekardiogenního plicního edému je třeba zajistit adekvátní oxygenaci a ventilaci k zabránění vzniku respirační acidózy (vazodilatace mozkových cév se zhoršením edému mozku) a hypoxémie. Adjuvantní léčbou může být podání kličkových diuretik (odstranění volné vody). CAVE Vaptany nejsou v léčbě akutní hyponatrémie indikovány.
Terapie chronické hyponatrémie (> 48 hodin) – rychlost vzestupu natrémie maximálně o 0,5 mmol/l/hodinu. Celkový vzestup maximálně o 10 mmol/l během 24 hodin a 18 mmol/l během 48 hodin. U rizikových pacientů (viz níže) jsou hodnoty nižší. Pokud nemáme spolehlivý údaj o délce trvání natrémie, je nutné k asymptomatickým pacientům přistupovat jako k chronikům.
Komplikace hyponatrémie
Demyelinizační syndrom – demyelinizační syndrom (neboli syndrom pontinní a extrapontinní myelinolýzy) je nejobávanější komplikací léčby hyponatrémie. Je způsoben asymetrickou korekcí osmolality intra- a extracelulárně. Toto platí zejména pro chronické poruchy, protože reakumulace organických osmolárních látek, které jsou kompenzačně vyloučeny, bývá velmi opožděná. Při rychlém vzestupu natrémie dochází k situaci, kdy je intracelulárně menší osmolalita než extracelulárně. Na základě osmotického gradientu proudí voda z buňky ven, která se tímto svrašťuje. Vznikají „střižné“ síly, které jsou odpovědny za demyelinizaci axonů nervových buněk. Nejčastěji postiženou strukturou je pons cerebri. Zákeřností této komplikace je fakt, že se projevuje za delší dobu po korekci poruchy (jeden i více dnů), tedy až v době kdy je „dílo dokonáno“. Mezi jeho projevy patří chabá para- nebo kvadruparéza, dysfágie, dysartrie, diplopie, kóma nebo locked-in syndrom. Mimo pons může být postižena prakticky jakákoliv struktura mozku (mozeček, nucleus geniculus lateralis, thalamus, putamen, kůra nebo podkorové oblasti), klinické příznaky pak závisí na místě největšího postižení. Rizikovými faktory vzniku demyelinizačního syndromu jsou alkoholismus, malnutrice, hypokalémie a stav po transplantaci jater. Prevencí jeho vzniku je dodržení rychlosti vzestupu natrémie.
CAVE Při rychlé normalizaci ADH (pacienti se sekundární adrenální insuficiencí substituovaní glukokortikoidy a vzápětí zaléčení solnými roztoky, zahájení léčby vaptany) může dojít k neadekvátnímu a nečekanému „vystřelení“ natrémie se všemi klinickými důsledky. V tomto případě je indikována rychlá reindukce hyponatrémie nejlépe kombinací desmopresinu a volné vody (5 % glukóza).
Hypernatrémie
Definice – definována jako vzestup Na+ v krvi > 145 mmol/l. Těžká hypernatrémie bývá spojena s mortalitou 40 – 60 % (zejména díky závažným komorbiditám, které ji provází).
Etiologie
- 1. Dehydratace – způsobena kombinovanou ztrátou vody a soli, při které ztráta vody převažuje. Nejvíce ohroženi jsou starší jedinci, kteří mají potlačený pocit žízně.
- 2. Ztráty tekutin
- perspiration insensibilis – nadměrná námaha, horečka, přehřátí, popáleniny, mechanická ventilace.
- gastrointestinálním traktem – nejčastěji průjem při virových gastroenteritidách, které jsou provázeny vylučováním hypotonické stolice (osmotický průjem, koncentrace Na+ a K+ < 100 mmol/l). Naopak, při sekrečních průjmech je generována izotonická stolice s následným vznikem izo- nebo hyponatremické dehydratace.
- renální – může vznikat při osmotické diuréze (glykosurie při diabetes mellitus, vysoká koncentrace urey v moči, podání manitolu) nebo po odstranění obstrukce močových cest.
- 3. Porucha hypothalamu – vzácná příčina hypernatrémie, většinou způsobena kombinací potlačení pocitu žízně a porušení syntézy ADH (oboje se děje v hypothalamu). Tento adipsický diabetes inspidus může být způsoben např. primárním tumorem nebo metastázou do hypothalamu, okluzí a.communicans anterior, traumatem, hydrocefalem nebo zánětem.
- 4. Podání roztoků s vysokým obsahem Na+ – vzácněji iatrogenně při podání roztoků s vysokým obsahem Na+ (NaCl, NaHCO3).
- 5. Diabetes inspidus – má řadu primárních i sekundárních příčin:
- I. Nefrogenní diabetes inspidus – způsoben rezistencí ledvinných tubulů k ADH: mutace V2 receptorů (X-dědičná), akvaporinu-2 (AD/AR), mutace akvaporinu-1 (AR).
- II. Hypokalémie – zhoršuje citlivost ledvin k ADH a internalizuje akvaporiny-2.
- III. Hyperkalcémie – hyperkalcémie aktivuje CaSR (calcium signalising receptor), který působí down regulaci transportéru pro Na+/K+2Cl– v tlusté části ascendentního raménka Henleovy kličky a zhoršuje tak koncentrační schopnost ledvin.
- IV. Léky – lithium – inhibice renální kinázy glykogen syntázy – 3 (GSK3), která je nejen cílem léčby bipolární afektivní poruchy, ale je i třeba k expresi akvaporinů-2. Lithium vstupuje do tubulárních buněk amilorid senzitivním ENaC kanálem, jeho blokáda amiloridem tak může mírnit příznaky diabetes inspidus indukovaného lithiem. Tubulární poškození může dlouho perzistovat, protože lithium působí chronickou tubulointersticiální nefritidu s jizvením.Dále ifosfamid a některá antivirotika.
- V. Gestační diabetes inspidus – vzácná komplikace pozdního těhotenství. Placentární proteázy štěpí i ADH a tím snižují jeho koncentraci s následnou polyurií a hypernatrémií. Léčbou je podání desmopresinu, který je vůči placentárním proteázám rezistentní.
Patofyziologie – hypernatrémie zvyšuje osmolalitu extracelulární tekutiny se vznikem osmotického gradientu a efluxem intracelulární tekutiny z buněk s jejich následným svrašťováním. Po 48 hodinách (definice chronické hypernatrémie) dochází k buněčné kompenzaci s aktivací transportu organických molekul (kreatin, betain, taurin, myozininozitol a glutamát), které zvyšují intracelulární osmolalitu i množství intracelulární tekutiny. Pacienti s chronickou hypernatrémií mívají proto méně závažnou symptomatologii (porucha je již kompenzovaná).
CAVE Díky kompenzačním mechanismům je při příliš rychlém poklesu natrémie (>10 mmol/den) vysoké riziko vzniku edému mozku.
Klinický obraz
1. Neurologické příznaky – nejčastějším příznakem jsou poruchy vědomí kolísající od lehké letargie po hluboké kóma.
CAVE Při akutním vzniku hyponatrémie dochází k rychlému svraštění s rizikem subarachnoidálního nebo subdurálního krvácení a trombózy mozkových sinů (zejména u novorozenců a dětí).
2. Svalové příznaky – svraštění rabdomyocytů může vést k rabdomyolýze.
Diagnostika
1. Anamnéza – je nutné se zaměřit na přítomnost (nebo absenci) žízně, polyurie a extrarenálních ztrát (nadměrné pocení, průjem apod.).
2. Fyzikální vyšetření – při fyzikálním vyšetření je přítomna oschlá sliznice dutiny ústní, snížený kožní turgor, ortostatická tachykardie (vzestup TF > 15´ při postavení), ortostatická hypotenze (pokles TK > 15 mm Hg při postavení) a pokles centrálního žilního tlaku. Při těžké hypovolémii dochází k hypovolemickému šoku s hypotenzí a zvýšením periferní cévní rezistence (oligurie, chladná a cyanotická akra, poruchy vědomí). Základem správné diagnostiky a léčby je důsledná bilance tekutin.
3. Biochemické vyšetření – základem je změření osmolality a iontogramu krve i moče:
- při extrarenálních ztrátách tekutin je fyziologickou reakcí na zvýšení hladiny osmolality krve (> 295 mOsm/l) zvýšení koncentrace ADH s produkcí nízkého objemu (< 500 ml/den) hypertonické moče (> 500 mOsm/l). Při tomto schématu lze předpokládat extrarenální zdroj ztrát.
- při osmotické diuréze dochází k polyurii s vysokými odpady solutů (Na+, K+ a Cl–) do moče v závislosti na příčině.
- při diabetes inspidus se vylučuje velké množství hypotonické vody. K odlišení centrální a nefrogenní formy lze použít desmopresin. Při centrální formě dochází po jeho podání k rychlému poklesu diurézy a zvýšení osmolality moče, bez jakékoliv změny nízké hladiny ADH. Při nefrogenní je normální nebo zvýšená hladina ADH a po podání desmopresinu nedochází k žádné odpovědi v množství nebo osmolalitě moči.
- při renálních ztrátách tekutin je potřeba vypočítat deficit čisté vody včetně clearance bezelektrolytové vody k určení substituce jejich ztrát.
CAVE Koncentrační test s odnětím tekutin je u hypernatrémie kontraindikován pro riziko dalšího zhoršení hypernatrémie.
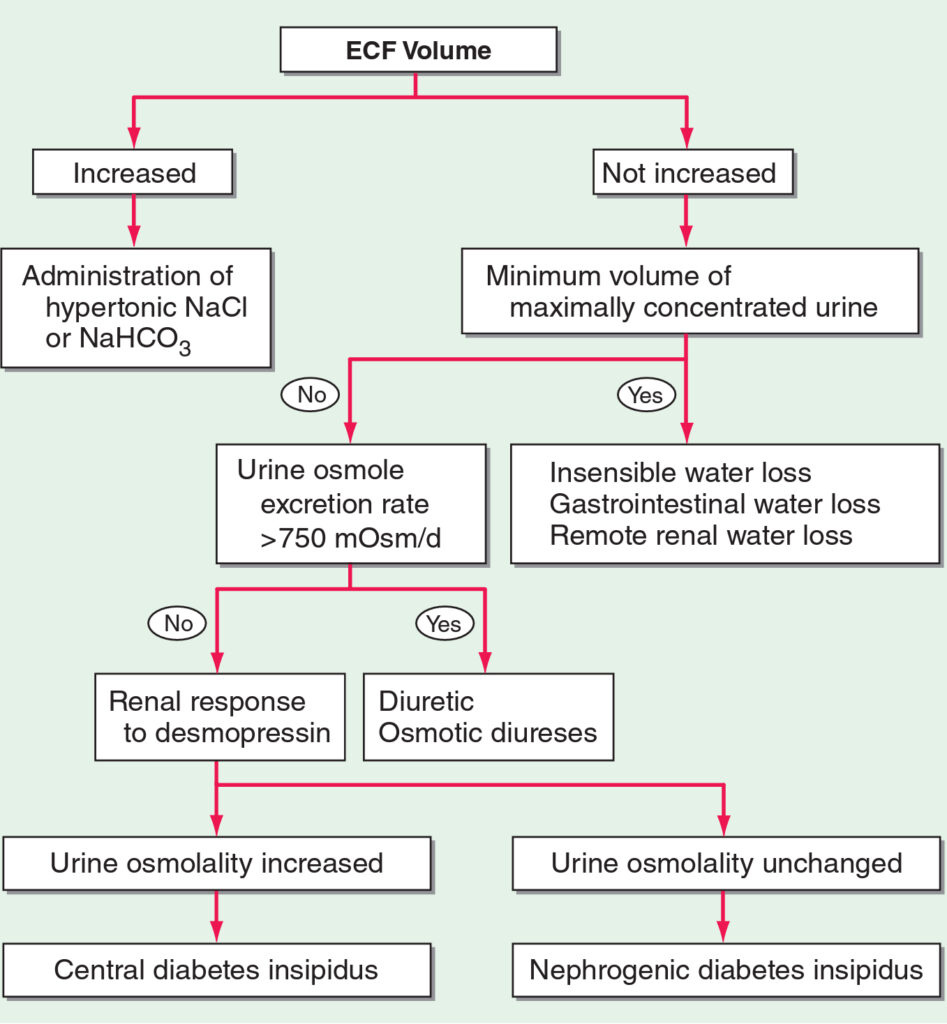
Diagnostika hypernatrémie – kroky:
- 1. Zhodnocení volémie:
- zvýšená – pravděpodobně následkem podání hypertonických roztoků (NaCl, NaHCO3)
- normální nebo snížená – 2. moč:
- malé množství vysoce koncentrované moče – dehydratace (neměřitelné ztráty, GIT, renální ztráty tekutiny)
- normální množství normálně koncentrované moči – 3. vylučování osmoticky aktivních látek močí > 750 mosmol/l
- ano – diuretika, osmotická diuréza
- ne – diabetes inspidus – odpověď na desmopresin
- centrální DI
- renální DI
Terapie
I. Léčba vyvolávající příčiny – prvním krokem musí být léčba vyvolávající příčiny, tedy vysazení hypokalemizujících léků a korekce hypokalémie, hyperkalcémie, hyperglykémie a léčba průjmu.
II. Podávání čisté vody – v lehčích případech je možné podávat čistou vodu perorálně, v těžších případech je nutné podávat parenterálně hypotonické roztoky (5 % glukózu, která se metabolizuje na čistou vodu, nebo poloviční fyziologický roztok u těžkých hypernatrémií, kdy by podání čisté vody vedlo k rychlému poklesu natrémie). U pacientů s diabetes inspidus je vhodné vypočítat množství vyloučené bezelektrolytové vody, kterou je potřeba každý den uhradit.
III. Specifická terapie
- Centrální DI – desmopresin
- Nefrogenní DI
- indukovaný lithiem – amilorid (2,5 – 10 mg/den)
- obecně thiazidy (zvýšení reabsorpce vody proximálním tubulem), NSAID – inhibice negativního vlivu prostaglandinů na koncentrační mechanismus ledvin (vždy je třeba zohlednit toxický vliv NSAID na gastrointestinální trakt a ledviny)
CAVE Farmakoterapie je indikovaná k léčbě chronické hypernatrémie, u akutní hypernatrémie je indikováno pouze hrazení a zábrana ztrát čisté vody.

Draslík
Distribuce draslíku v organismu
Normální hladina draslíku v krvi je 3,5 mmol/l – 5,0 mmol/l. Draslík se vylučuje z 90 % ledvinami a 10 % stolicí. 98 % celkového obsahu draslíku se nachází intracelulárně (zejména ve svalech). Masivní nekróza může způsobit uvolnění draslíku z buněk se vznikem těžké hyperkalémie (zejména v terénu nefropatie).
Regulace kalémie
Hlavním místem regulace kalémie jsou ledviny:
- při deficitu kalia působí jeho reabsorpci, zejména cestou vmezeřených buněk sběrných kanálků.
- při nadbytku kalia dochází k jeho exkreci, zejména z hlavních buněk sběrných kanálků, do kterých Na+ vstupuje cestou amilorid senzitivních ENaC kanálů. Tím vzniká negativní intraluminální potenciál s následným pasivním vyloučením draslíku přes apikální draslíkové kanály. V distálním nefronu jsou přítomny dva typy:
- ROMK (renal outer medullary K+ channel), který je zodpovědný za většinu konstitutivní sekrece.
- BK (flow sensitive big potassium, neboli „maxi-K” draslíkový kanál), který je využíván při vyloučení náhlé nálože draslíku nebo při genetickém defektu ROMK.
Zhodnocení vztahu resorpce sodíku cestou ENaC a exkrece draslíku v distálním nefronu je základem zhodnocení iontové poruchy:
- snížení aktivity ENaC a reabsorpce Na+ v distálním nefronu vede k hyperkalémii, díky absenci „motoru“ k vyloučení draslíku:
- extrarenální hypovolémie se snížením průtoku Na+ distálním nefronem.
- amilorid inhibuje ENaC a snižuje tak vstup Na+ do buněk.
- zvýšení aktivity ENaC a reabsorpce Na+ v distálním nefronu vede ke vzniku negativního intraluminálního potenciálu, který je „vyrovnáván“ zvýšením pasivní exkrece draslíku do lumina s rozvojem hypokalémie:
- při léčbě thiazidy se snižuje reabsorpce Na+ v distálním tubulu, čímž je v distálnějších částech nefronu přítomno více Na+.
- aldosteron aktivuje ENaC se zvýšením resorpce Na+ v distálním nefronu
Nadbytek nebo nedostatek draslíku má efekt na hustotu a aktivitu apikálních K+ kanálů distálního nefronu a H+/K+ATPázy vmezeřených buněk sběrných kanálků vnější dřeně, které jsou nezávislé na aldosteronu. Hypokalémie je aktivuje, hyperkalémie zase inhibuje.
Hypokalémie
Definice – při hypokalémii je S-K+ < 3,5 mmol/l. Objevuje se u více než 20 % hospitalizovaných pacientů a je spojena s 10x vyšší nemocniční mortalitou (zejména kardiovaskulární komplikace).
Lze odhadnout, že pokles kalémie o 1 mmol/l je spojen s celkovým deficitem 200 mmol.
Etiologie
I. Pseudohypokalémie – vzniká vychytáváním draslíku buňkami při jejich nadbytku v krvi (např. leukémie) nebo špatnou technikou odběru (zahřátí vzorku krve).
II. Redistribuce draslíku
1. Aktivace Na+, K+ ATPázy – kdy dochází ke zvýšenému vstupu K+ do buňky. Hyperaktivitu této pumpy působí:
- inzulín – stimulace endogenní sekrece inzulínu podáním glukózy malnutrickým pacientům (mimo hypokalémie bývá častá i hypomagnezémie a/nebo hypofosfatémie).
- aktivace sympatiku – např. při alkoholové abstinenci, hypertyreóze, akutním infarktu, myokardu, těžkém kraniotraumatu, podání β2 sympatomimetik (bronchodilatancia nebo tokolytika, např. ritodrin, dále efedrin a pseudoefedrin, které jsou součástí sirupu proti kašli).
- hormony štítné žlázy – hypertyreóza s periodickými atakami hypokalemické paralýzy, častěji vzniká u Asiatů a Hispánců a je působena mutací svalového iontového kanálu stimulovaného hormony štítné žlázy (u Asiatů nejčastěji draslíkový kanál Kir2.6). Porucha se projevuje nejčastěji nad ránem slabostí končetin (nejčastěji dolních), těžkou hypokalémií a hypertyreoidismem. Základem léčby jsou neselektivní beta blokátory (např. propranolol), substituce draslíku a léčba hypertyreoidismu.
- k podobnému obrazu (ovšem bez tyreotoxikózy) dochází při familiární hypokalemické periodické paralýze (mutace voltážové domény α1 podjednotky kalciového kanálu typu L nebo skeletálního Na+ kanálu s následným abnormálním gatingem proudu aktivovaného hyperpolarizací).
- aktivace cAMP signalizační dráhy (využívají ji i β2 receptory), kterou působí např. teofylin nebo kofein (konzumace kávy).
2. Inhibice pasivního efluxu draslíku z buněk – vzácná příčina hypokalémie, např. při intoxikaci baryem.
III. Extrarenální ztráty draslíku – v potu i žaludečních šťávách je koncentrace draslíku malá, proto k významnějším ztrátám dochází pouze při velmi excesivním pocení nebo zvracení.
CAVE Při zvracení vzniká hypochloremická alkalóza, která vede k sekundárnímu hyperaldosteronismu a bikarbonáturii, zvýšení vylučování draslíku a hypokalémi, tedy renálním ztrátám draslíku.
Průjem – nejčastější extrarenální příčina hypokalémie je průjem (infekční i neinfekční).
IV. Renální ztráty draslíku
1. Léky
- diuretika
- thiazidy působí blokádu Na+ Cl– transportéru distálního tubulu s nárůstem koncentrace Na+ v distálním nefronu (spojovací kanálek) a následným zvýšením exkrece K+ do lumina kanálků a sekundárním hyperaldosteronismem. Mimo to jsou spojeny s hyperkalciurií.
- furosemid působí nejen vyšší koncentraci Na+ v distálním tubulu, ale i hypokalciurii, která blokuje funkci ENaC a tím snižuje vstup Na+ do tubulárních buněk, negativní luminální potenciál i následný výstup K+ do lumen. Jinými slovy, kličková diuretika mají i přes vyšší natriuretický efekt menší vliv na kalémii.
- penicilinová antibiotika – vyšší dávky některých penicilinových antibiotik s aniontovou molekulou, které nejsou v tubulech resorbovány (např. oxacilin a ticarcilin), působí zvýšení distálního elektrického gradientů s výstupem K+ do distálního nefronu a vznikem hypokalémie.
- některé renální tubulární „toxiny“ – některé nefrotoxické látky jsou spojeny s vyšší exkrecí draslíku a hořčíku, např. aminoglykosidy, amfotericin B, foscarnet, cisplatina a ifosfamid.
2. Hyperaldosteronismus – i aldosteron aktivuje ENaC s následným rozvojem hypokalémie (viz. výše):
- primární hyperaldosteronismus
- kongenitální adrenální hyperplázie s defektem 11β-hydroxylázy (virilismus) nebo 17α-hydroxylázy (hypogonadismus)
- familiární hyperaldosteronismus I. typu způsobený chimérickou duplikací mezi geny pro homologní 11β-hydroxylázu a aldosteron syntázu. Chimérický gen je pod kontrolou ACTH, proto suprese jeho produkce glukokortikoidy vede i ke kontrole hyperaldosteronismu.
- familiální hyperaldosteronismus II. typu není ovlivnitelný podáním glukokortikoidů.
- familiární hyperaldosteronismus III. typu je způsobený mutací genu KCNJ5, který kóduje GIRK-4 (G-protein-activated inward rectifier K+ channel). Jeho mutace vede ke zvýšení permeability GIRK-4 pro sodíkový iont s následnou excesivní membránovou depolarizací buněk zona glomerulosa nadledvin a aktivaci voltážově řízených kalciových kanálů. Následný influx Ca2+ stimuluje buněčnou proliferaci a sekreci aldosteronu vedoucí ke vzniku adenomů a hyperaldosteronismu. Ani tato forma není ovlivnitelná glukokortikoidy.
- získaný hyperaldosteronismus
- adenomy produkující aldosteron (téměř 60 % případů sekundárního hyperaldosteronismu). Často byly identifikovány mutace genu KCNJ5, vzácněji ATP1A1 (α1 podjednotky Na+, K+, ATPázy) a ATP2B3 (Ca2+ ATPázy). Tyto mutace působí hyperaldosteronismus stejným mechanismem jako v případě FH III. typu.
- bilaterální adrenální hyperplázie (idiopatický hyperaldosteronismus, 40 % případů).
- unilaterální adrenální hyperplázie.
- karcinom nadledvin.
- syndrom zdánlivého nadbytku mineralokortikoidů – glukokortikoid kortizol má k mineralokortikoidovému receptoru (MLR) stejnou afinitu jako aldosteron. Buňky distálního nefronu citlivé k aldosteronu jsou před excesivní aktivací chráněni přítomností enzymu 11β-hydroxysteroid dehydrogenázy-2 (11βHSD-2). Tento enzym konvertuje kortizol na kortizon, který má afinitu k MLR již minimální. AR dědičná inhibiční mutace genu pro 11βHSD-2 je spojena s excesivní aktivací MLR kortizolem projevující se hypertenzí, hypokalémií, hyperkalciurií, metabolickou alkalózou a snížením PRA a aldosteronu. Podobné projevy má exogenní inhibice 11βHSD-2 kyselinou glycyrhinickou a/nebo karbenoxolonem. Glycyrhinická kyselina je přírodní sladidlo, které se ve velkém množství nachází v lékořici nebo jako příchuť v tabákových výrobcích.
U pacientů s hypokalémií a hypertenzí je užitečné screeningové stanovení poměru reninu a aldosteronu. Výsledek > 50 je velmi sugestivní pro primární hypoaldosteronismus. Při hypokalémii a současnému užívání některých léků se tento poměr může snížit pod 50 a výsledek testu učinit falešně negativní. Jeho interpretace musí být vždy spojena s farmakologickou anamnézou.
3. Cushingův syndrom – je způsobený zvýšenou aktivitou glukokortikoidů:
- centrální Cushingův syndrom
- adenom produkující ACTH (Cushingova choroba) je spojen s hypokalémií a hypertenzí jen v 10 % případů.
- při ektopické produkci ACTH jsou oba příznaky přítomny u 60 – 100 % pacientů (pravděpodobně přítomna i snížená aktivita 11βHSD-2).
- periferní Cushingův syndrom – nejčastěji iatrogenní forma při kortikoterapii, vzácněji adenom nadledvin, raritně karcinom nadledvin.
4. Poruchy tubulárního transportu ledvin
- distální renální tubulární acidóza (I. typu) – neschopnost vyloučit H+ v distálním tubulu s nízkou produkcí NH4+.
- Liddleho syndrom – AD dědičná hyperaktivační mutace genu pro podjenotku ENaC se zvýšením exprese ENaC na plazmatické membráně hlavních buněk se zvýšením transportu Na+ do buněk, vznikem negativního elektrického gradientu v tubulech, který má za následek proudění K+ do lumina tubulů, hypokalémii a těžkou hypertenzi. Porucha je rezistentní ke spironolaktonu, ale citlivá k amiloridu (ENaC jsou amilorid senzitivní).
- Bartterův syndrom – typy:
- Typ I − defekt Na+, K+, 2Cl–-kotransportéru. Inhibiční mutace genů kódujících Na+K+2Cl– symport v tlusté části ascendentního raménka Henleovy kličky. Projevuje se polyurií, polydipsií, hyperkalicurií s hypokalcémií, hypokalémií a metabolickou alkalózou. Dochází k aktivaci renin-angiotenzin-aldosteronové osy. Jinak řečeno, syndrom klinicky odpovídá předávkování furosemidem.
- Typ II − defekt ROMK, projevuje se stejně jako typ I.
- Typ III − defekt bazolaterálního Cl–, přítomna bývá i hypomagnezémie.
- Typ IV − mutace genu pro barttin (protein, který umožňuje externalizaci a správnou funkci bazolaterálního Cl– V ledvinách a vnitřním uchu). Charakteristická trias: Bartterův syndrom + renální insuficience + porucha sluchu.
- Typ V − inhibiční mutace CaSR, objevuje se hypokalcémie při sníženém PTH.
- Gittelmannův syndrom – inhibiční mutace genu pro Na+, Cl– symportu v distálním tubulu. Projevuje se hypomagnezémií, hypokalciurií (tou se liší od Bartterova syndromu), hypokalémií, hypokalemickou alkalózou a navíc často chondrokalcinózou (abnormální depozice kalcium pyrofosfát dihydrátu v kloubní chrupavce). Projevy poruchy jsou mírnější než u Bartterova syndromu. Syndrom klinicky odpovídá předávkování thiazidy.
5. Deficit hořčíku a hypokalémie – hypokalémie vzniká několika mechanismy:
- hořčík je důležitým kofaktorem Na+, K+ ATPázy, hypomagnézémie proto inhibuje její funkci a tak i influx draslíku do svalových buněk se vznikem sekundárního zvýšení vylučování draslíku ledvinami. .
- hořčík blokuje funkci ROMK (renal outer medullary K+ channel) v hlavních buňkách sběrných kanálků, jeho nedostatek má tak za následek zvýšený únik K+ do lumina tubulů.
CAVE Pacienti s hypokalemií se současnou hypomagnézemií jsou refrakterní k substituci draslíku než dojde k substituci hořčíku.
Klinický obraz
1. Kardiální příznaky – hypokalémie je hlavním rizikovým faktorem supraventrikulárních i komorových arytmií. Zhoršuje toxicitu digoxinu (snížení kompetice mezi draslíkem a digoxinem o vazebná místa na Na+ K+ ATPáze ve prospěch digoxinu). Typické jsou EKG změny (zejména při S-K+ ˂ 2,7 mmol/l):
- T vlny jsou široké a ploché, často se objevuje vlna U, bývají ST deprese.
- prodloužení QT intervalu (tedy zhoršuje průběh při syndromu dlouhého QT jiné etiologie).
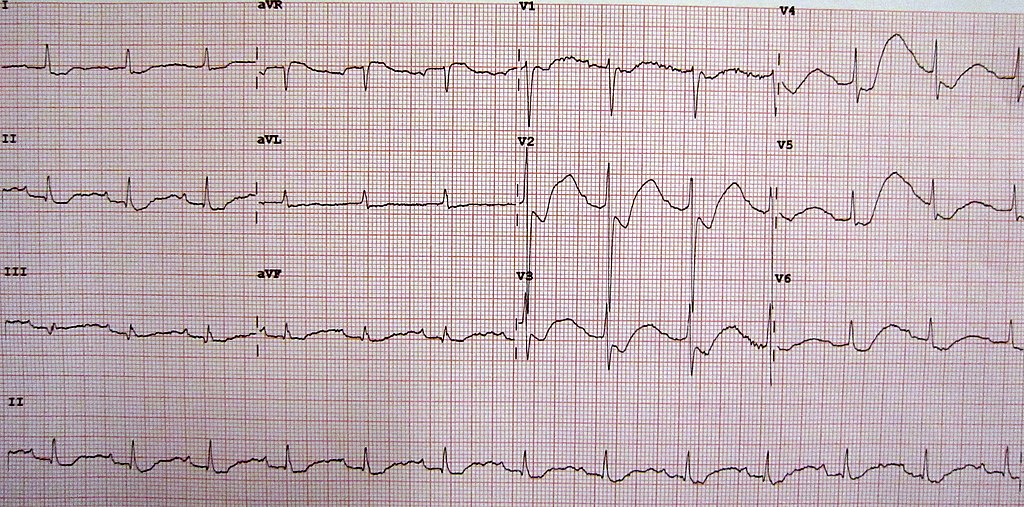
2. Příznaky z kosterního svalstva – hypokalémie zhoršuje depolarizační schopnost i kosterního svalstva projevující se svalovou slabostí a predispozicí k rabdomyolýze.
3. Gastrointestinální příznaky – zhoršení depolarizace a paralýza hladkého svalstva trávicí trubice predisponuje ke vzniku p aralytického ileu.
4. Renální příznaky – při hypokalémii dochází k:
- retenci Na+, Cl–, retenci HCO3– se vznikem metabolické alkalózy a retencí citrátů.
- sekreci fosfátů a aktivaci renální tvorby amoniaku.
- polyurii při polydipsii a hypokalémií navozené rezistenci tubulů k ADH.
Při dlouhodobé hypokalémii dochází k vakuolizaci buněk proximálního tubulu, intersticiální nefritidě a vzniku renálních cyst. Hypokalémie predisponuje k akutnímu selhání ledvin a urychluje progresi chronické nefropatie do end-stage (zejména při dietních poruchách a/nebo abúzu laxativ).
5. Ostatní – hypokalémie a snížený přívod draslíku ve stravě je spojen s progresí hypertenze, srdečního selhání a centrální mozkové příhody. Krátkodobá restrikce draslíku u zdravých jedinců i hypertoniků vede k indukci retence Na+ a Cl– a hypertenze. Při normalizaci kalémie se snižuje i krevní tlak (důležité zejména u pacientů léčených diuretiky).
Diagnostika
1. Anamnéza – důležitá je zejména:
- farmakologická anamnéza (užívání laxativ, diuretik a antibiotik).
- dieta (lékořice).
- přítomnost podezřelých symptomů (periodická svalová slabost, průjem).
2. Fyzikální vyšetření – důležité je zaměřit se na krevní tlak, volumový status a příznaky chorob, které by mohly být spojeny s hypokalémií (např. hypertyreóza, Cushingův syndrom).
3. Laboratorní metody
I. Biochemické vyšetření séra – základem je stanovení vyšetření Na+, K+, Cl–, Mg2+, Ca2+, P, osmolality, urey, kreatininu, pH a kompletního krevního obrazu. Interpretace:
- Metabolická acidóza s normálním anion gap bývá při distální renální tubulární acidóze nebo průjmu (k odlišení lze použít močový anion gap).
- Chronická metabolická alkalóza s hypokalémií vzniká nejčastěji při dlouhodobém zvracení, abúzu diuretik a Gittelmannově syndromu, které lze odlišit analýzou elektrolytů v moči:
- při zvracení a bulimii je Cl– v moči snížené (< 10 mmol/l).
- při Gittelmannově syndromu a abúzu diuretik jsou Na+, K+ a Cl– v moči zvýšené.
- Poměr aldosteron:renin
- > 50 při hyperaldosteronismu (suprese PRA, elevace aldosteronu), pacienti potřebují další testování k odlišení jednotlivých příčin (FH-1, syndrom zdánlivé nadprodukce mineralokortikoidů, Liddleho syndrom apod.) Při pozitivní rodinné anamnéze primárního hyperaldosteronismu, nebo věku < 20 let nebo iktu v mladém věku (< 40 roků) je třeba vyloučit familiární hyperaldosteronismus I. typu. Odlišení Liddleho syndromu a syndromu zdánlivého nadbytku mineralokortikoidů je možné na základě genetického vyšetření a terapeutické odpovědi (Liddleho syndrom reaguje na amilorid a je rezistentní ke spironolaktonu, zatímco syndrom zdánlivého nadbytku mineralokortikoidů na spironolakton reaguje dobře).
II. Biochemické vyšetření moče – základem je stanovení vyšetření Na+, K+, Cl–, Mg2+, Ca2+, P, osmolality, urey, kreatininu a pH.
- 24 hodinová sekrece K+ močí
- snížení (< 15 mmol/d) bývá při extrarenálních ztrátách draslíku.
- Koncentrace K+ ve vzorku moče – pokud není k dispozici sběr moče, lze stanovit:
- transtubulární K+ gradient (TTKG), který by při hypokalémii nerenálního původu měl být < 3. TTKG = (UK/PK) / (Uosm/Posm), tedy poměr poměrů močové a plazmatické koncentrace draslíku a močové a plazmatické osmolality. CAVE Lze použít pouze při osmolalitě moči > 300 mosm/l a močové koncentraci UNa > 25 mmol/l. Ukazuje jak moc ledviny vylučují nebo resorbují draslík (čím nižší, tím ledviny méně draslíku vylučují).
- poměr koncentrace K+ a kreatininu v moči, který by měl být při renálních ztrátách K+ > 1,5 mmol/mmol kreatininu.
- Koncentrace Cl– ve vzorku moče
- snížená u hypokalémií způsobených neresorbovatelnými anionty (antibiotika, HCO3–) a zvracení (+ metabolická alkalóza).
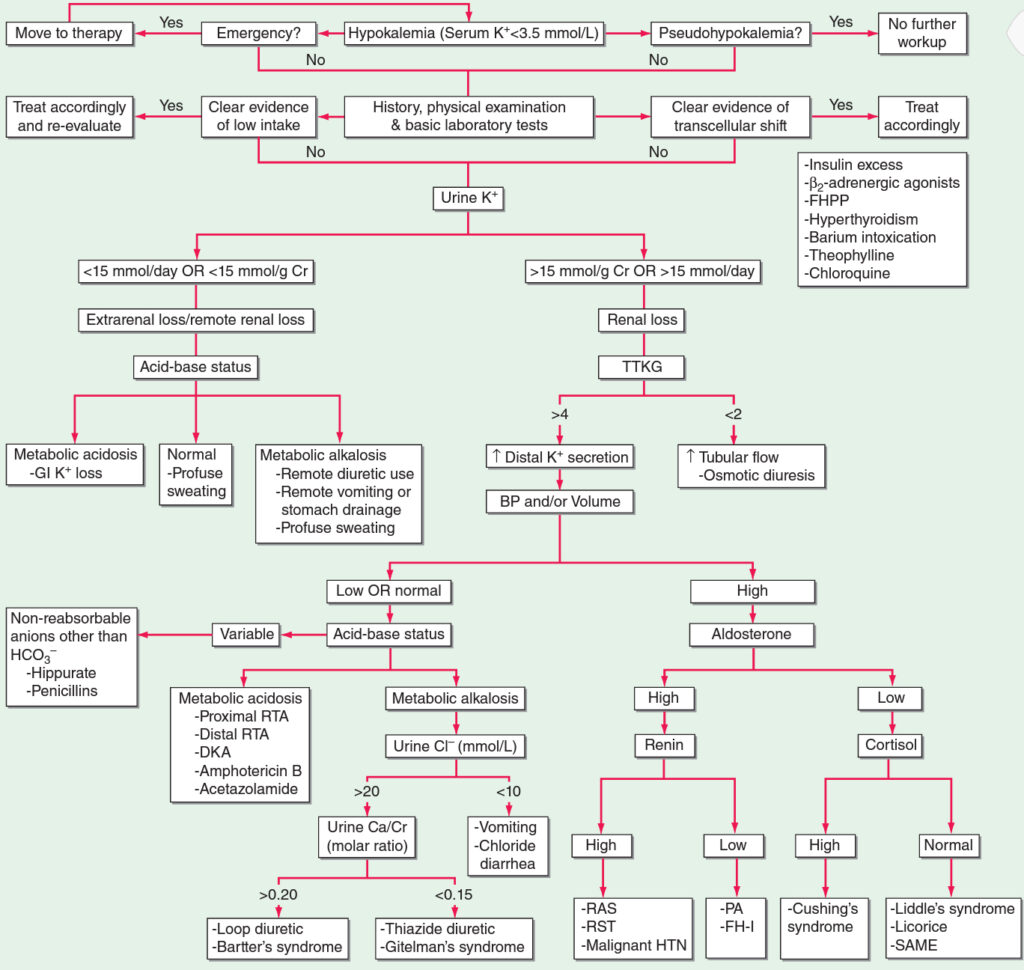
Diagnostika hypokalémie – kroky:
- 1. Je přítomna pseudohypokalémie??
- 2. Vyloučení redistribuce (beta2 sympatikomimetika, inzulín, hypertyreoidismus, familiální hypokalemická periodická paralýza) a nízkého příjmu draslíku.
- 3. Koncentrace draslíku v moči
- nízká (< 15 mmol/d) – extrarenální příčina hypokalémie, stanovíme acidobazický status:
- + metabolická acidóza (ztráty pankreatické tekutiny).
- + metabolická alkalóza (zvracení).
- normální ABR (výrazné pocení).
- vysoká (> 15 mmol/d) – renální příčina – změření TTKG:
- nízký (< 2) – rychlý tok a draslík se nestačí rychle vstřebat (osmotická diuréza).
- vysoký (> 4) – v distálním tubulu je zvýšená sekrece draslíku. Zhodnotíme TK a volémii.
- jestliže je TK a volémie vysoká, stanovíme plazmatickou hladinu aldosteronu:
- jestliže je aldosteron vysoký stanovíme plazmatickou hladinu reninu:
- vysoká – tumor produkující renin, stenóza renální tepny, maligní hypertenze.
- nízká – familiální hyperaldosteronismus I. typu, primární hyperaldosteronismus.
- jestliže je aldosteron nízký, stanovíme hladinu kortizolu.
- vysoká – Cushingův syndrom.
- nízká – Liddleho syndrom, SAME, popřípadě lékořice.
- jestliže je aldosteron vysoký stanovíme plazmatickou hladinu reninu:
- jestliže je TK a volémie normální nebo nízká, stanovíme acidobazický status:
- různý výsledek – vylučování neabsorbovatelných aniontů, které sebou strhnou draslíkové kationty (penicilinová antibiotika).
- metabolická acidóza – renální tubulární acidóza (proximální, distální), diabetická ketoacidóza, acetazolamid.
- metabolická alkalóza – stanovíme následně hladinu Cl- v moči.
- > 20 mmol/l – stanovíme poměr Ca/Cr v moči (poměr mmol).
- > 0,2 – kličková diuretika, Bartterův syndrom.
- < 0,15 – thiazidová diuretika, Gittelmannův syndrom.
- < 10 mmol/l – ztráty Cl- zvracením nebo průjmem.
- > 20 mmol/l – stanovíme poměr Ca/Cr v moči (poměr mmol).
- jestliže je TK a volémie vysoká, stanovíme plazmatickou hladinu aldosteronu:
- nízká (< 15 mmol/d) – extrarenální příčina hypokalémie, stanovíme acidobazický status:
Terapie – několik kroků:
I. Stanovení urgentnosti terapie – naléhavost terapie závisí nejen na závažnosti hypokalémie, ale i na řadě dalších faktorů:
- současná choroba srdce
- léčba digoxinem
- prodloužení QT intervalu
II. Léčba vyvolávající příčiny – při těžké redistribuční hypokalémii (< 2,5 mmol/l) je při odstranění vyvolávající poruchy (např. korekce metabolické alkalózy) a současné intenzivní substituci draslíkem vysoké riziko rebound hyperkalémie. Pokud je redistribuce a předpokládáme i určitý deficit, je třeba substituovat pomalu (24 – 48 hodin) a vždy nejdříve korigovat vyvolávající příčinu:
- při předpokládaném vlivu nadměrné aktivity sympatiku (tyreotoxikóza, předávkování teofylinem, akutní kraniotrauma) je vhodné podání vysoké dávky neselektivního beta blokátoru (propranolol, 3 mg/kg). Tato terapie koriguje hypokalémii bez rizika rebound hyperkalémie.
- úprava medikace (omezení diuretik, kombinace s jejich kalium-šetřícími formami event. ACE inhibitory).
- restrikce sodíku
III. Substituční terapie – u lehčích forem hypokalémie lze substituovat perorálními přípravky. Přitom je nutné vzít v potaz řadu faktorů (možnost redistribuční hypokalémie, stav renálních funkcí, medikace, přítomnost diabetu), tak aby nedošlo k rebound hyperkalémii. Podle vyvolávající příčiny je třeba vybrat vhodné přípravky: základem je KCl, při současné hypofosfatémii KHPO4, při současné metabolické acidóze KHCO3, při současné hypomagnezemii + MgSO4 (vždy, jinak je substituce draslíkem neúčinná).
U těžkých forem hypokalémie s rizikem komplikací nebo u pacientů neschopných perorálního příjmu je nutné draslík podávat parenterálně. Zásady:
- Draslík je vždy vhodné ředit do solných roztoků, ne glukózy (glukóza indukuje vzestup hladiny inzulínu, který hypokalémii dále zhoršuje).
- Při podání do periferní kanyly je maximální ředění 40 mmol KCl na litr roztoku. Při vyšší koncentraci je riziko chemické flebitidy. Při nutnosti podání koncentrovanějších roztoků je třeba aplikovat do centrální žíly (nejvhodnější je femorální žíla, protože proximálnější přístupy jsou velmi blízko srdci a podáni koncentrovaného roztoku draslíku kalia sem zvyšuje riziko kardiovaskulárních komplikací).
- Rychlost podání by neměla překročit 20 mmol KCl za hodinu (při překročení se zvyšuje riziko kardiovaskulárních komplikací).
Hyperkalémie
Definice, epidemiologie – při hyperkalémii je S-K+ > 5,5 mmol/l. U hospitalizovaných pacientů je v lehčí formě (5,5 – 6,0 mmol/l) přítomen u více než 10 %, v těžší formě (> 6,0 mmol/l) u 1 %.
Etiologie
I. Pseudohyperkalémie – pseudohyperkalémie vzniká uvolněním K+ z buněk, nejčastěji při nesprávné technice odběru:
- nadměrná svalová aktivita během venepunkce (např. svírání ruky v pěst).
- zvýšení buněčných elementů v krvi (trombocytóza, leukocytóza, erytrocytóza).
- chlazení vzorku po odběru.
- při hereditární pseudohyperkalémii dochází ke zvýšenému pasivnímu efluxu K+ z erytrocytů (např. mutace genu SLC4A1 kódujícího aniontový výměník erytrocytů AE1 vede ke snížení aniontového transportu v erytrocytech, hemolytické anémii, zvýšení efluxu K+z buňky a pseudohyperkalémii).
II. Redistribuce – k efluxu intracelulárního K+ a následné hyperkalémii může docházet několika mechanismy:
- 1. Acidémie – k zachování extracelulárního pH dochází při acidémii k influxu extracelulárního H+ a efluxu intracelulárního K+.
CAVE Tento efekt platí pouze pro metabolickou acidózu s normálním anion gap, méně výrazně pro respirační acidózu. Neplatí u metabolické acidózy s vysokým anion gap (laktátová acidóza, ketoacidóza).
- 2. „Solvent drag“ efekt – hypertonický manitol, hypertonický solný roztok, intravenózní imunoglobuliny a hypertonická glukóza podaná bez adekvátního inzulínu působí „solvent drag efekt“, při kterém proudí voda na základě osmotického gradientu ven z buněk. Spolu s ní opouští buňku i K+.
- 3. Inhibice Na+ K+ ATPázy – Na+, K+ ATPázu a tak i vychytávání K+ kosterními svaly inhibuje digoxin, některé příbuzné glykosidy v určitých rostlinách (náprstník, žlutý oleandr) nebo jed ropuchy obrovské. Podobný účinek mají i fluoridové ionty, hyperkalémie proto patří do obrazu intoxikace fluorem.
- 4. Léky
- kationické aminokyseliny – nejasným mechanismem působí eflux K+ a hyperkalémii lyzin, arginin a strukturálně příbuzná látka kyselina epsilon-aminokaproová.
- sukcinylcholin – depolarizace svalových buněk sukcinylcholinem působí eflux K+ cestou acetylcholinových receptorů.
CAVE Použití sukcinylcholinu je kontraindikováno u popálenin, neuromuskulárních chorob, svalové atrofii při prolongované intaktivitě, právě pro riziko nepřiměřeného efluxu K+ s rizikem akutní hyperkalémie.
III. Zvýšený příjem draslíku – vzhledem k vysoké exkreční kapacitě ledvin je u zdravých jedinců vzácnou příčinou. Naopak, u predisponovaných pacientů (např. renální insuficience, hyporeninemický hypoaldosteronismus) může vyvolat těžkou hyperkalémii i malé množství přijatého draslíku:
- potraviny bohaté na draslík jsou rajčata, banány a citrusové ovoce.
- iatrogenní příčinou může být podání KCl, léku obsahujících draslík (např. K-penicilin) nebo krevních transfúzí.
IV. Tkáňová nekróza – při masivní tkáňové nekróze (tumor lysis syndrom, rhabdomyolýza) dochází k uvolnění velkého množství draslíku z poškozených buněk se vznikem hyperkalémie.
V. Hypoaldosteronismus – uvolnění aldosteronu z nadledvin může být snížené z několika důvodů:
- 1. Hyporeninemický hypoaldosteronismus – většina pacientů má hypervolémii se sekundárním zvýšením ANP, který inhibuje uvolnění reninu i angiotenzinu. U některých chorob je velmi častý:
- starší věk
- diabetes mellitus
- renální insuficience
- metabolická acidóza – 50 % pacientů s MAc má snížení hladiny PRA a aldosteronu, nejčastěji při snížení renální exkrece NH4+, pozitivním močovým anion gap a pH < 5,5 (pro zapamatování tedy starší diabetik s pokročilou nefropatií, ke které patří metabolická acidóza…).
- 2. Primární hypoaldosteronismus – může být genetický nebo získaný a vzniká několika mechanismy:
- autoimunitní – Addisonova choroba, polyglandulární syndrom I. a II. typu.
- infekce – nejčastěji infekce HIV, na druhém místě tuberkulóza. Většinou subklinické, manifestovat se mohou různými vyvolávajícími faktory, např. stres, některé léky (ketokonazol, který inhibuje steroidogenezi) nebo vysazením steroidů (např. megestrolu).
- 3. Pseudohypoaldosteronismus – vrozená renální příčina, která se fenotypově překrývá s hypoaldosteronismem:
- Pseudohypoaldosteronismus I. typu – projevuje se ztrátami soli, hypotenzí a hyperkalémií. Má dvě formy:
- AD dědičná inhibiční mutace genu pro MLR, která se v dospělosti upravuje (necitlivost k aldosteronu).
- AR dědičná inhibiční mutace jedné ze tří podjednotek ENaC, která je celoživotní.
- Pseudohypoaldosteronismus II. typu – mutace genu pro proteiny regulující funkci Na+ Cl– symportu v distálním tubulu s jeho hyperfunkcí. Klinicky přesný opak Gittelmannova syndromu. Projevuje se hypertenzí, hyperkalémií, hyperchloremickou metabolickou acidózou, supresí PRA i aldosteronu a hyperkalciurií se sníženou kostní denzitou. K hyperkalémii dochází snížením aktivity K+ kanálů ve sběrných kanálcích (není zde dostatek Na+ k resorpci přes ENaC a následnému „elektrickému vytlačení“ K+ do tubulů). Po podání thiazidů dochází k úpravě stavu.
- Pseudohypoaldosteronismus I. typu – projevuje se ztrátami soli, hypotenzí a hyperkalémií. Má dvě formy:
VI. Renální příčiny – jeden z nejčastějších mechanismů vzniku hyperkalémie:
- 1. Chronická renální insuficience – hyperkalémie vzniká absencí funkčních nefronů se sníženou kapacitou ledvin pro exkreci draslíku (je častější u oligurického renálního selhání).
- 2. Tubulointersticiální nefropatie – při tubulointersticiálním poškození distálního nefronu (např. amyloidóza, srpkovitá anémie, tubulointersticiální nefritida, obstrukční uropatie) může být kalémie vyšší než by odpovídalo aktuální glomerulární filtraci.
VII. Léky
- ACE inhibitory, sartany, inhibitory reninu nebo MLR inhibují RAAS (renin-angiotenzin – aldosteronový systém) a blokují i lokální odpověď nadledvin na hyperkalémii. Potlačení uvolnění aldosteronu je tedy jak nepřímé, tak přímé.
- Spironolakton působí hyperkalémii přímou inhibicí aldosteronu.
- Amilorid, trimetoprim a pentamidin inhibují luminální sodíkový kanál ENaC se vznikem hyperkalémie, bývá doprovázená hyperchloremickou acidózou a/nebo hypovolemickou hyponatrémií.
- Cyklosporin, takrolimus, NSAID a inhibitory COX2 působí hyporeninemický hypoaldosteronismus.
- Drospirenone (součást antikoncepce) inhibuje MLR.
Patofyziologie – při lehké hyperkalémii je postižena repolarizační fáze srdečního cyklu se vznikem abnormalit T vlny, při dalším nárůstu kalémie dochází k poruchám vedení (prodloužení intervalu PR a QRS). U nejtěžších forem vzniká zcela abnormální EKG nález tvaru sinusoidy s hrozící zástavou nebo fibrilací komor.
Klinický obraz
1. Kardiální příznaky – nejnebezpečnějším projevem hyperkalémie jsou srdeční arytmie, zejména sinusová bradykardie, sinusové zástavy, pomalý idioventrikulární rytmus, komorové tachykardie, fibrilace komor a asystolie.
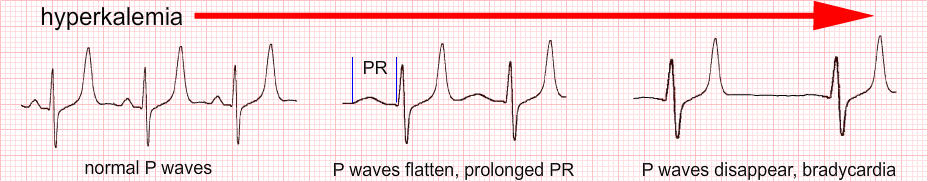
EKG se mění v závislosti na závažnosti kalémie (u pacientů „zvyklých“ na hyperkalémii, např. při chronickém renálním selhání se tyto změny posouvají k vyšším hladinám kalémie):
- 5,5 – 6,5 mmol/l – hrotnaté vlny T
- 6,5 – 7,5 mmol/l – vymizení vln P
- 7,0 – 8,0 mmol/l – rozšíření QRS komplexu
- ˃ 8,0 mmol/l – EKG křivka tvaru sinusoidy, hrozící fibrilace komor nebo asystolie
2. Příznaky z kosterního svalstva – při hyperkalémii se může vyskytnout ascendentní paralýza s postižením bránice a respiračním selháním. Lze rozlišit:
- sekundární hyperkalemickou paralýzu.
- familiární hyperkalemickou periodickou paralýzu, která se projevuje epizodami svalové slabosti a hyperkalémií.
- hyperkalemická depolarizace kosterních svalů může demaskovat AD dědičnou inaktivační mutaci genu SCN4A pro skeletální Na+ kanál.
3. Renální příznaky – při hyperkalémii dochází ke snížení schopnosti odstranění kyselé nálože (hyperkalémie vyvolává metabolickou acidózu) díky kompetici mezi K+ a NH4+ v reabsorpci v tlusté části ascendentního raménka Henleovy kličky. Dochází ke snížení dřeňového gradientu pro exkreci NH3/NH4.
CAVE Nezávisle na vyvolávajícím mechanismu může korekce kalémie vést i ke korekci hyperkalemické metabolické acidózy.
Diagnostika
1. Anamnéza a fyzikální vyšetření – důležité je pátrat po přítomnosti hyperkalemizujících léků, zvýšeného dietního příjmu draslíku (strava, potravinové doplňky), hypovolémii, hypotenzi a snížené diuréze.
2. Laboratorní vyšetření – základem je stanovení Na+, K+, Cl–, Mg2+, Ca2+, P, osmolality, urey, kreatininu, pH a kompletního krevního obrazu v séru a Na+, K+, Cl–, Mg2+, Ca2+, P, osmolality, urey, kreatininu a pH v moči. Interpretace:
- U-Na+ < 20 mmol/l znamená, že v distálním nefronu chybí „motor“ k exkreci K+. Efektivní léčbou je volumová resuscitace fyziologickým roztokem nebo podání furosemidu.
- osmolalita a koncentrace K+ moče a séra jsou důležité k výpočtu TTKG (transtubulárního K+ gradientu), který umožňuje zhodnotit schopnost distálního nefronu resorbovat K.
TTKG = ([K+]moč / [K+]sérum) / (osmolalita moč / osmolalita sérum)
Interpretace hodnot: norma cca 7 – 8, při hypokalémii je fyziologickou odpovědí ledviny TTKG < 3 (K+ je výrazně resorbován), naopak při hyperkalémii je normální TTKG > 10 (K+ je vylučován). Hodnota < 7 při hyperkalémii může znamenat deficit mineralokortikoidů (i přes hyperkalémii je K+ málo vylučován a je proto jeho nízká koncentrace v moči).
CAVE Použitelné pouze při Uosm >300 mosmol/l a UNa > 25 mmol/l.
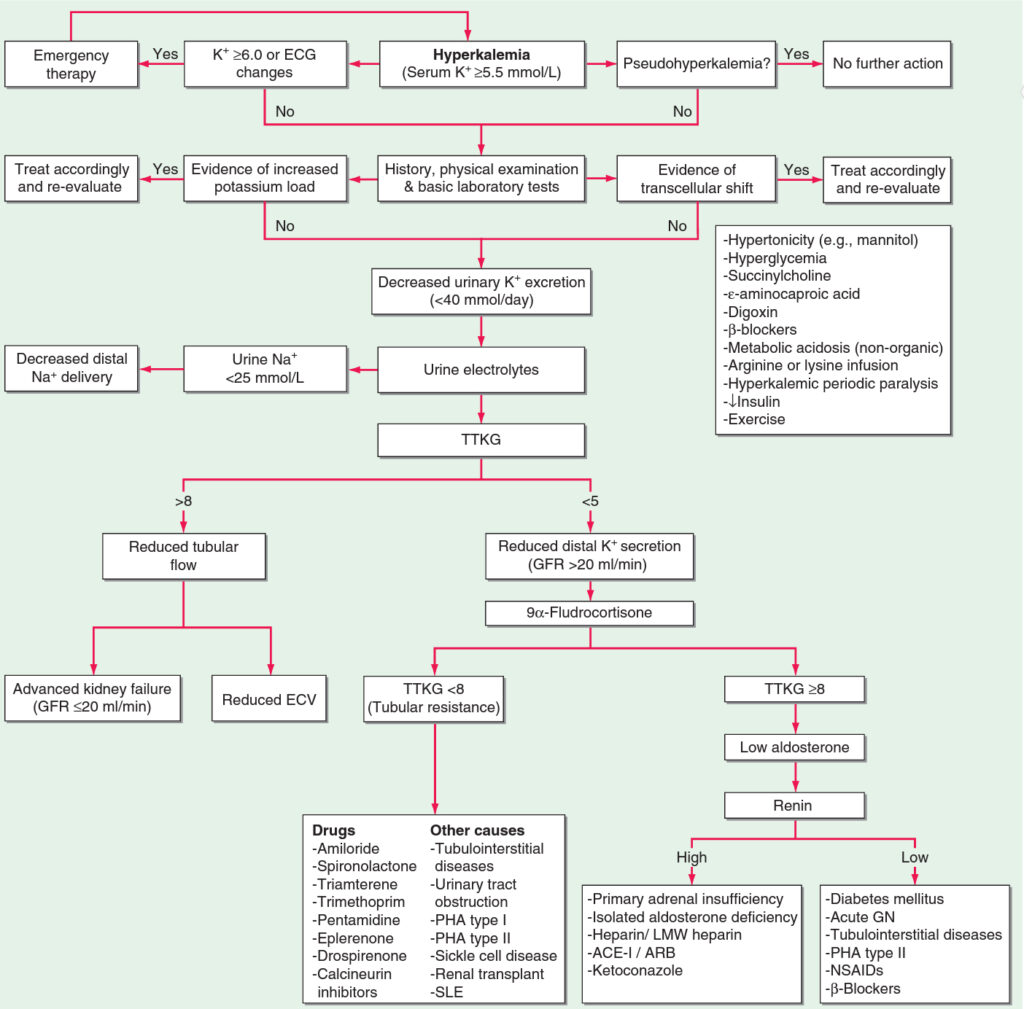
Diagnostika hyperkalémie – kroky:
- 1. Urgentnost hyperkalémie – je hyperkalémie > 6,5 mmol/l, popřípadě jsou přítomny EKG změny? Pak nediagnostikujeme a primárně zachraňujeme pacienta akutní hemodialýzou.
- 2. Je přítomna pseudohyperkalémie??
- 3. Vyloučení redistribuce (zejména acidóza, dále beta blokátory, digoxin, hyperglykémie, příjem hypertonických roztoků) a vysokého příjmu příjmu.
- 3. Koncentrace draslíku v moči
- nízká (< 40 mmol/d) – stanovení iontů v moči a změření TTKG:
- Na+ v moči < 25 mmol/l – chybí motor pro vylučování draslíku močí (hypovolémie) – nutná volumová resuscitace event. doplněná o podání furosemidu.
- TTKG > 8 – nízký tubulární průtok při hypovolémii nebo pokročilém renálním selhání.
- TTKG < 5 při GF > 0,35 ml/s – podáme fludrokortizon
- TTKG zůstává < 8 (nedochází ke zvýšení exkrece K+ při nedostatečné reakci tubulů na mineralokortikoid) – amilorid, spironolakton, pseudohypoaldosteronismus, tubulointersticiální choroby.
- TTKG stoupá > 8 (tubuly na mineralokortikoid zareagují): Odebereme renin:
- nízký – hyporeninemický hypoaldosteronismus.
- vysoký – deficit aldosteronu, inhibice syntézy aldosteronu (ketokonazol, ACEI/sartany).
- nízká (< 40 mmol/d) – stanovení iontů v moči a změření TTKG:
Terapie
I. Stanovení urgentnosti terapie – urgentní terapii za hospitalizace vyžadují pacienti s kalémií > 6,5 mmol/l. Rozhodující je vlastní hladina kalémie a EKG změn.
II. Farmakoterapie
1. Antagonizace účinku hyperkalémie na srdce
Kalcium – intravenózní podání kalcia má při hyperkalémii bezprostřední kardioprotektivní účinek. Zvyšuje excitační práh, snižuje dráždivost beze změny klidového membránového potenciálu a mírní hyperkalemickou blokádu depolarizace. Doporučená dávka je 10 ml 10 % calcium chloratum/gluconicum během 2-3 minut za srdeční monitorace. Pokud EKG změny nezmizí nebo recidivují, je možné dávku opakovat. Účinek začíná za 1 – 3 minuty a trvá 30 – 60 minut.
CAVE Hyperkalcémie zhoršuje kardiotoxicitu digoxinu. U pacientů užívajících digoxin by se kalcium mělo podávat velmi pomalu a opatrně.
2. Redistribuce draslíku intracelulárně
Inzulín – inzulín přesouvá K+ dovnitř buněk. Vhodná dávka je 500 ml 10 % glukózy (50 g) s 10 jednotkami inzulínu. U pacientů s glykémií vyšší než 12 mmol/l by měl být podán inzulín bez glukózy. Účinek začíná za 10 – 20 minut, vrcholí za 30 – 60 minut a trvá 4 – 6 hodin.
CAVE Podání samotné hypertonické (40 %) glukózy bez inzulínu je kontraindikováno, protože její osmotický efekt může vést k akutnímu zhoršení hyperkalémie.
β2 sympatomimetika – podceňovaný způsob léčby hyperkalémíe je použití β2 sympatomimetik (nejčastěji albuterolu), které mají s inzulínem aditivní účinek. Cca 20 % pacientů v end-stage nefropatii je k albuterolu rezistentních. Doporučená dávka je 10 – 20 mg nebulizovaného albuterolu ve 4 ml fyziologického roztoku inhalovaného cca 10 minut. Vedlejším účinkem je hyperglykémie a tachykardie. Účinek začíná za 30 minut, vrcholí za 90 minut a trvá 2 – 6 hodin.
CAVE Použití je třeba důkladně zvážit u pacientů s chorobami srdce.
Bikarbonát – intravenózní bikarbonát nemá v léčbě akutní hyperkalémie žádnou roli, ale pokud je podáván z jiné indikace, může vést k pomalému snížení kalémie (po 4 – 6 hodinách aplikace). Pro riziko indukce hypernatrémie by měl být podán v izotonickém nebo hypotonickém roztoku.
3. Eliminace draslíku
Calcium resonium – nevstřebatelný iontoměnič, který v gastrointestinálním traktu směňuje K+ a Ca2+ a zvyšuje tak fekální sekreci draslíku (k dispozici je i iontoměnič směňující K+ a Na+). Podává se 15 g perorálně nebo 30 g ve formě retenčního klyzmatu 4x denně. Dosažení plného efektu může trvat až 24 hodin. Nejzávažnější komplikací je nekróza ilea nebo tlustého střeva, která bývá většinou fatální (ohroženi jsou zejména pacienti s porušenou motilitou střeva, např. pooperačně nebo při léčbě opiáty, zejména při podání formou klyzmatu), proto je aplikaci iontoměničů třeba důkladně zvážit.
Sodík – fyziologický roztok je vhodný zejména u pacientů s hypovolémií a oligurií, u kterých chybí dostatek Na+ iontů v distálním nefronu, což je spojeno se sníženou renální exkrecí K+.
Diuretika – thiazidy a kličková diuretika jsou vhodná u normo-, nebo hypervolemických pacientů se zachovalou funkcí ledvin. K zachování euvolémie bývá často nutné podání krystaloidů.
III. Hemodialýza – nejefektivnější metoda léčby hyperkalémie (peritoneální dialýza je méně účinná a v akutní léčbě hyperkalémie nemá místo). K provedení hemodialýzy je nutné zajištění dobrého žilního přístupu (kanylace centrální žíly nebo přítomnost A-V shuntu).