Základní parametry acidobazické rovnováhy (ABR)
- pH = 7,36 – 7,44
- PCO2 = 4,6 – 6,0 kPa
- aktuální HCO3– = 22 – 26 mmol/l
- BE = -2,5 – +2,5 mmol/l (= množství silných kyselin nebo bází, kterými je nutno titrovat 1 litr plasmy do pH 7,4 při PCO2 5,3 kPa a teplotě 37 °C)
Aktivita H+ iontů v organismu je velmi nízká (40 nmol/l), proto se vyjadřuje v jednotkách pH (záporný dekadický logaritmus molární aktivity H+). Jelikož se tato aktivita může velice rychle měnit, existují tzv. nárazníkové systémy, které slouží k udržování stálosti vnitřního prostředí a tlumí tyto změny. Jsou složeny ze slabé kyseliny a její soli. Slabá kyselina disociuje v roztoku nepatrně, její sůl disociuje prakticky úplně. Slabá kyselina a její sůl mají stejnou silnou konjugovanou bázi (např. HCO3–), partnerem těchto silných konjugovaných bází je buď vázaný vodíkový iont, jde-li o kyselinu (např. H2CO3) nebo volný kation (Na+, K+, Ca2+, Mg2+), jde-li o bázi (např. Na+ + HCO3–). Mírou disociace kyseliny je hodnota pK, což je záporný dekadický logaritmus disociační konstanty kyseliny (čím je kyselina silnější, tím více disociuje, tím vyšší koncentrace H+ je přítomno, tím nižší je pK jako záporný dekadický logaritmus). Tyto děje popisuje Henderson – Hasselbachova rovnice:
pH = pK + log sůl/kyselina
Nárazníkové systémy:
1. Hydrogenuhličitanový iont 53 % – tvoří sůl převážně s Na+, jeho varianta HH rovnice:
pH = 6,1 + logHCO3–/PaCO2 ∙ 0,23
[HCO3–] – metabolická složka, [H2CO3] – respirační složka – lze nahradit hodnotou PCO2 · s (koeficient rozpustnosti – pro PCO2 v kPa je tento koeficient 0,23)
H2CO3 může volně disociovat: CO2 + H2O → H2CO3 → H+ + HCO3–.
2. Systém hemoglobin – oxyhemoglobin 35 % – jde o systém dvou kyselin, kde oxidovaný hemoglobin je silnější, proto proton odštěpuje. Deoxidovaný hemoglobin je slabší kyselina, která proton váže.
3. Systém plazmatických bílkovin 7 % – plazmatické bílkoviny mají negativní náboj (anionty), jsou schopné vázat protony (báze).
4. Systém fosfátů 5 % – uplatňuje se především intracelulárně. V acidóze protony váže a uvolňuje K+, v alkalóze protony uvolňuje a K+ naopak váže.

Vývoj acidobazických poruch
1. Nárazníková reakce – probíhá okamžitě při vzniku poruchy. Mění se při ní vždy jedna složka nárazníkové dvojice báze:kyseliny. U metabolických poruch se mění hodnota celkových bází, tzv. base excess (acidóza – snižuje se, alkalóza – zvyšuje se). U respiračních poruch se naopak mění PCO2 a nemění se BE (s výjimkou těžké respirační acidózy, kdy vzniká laktát a BE klesá také). Např. při náloži většího množství kyseliny se vzniklé H+ vážou na HCO3– za vzniku H2CO3, který se mění na CO2 (vydýchán) a vodu.
2. Kompenzační reakce – dochází ke změně druhé složky nárazníkové reakce, která se nezměnila při nárazníkové reakci se snahou o návrat k pH 7,4. Toto vyjadřuje graf acidobazické regulace. Kompenzaci metabolických poruch zajišťují plíce, kompenzaci respiračních poruch zajišťují ledviny. Jinak řečeno, kompenzační odpověď působí proti primární poruše vyvolávající acidobazickou nerovnováhu, ale nikdy nekompenzuje poruchu zcela s jedinou výjimkou, kdy chronická respirační alkalóza je metabolickou složkou často zcela normalizována. Např. u příkladu z bodu 1 dochází k hyperventilaci a snižuje se hladina CO2, který je zdrojem H2CO3.
- Metabolická acidóza – hyperventilace plic s poklesem PCO2.
- Metabolická alkalóza – hypoventilace plic se vzestupem PCO2 Vznik hyperkapnie je signálem k obnovení ventilace (organismus dává přednost alkalóze před hypoxii).
- Respirační acidóza – retence a generace HCO3– a zvýšené exkrece H+ a Cl–.
- Respirační alkalóza – vylučování HCO3– a retence H+ a Cl–.
3. Korekce poruchy – úprava té složky nárazníkové reakce, která se změnila při nárazníkové reakci. Korekci metabolických poruch zajišťují ledviny (acidifikace při alkalóze, alkalizace při acidóze), korekcí respiračních poruch je úprava pCO2 (např. pomocí umělé plicní ventilace). V našem případě ledviny vyloučí nadbytek H+ formou NH4+.
Primární poruchy ventilace (změny PaCO2) vyvolávají kompenzační metabolickou odpověď (sekundární změny HCO3–) a naopak, primárně metabolické poruchy působí sekundární změnu ventilace.
Metabolická acidóza při zvýšení endogenních aniontů (např. ketoacidóza) snižuje koncentraci HCO3– a tak i pH. Toto stimuluje míšní chemoreceptory a zvyšuje ventilaci, tak aby pokles PaCO2 vyrovnával vzniklý pokles HCO3– (jak již řečeno, kompenzace není úplná).
Očekávaný stupeň respirační kompenzace lze predikovat ze vztahu: PaCO2 = [(1,5 ∙ HCO3–) + 8] · 0,133
Např. u pacienta s HCO3– = 12 mmol/l lze očekávat PaCO2 3,45 kPa. Pokud je např. hodnota nižší, lze předpokládat smíšenou poruchu (respirační alkalózu).
Jinými slovy, při kompenzaci dochází ke změně druhého partnera z dvojice (PaCO2 x HCO3–) stejným směrem (např. pokles HCO3– při metabolické acidóze je následováno poklesem PaCO2). Pokud je reakce jiná, lze očekávat smíšenou poruchu. K predikci poruchy lze použít acidobazický normogram.

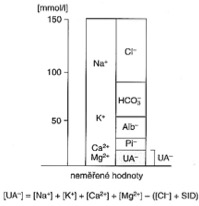
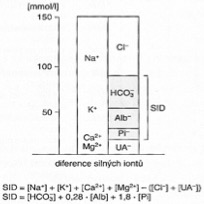
Iontové systémy a acidobazická rovnováha – ideální je postup podle P. A. Stewarta a V. Fencla, podle kterých je stav ABR určován nezávisle proměnnými veličinami. Mezi ně patří:
- pCO2
- SID (norma 37 – 41 mmol/l) = (Na+, K+, Ca2+, Mg2+) – (Cl–, UA–), často nelze v praxi určit (zejména UA–)
= HCO3– + 0,28 · albumin + 1,8 · anorganický fosfát (suma HCO3– + albumin + anorganický fosfát)
- neměřené anionty (UA–, norma 6 – 10 mmol/l) = (Na+, K+, Ca2+, Mg2+) – (Cl–, SID). Patří sem laktát, 3-hydroxybutyrát, acetacetát, endogenní anionty, resp. ostatní anionty např. při otravách apod. CAVE Při dysnatrémii se hodnota koriguje UA–korig = UA– · 140/Na+zjišť.
- anion gap (AG, norma 8 – 16 mmol/l) – zachycuje přibližně sumu UA– + anorganický fosfát + albumin, = Na+ + K+ – (Cl– + HCO3–).
CAVE Hodnota se snižuje při hypoalbuminémii, kdy místo albuminu ve sloupci aniontů obsazuje HCO3–. Poklesem albuminu o 1 g/l se vytvoří prostor pro zvýšení HCO3– o 0,25 mmol/l. Korekce na hodnotu hypoproteinémie: AGkorig = AG + 0,25 · (44 – albuminzjišť.)
Poruchy acidobazické rovnováhy mívají často více příčin, které se potencují a pH tak může dosáhnout nebezpečných hodnot, např.:
- při diabetické ketoacidóze může vzniknout nezávislý nebo preexistující respirační problém (např. CHOPN nebo pneumonie) s rozvojem respirační acidózy
- naopak, pokud je u jednoho pacienta metabolická acidóza a současně metabolická alkalóza jiné příčiny, je výsledné pH normální
Vždy je potřeba porovnávat hladinu pH, albuminu, anion gap (AG). Příklady smíšených poruch:
- pokud jsou pH i sérová hladina albuminu normální (cca 45 g/l) a současně zvýšený anion gap (AG), lze spolehlivě říci, že je přítomna metabolická acidóza
- diabetici s ketoacidózou mohou mít současnou diabetickou nefropatii, která acidózu dále zhoršuje
- při otravě salicyláty a sedativy dochází k metabolické acidóze díky salicylátům a současné respirační acidóze z útlumu dechového srdce s hypoventilací díky sedativům
- pacienti s alkoholickou ketoacidózou (metabolická acidóza) mohou zvracet (metabolická alkalóza) a hyperventilovat při jaterní dysfunkci nebo abstinenčním syndromu respirační alkalóza

Diagnostika poruch ABR
1. Stanovení krevních plynů, elektrolytů, albuminu – prvním krokem je stanovení elektrolytů a krevních plynů ještě před zahájením léčby.
2. Vyloučení přítomnosti laboratorní chyby – jako kontrolu správnosti odběru lze použít HCO3–. pH a PaCO2 lze stanovit přímo laboratorně a koncentraci HCO3– následně spočítat z Henderson-Hasselbachovy rovnice. Tato hodnota by měla být srovnána se změřenou hodnotou HCO3–. Obě hodnoty by se neměly lišit o více než 2 mmol/l. Přo větším rozdílu lze předpokládat laboratorní chybu.
3. Stanovení anion gap (AG) – odpovídá přítomnosti neměřitelných iontů, norma je 8 – 16 mmol/l. Výpočet: AG = Na+ + K+ – Cl– – HCO3–
**AG se zvyšuje při:
- 1. Zvýšení koncentrace aniontů:
- organických (laktát, acetoacetát, uremické organické anionty)
- anorganických (fosfát, sulfát)
- exogenních (salicyláty nebo neidentifikované anionty)
- albuminu (aniont) nebo jeho ionizace při alkalóze
- 2. Vzácně při snížení extracelulárních kationtů (K+, Ca2+ nebo Mg2+)
Hlavními čtyři příčiny high-AG metabolické acidózy:
- ketoacidóza
- laktátová acidóza
- selhání ledvin
- intoxikace
**AG se snižuje při:
- 1. Zvýšení koncentrace kationtů – K+, Ca2+, Mg2+, guanidiny u CKD, lithium, imunoglobulinů (choroby plazmocytů).
- 2. Snížení koncentrace aniontů, zejména albuminu (např. při nefrotickém syndromu, jaterní cirhóze apod.). Pokles koncentrace albuminu o 10 g/l = snížení AG o 2,5 mmol/l: AGkorig = AG + 0,25 · (44 – albuminzjišť.).
- hyperviskozitě nebo těžké hyperlipidémii (pseudohyponatremie a pseudohypochloremie).
Hlavní dvě příčiny metabolické acidózy s normálním AG mají společnou ztrátu bikarbonátu:
- gastrointestinálním traktem
- ledvinami (renální tubulární acidóza)
4. Zhodnocení respirační kompenzace PaCO2 = [(1,5 ∙ HCO3–) + 8] · 0,133 k určení smíšené poruchy,
5. Korekce chloridů – při hyponatrémii (nadbytku vody) se chlorémie sníží buď úměrně s poklesem natrémie nebo relativně více, či méně, jak je uvedeno výše. Samotný pokles koncentrace silných iontů snižuje i prostor pro HCO3– a vzniká acidóza z nadbytku vody. Je-li za této situace pokles Na+ relativně výraznější než pokles Cl– je prostor pro HCO3– snížen ještě více a příčinami acidózy jsou jak nadbytek vody, tak nadbytek Cl–. Naopak, je-li při hyponatrémii pokles Cl– ještě výraznější, vytváří to větší prostor pro HCO3– a mírní nebo ruší účinek acidózy z nadbytku vody. Zrcadlové situace nastávají při nadbytku vody. Zjištěnou hodnotu je tedy nutno korigovat: Cl–korig = Cl–zjišť · 140/Na+zjišť
6. Zhodnocení delta ratio ΔAG/ΔHCO3=(AG – 12)/(HCO3 – 24) – lze použít, pokud se chceme rozhodnout, zda je přítomna čístá high-AG MAc nebo smíšená porucha (+ non-high AG MAc nebo MAlk). Pokud je přidána jedna molekula kyseliny do extracelulární tekutiny, je uvolněn jeden H+, který je neutralizovám pomocí HCO3– za vzniku CO2 + H2O. Dochází tedy k vzestupu UA– a tedy i AG a poklesu HCO3–. Pokud je ΔAG (aktuální AG – fyziologické AG, tedy 12 mmol) výrazně vyšší, než ΔHCO3– (aktuální ΔHCO3– – fyziologické ΔHCO3–, tedy 24 mmol), je přítomna smíšená high AG MAc + normal AG MAc/MAlk.
Interpretace delta ratio:
- < 0,4 čistá normal-AG MAc
- 0,4 – 0,8 smíšená normal-AG MAc a high-Ag MAc
- 0,8 – 2,0 čistá high-Ag MAc
- >2.0 smíšená high-Ag MAc a MAlk
Např. Alkoholik, který zvrací, může mít hypochloremickou metabolickou alkalózu (pH 7,55), PaCO2 (6,2 kPa) a HCO3– 40 mmol/l, Na+ 135 mmol/l, Cl– 80 mmol/l a K+ 2,8 mmol/l. Pokud se u tohoto pacienta vyvine i alkoholická ketoacidóza s koncentrací β-hydroxybutyrátu 15 mmol/l, klesá pH na 7,4, hladina HCO3– na 25 mmHg a PaCO2 na 5,3 kPa. Přestože jsou krevní plyny normální, je AG = 30 mmol/l (tedy zvýšené), a indikuje kombinovanou high-AG acidózu a metabolickou alkalózu. Tato eventualita je snadno identifikovatelná srovnáním diferencí (Δ hodnot), v tomto případě ΔHCO3– je 0 (25-25 mmol/l), ale ΔAG je 20 (30 – 10 mmol/l). Proto není hodnota 20 mmol/l započítána do poměru Δ/Δ (ΔAG/ΔHCO3–).
Metabolická acidóza
Patofyziologie – velmi zjednodušeně, k metabolické acidóze dochází při zvýšení koncentrace endogenních kyselin (laktátová acidóza, ketoacidóza), snížení jejich exkrece (renální selhání), dále zvýšení koncentrace exogenních kyselin (intoxikace) nebo ztrátě bikarbonátu (průjem).
Klinický obraz – pokles pH je spojen s
- typickým nárůstem ventilace (Kussmaulovo dýchání)
- poklesem kontraktility myokardu (může být kompenzováno zvýšením katecholaminů)
- periferní vazodilatací a centrální venokonstrikcí s hlavní manifestací v plicích (tendence ke vzniku plicního edému i při minimální hypervolémii) a mozku (bolesti hlavy, letargie, kvalitativní a kvantitativní poruchy vědomí až kóma, predispozice k edému mozku)
Terapie – léčba metabolické acidózy podáním alkalizačních látek by měla být vyhrazena jen pro případy těžké acidémie s výjimkou plazmatického deficitu „potenciálního HCO3–“, kdy by HCO3– měl být podán vždy.
Deficit lze odhadnout z přírůstku AG (ΔAG = AGzměřený – 10) při přítomnosti metabolizovatelných (např. β-hydroxybutyrát, acetoacetát a laktát) i nemetabolizovatelných plazmatických aniontů (např. při chronickém renálním selhání nebo intoxikaci).
K úpravě deficitu NaHCO3– při renálním selhání je potřeba restituce funkce ledvin. Alkalizace je indikována při MAc s normálním AG při hyperchloremické acidóze), mírně zvýšeným AG (smíšená hyperchloremická a high-AG acidóza) nebo vysokém AG při renálním selhání. Dávka by měla odpovídat navýšení koncentrace NaHCO3– na úroveň 20 – 22 mmol/l, vždy je nutné se vyvarovat „přestřelení“ do metabolické alkalózy.
Kontroverzní je použití alkalizace u pacientů s čistou AG při akumulaci metabolizovatelných aniontů (ketoacidóza nebo laktátová acidóza). Obecně, při těžké acidóze (pH < 7,1) je v úvodu indikováno i.v. podání 50 – 100 mmol NaHCO3 na 30 – 45 minut. Vždy je nutné sledovat kalémii, které může při vzestupu pH klesat. V tomto případě je cílem vzestup HCO3–na 10 mmol/l a pH na cca 7,2, tedy nikoliv k normálním hodnotám.
Alkalizace = hyperchloremická acidóza, renální selhání, ostatní v případě těžké acidózy k inkompletní korekci pH.
Přístup k pacientovi s high-AG metabolickou acidózou
Metabolická acidóza s vysokým anion gap může mít čtyři základní příčiny: laktátovou acidózu, ketoacidóza, acidóza polékovou nebo při intoxikacích a renální selhání.
Při úvodním vyšetření je nutné stanovit krevní plyny k detekci současné respirační složky, anamnézu intoxikace léky, alkoholismu, přítomnost diabetu (diabetická ketoacidóza) nebo renálního selhání (uremická acidóza), pátrání po přítomnosti krystalů oxalátu v moči (intoxikace etylenglykolem) a rozpoznání chorob, jejichž součástí je laktátová acidóza (hypotenze, šok, srdeční selhání, leukémie, onkologické onemocnění nebo požití některých léků nebo toxinů).
1. Laktátová acidóza – lze rozlišit dva typy:
- Hypoxická (typ A) při tkáňové hypoxii, např. šok, srdeční selhání, těžká anémie, genetické defekty, inhibice mitochondriálních enzymů (intoxikace CO nebo kyanidy), infarkt střeva.
- Nehypoxická (typ B) bez tkáňové hypoxie, např. malignity, diabetes mellitus, selhání jater/ledvin, deficit thiaminu, infekce (cholera nebo malárie), křeče, vedlejší účinek léků a toxinů (inhibitory reverzní transkriptázy, biguanidy, metanol, etanol, propylenglykol, isoniazid a fruktóza).
- Pyroglutamátová acidóza u kriticky nemocných pacientů (mají deficit glutationu) léčených paracetamolem.
- D-laktátová acidóza, kdy je D-laktát produkován střevními bakteriemi, proto se může vyskytnout u pacientů s jejunoileálním bypassem, syndromem krátkého střeva nebo střevní obstrukcí.
Terapie
- Úprava poruchy vyvolávající zvýšenou hladinu laktátu. V případě typu A zlepšit perfúzi tkání, pokud možno se vyhnout vazokonstrikčním látkám, které tkáňovou ischémii dále zhoršují).
- Podání bikarbonátu při akutní, těžké acidémii (pH < 7,1), která zhoršuje kardiální funkci a prohlubuje laktátovou acidózu („circulus vitiosus“). Cílovou hodnotou pH alkalizační léčby NaHCO3 by mělo být cca 7,2.
CAVE U méně závažných forem je alkalizace neopodstatněná, protože podání bikarbonátu může laktátovou acidózu naopak dále zhoršovat (HCO3– stimuluje enzym fosfofruktokinázu anaerobní glykolýzy). Při podání NaHCO3– je třeba se vyvarovat „přestřelení“ do alkalózy a indukci hypervolémie, ke které jsou pacienti s metabolickou acidózou velmi náchylní.
2. Ketoacidóza – lze rozlišit dva typy:
a) Diabetická ketoacidóza vzniká u inzulín-dependentního diabetes mellitus následkem náhlého vysazení inzulínu nebo nárůstem jeho potřeby při interkurentním onemocnění (infekce, gastroenteritida, pankreatitida nebo AIM). Je způsobena zvýšením metabolismu mastných kyselin a akumulací ketolátek (acetoacetátu a β-hydroxybutyrátu). Akumulace ketolátek zvyšuje AG, spojena s hyperglykémií (obvykle > 17 mmol/l). Terapie:
- Základem je aplikace inzulínu.
- Bikarbonát indikován až při extrémní acidémii (poměr ΔAG a ΔHCO3– při diabetické ketoacidóze bývá cca 1:1) s cílovou hodnotou pH cca 7,2.
- Korekce hypovolémie krystaloidy. Častou komplikací je přestřelení do hypervolémie nebo rozvoj hyperchloremické acidózy.
b) Alkoholická ketoacidóza – rozvíjí se při náhlém odnětí alkoholu u chronických alkoholiků s malnutricí (častěji při záchvatovitém pití). Bývá provázena hladověním, zvracením a břišní bolestí. Glykémie v séru bývá variabilní, vždy jsou zvýšeny hladiny ketolátek, zejména β-hydroxybutyrátu. Po zaléčení hypovolémie fyziologickým roztokem se hlavní ketolátkou stává acetoacetát. Funkce ledvin při alkoholické ketoacidóze bývá často v normě (na rozdíl od diabetické ketoacidózy, při které často bývají renální funkce postiženy současnou hypovolémii při osmotické diuréze a diabetickou nefropatii). Pacienti se zachovalou funkcí ledvin mohou vylučovat velké množství ketolátek močí, což vysvětluje relativně normální AG a diskrepanci v poměru ΔAG a ΔHCO3–. Průběh bývá komplikován krvácením z horních partií GIT, pankreatitidou nebo pneumonií. Porucha je často smíšená, součásti bývá laktátová acidóza při hypoperfúzi tkání, metabolická alkalóza při zvracení (důležité je posouzení poměru ΔAG a ΔHCO3–), chronická respirační alkalóza může provázet jaterní choroby. Léčba:
- Korekce hypovolémie fyziologickým roztokem nebo 5 % glukózou.
- Korekce iontových poruch (častá je hypofosfatémie, hypokalémie a hypomagnezémie), kritická je zejména korekce hypofosfátemíe do 12 – 24 hodin po přijetí, protože může být dále zhoršena podáním glukózy, a pokud je závažná, může vést k rabdomyolýze nebo dechové zástavě).
- Léčba komplikací.
3. Acidóza poléková nebo při intoxikacích
Osmolar gap – osmolalitu plazmy podmiňuje zejména Na+, urea a glukóza. Má normální hodnotu cca 275 – 295 mOsm/l. Lze ji vypočítat ze vzorce: Posm = 2 · [Na+] + [glukóza] + [urea].
Rozdíl mezi změřenou a vypočítanou osmolalitou se označuje jako osmolar gap (osmolární okno) a činí maximálně 10 – 15 mOsm/l: Osmolar gap = osmzměřená – osmvypočítaná.
Při osmolar gap > 10 – 15 mOsm/l může dojít ke dvěma situacím:
- vzniká pseudohyponatrémie, kdy koncentrace Na+ je velmi nízká při hyperlipidémii nebo hyperproteinémii
- v krvi jsou přítomny ještě jiné osmoticky aktivní látky, např. manitol, radiokontrastní látky, etanol, izopropylalkohol, etylenglykol, propylenglykol, metanol a aceton. Osmolar gap je tedy vhodné jako prvotní screening intoxikace osmoticky aktivními látkami. Z těchto osmoticky aktivních látek je nejnebezpečnější intoxikace etylenglykolem, metanolem a izopropylalkoholem. Etylenglykol a metanol navíc působí i high-AG metabolickou acidózu.
a) Salicyláty – při intoxikaci salicyláty dochází většinou k respirační alkalóze nebo smíšené poruše (high-AG metabolická acidóza + respirační alkalóza). Často se zvyšuje i produkce laktátu. Excesivní neměřitelné ztráty vody mohou působit hypovolémii, hypernatrémii a renální selhání. Léčba:
- Dostatečná laváž žaludku izotonickým fyziologickým roztokem (nikoliv NaHCO3), po které je nutné aplikovat carbo adsorbens.
- Při metabolické acidóze bez respirační alkalózy je k usnadnění eliminace salicylátů vhodná alkalizace moči (intravenózní NaHCO3) s cílovým pH moči 7,5) a zachováním dostatečné diurézy. Při současné respirační alkalóze je tento postup rizikový a kontraindikovaný, podobně při hypervolémii, v tom případě lze použít acetazolamid. Následkem alkalizace vzniká hypokalémie, kterou je třeba očekávat a včas léčit.
- Pro častou hypoglykémii je vhodné aplikovat i krystaloidy s obsahem glukózy.
- Při renálním selhání je indikována hemodialýza s bikarbonátovým dialyzačním roztokem.
laváž žaludku + carbo adsorbens, alkalizace moči event. acetazolamid
b) Etylenglykol – etylenglykol je součástí nemrznoucích směsí, jejichž požití vede k metabolické acidóze a těžkému poškození CNS, srdce, plic a ledvin. Zvyšuje se AG i osmolar gap, což odpovídá přítomnosti nejen etylenglykolu ale i jeho metabolitů (zejména kyselině oxalové a glykolové). Důsledkem intoxikace je inhibice Krebsova cyklu a intracelulárních oxidačně-redukčních pochodů se zvýšením produkce laktátu. Typická je přítomnost oxalátových krystalů v moči a vysoké osmolar gap i high-AG metabolická acidóza.
CAVE Při podezření na tuto otravu (vysoké osmolar gap + high-AG acidóza) by se mělo cíleně pátrat po intoxikaci etylenglykolem a zahájení terapie by nemělo být zdrženo čekáním na výsledek toxikologie. Léčba:
- Rehydratace fyziologickým roztokem nebo osmotickým diuretikem.
- Suplementace thiaminu a pyridoxinu.
- Zásadní při závažné intoxikaci je aplikace inhibitoru alkohol dehydrogenázy fomepizolu (4-metylpyrazol, 15 mg/kg jako úvodní dávka) jako antidota. Při nedostupnosti indikováno intravenózní podání etanolu s cílovou hladinou v krvi 1 ‰ (fomepizol i etanol snižují toxicitu etylenglykolu, protože s ním kompetují o alkohol dehydrogenázu).
- Hemodialýza je indikována při arteriálním pH < 7,3 nebo osmolar gap > 20 mOsm/kg.
rehydratace + thiamin a pyridoxin + ethanol a fomepizol + hemodialýza
c) Metanol – požití metanolu vede k high-AG metabolické acidóze a zvýšení osmolar gap. Jeho metabolity formaldehyd a kyselina mravenčí působí poškození optického nervu a CNS. Acidózu často prohlubuje současná produkce laktátu a ketolátek. Terapie je stejná jako v případě intoxikace etylenglykolem.
d) Propylenglykol – vehikulum užívané v i.v. formách některých léků, např. diazepamu, fenytoinu, etomidátu, nitroglycerinu, lorazepamu, fenobarbitalu a enoximonu. Toxicita se projevuje high-AG metabolickou acidózou, hyperosmolaritou, obecnými příznaky metabolické acidózy a byla zaznamenána v intenzivní péči při častém nebo kontinuálním užívání jmenovaných léků. Propylenglykol je metabolizován alkohol dehydrogenázou. Prvním opatřením je zastavení aplikace léků s tímto vehikulem, při těžkém průběhu je ke zvážení aplikace fomepizolu.
e) Izopropylalkohol – bývá součástí chirurgické dezinfekce, rozpouštědel nebo odmrazovačů. Požití > 150 ml nebo plazmatická koncentrace > 4 ‰ může být život ohrožující. Toxický je vlastní izopropylalkohol, nikoliv jeho metabolity. Alkohol dehydrogenázou je metabolizován na aceton. Často je současně přítomná i hypoglykémie. Základními biochemickými příznaky intoxikace je: vysoké osmolar gap, nepřítomnost high-AG metabolickou acidózy (na rozdíl od intoxikace etylenglykolem a metanolem), protože aceton je rychle eliminován. Léčba:
- Základem je observace a podpůrná terapie (infuze, ventilační podpora, vazopresory…).
- Při závažném průběhu otravy (kóma, hemodynamická nestabilita, plazmatická koncentrace > 4 ‰) je indikována hemodialýza.
f) Kyselina pyroglutamová – k akumulaci 5-oxoprolinu může vzácně docházet u kriticky nemocných nebo malnutrických pacientů, kteří jsou léčeny paracetamolem. Je přítomna „nevysvětlitelná“ high-AG metabolická acidóza s normálním osmolar gap. Léčba:
- Okamžité přerušení podávání paracetamolu
- Bikarbonát i.v.
- Podání N-acetylcysteinu je sporné pro nejistý účinek.
4. Acidóza při renálním selhání – hyperchloremická acidóza při mírných stupních renální insuficience se s progredující renální dysfunkcí a zmenšujícím se množstvím funkčních nefronů mění v high-AG uremickou metabolickou acidózu, která je způsobena nemožností exkrece organických aniontů s kompenzačním snížením produkce a exkrece NH4+. Retinovaná kyselina při renálním selhání je neutralizována HCO3– a alkalickými solemi pocházejícími z kostní hmoty (zejména kalcium karbonát) → její ztráta při chronické metabolické acidóze. Kostní metabolismus je dále zhoršen hyperkalciurií, přímo úměrné retenci kyselin. Při hyperchloremické i uremické acidóze indikována alkalizační léčba NaHCO3 s cílovou koncentrací HCO3– > 22 mmol/l (většinou postačuje poměrně malá dávka alkálií, 1,0 – 1,5 mmol/kg denně).
Přístup k pacientovi s non-high-AG metabolickou acidózou
Alkalické látky se ztrácí nejčastěji gastrointestinálním traktem (průjem) nebo ledvinami (renální tubulární acidóza). Při těchto poruchách dochází k reciproční změně koncentrace Cl– a HCO3– a AG proto zůstává normální. Při čisté non-AG acidóze tak nárůst koncentrace HCO3– odpovídá poklesu koncentrace Cl–. Cokoliv jiného naznačuje přítomnost smíšené acidobazické poruchy.
1. Ztráta HCO3– gastrointestinálním traktem
a) Průjem – při průjmu může docházet k hypovolémii, hypokalémii a při vysokém obsahu HCO3– ve stolici i k metabolické acidóze. V ledvinách se kompenzačně syntetizuje a vylučuje NH4+ s nárůstem pH moče (obvykle > 6). Tím se odlišuje od renální tubulární acidózy, při které je exkrece NH4+ močí typicky nízká. Hladina NH4+ v moči lze odhadnout pomocí anion gap v moči (UAG). UAG = [Na+ + K+]moč – [Cl–]moč
Pokud je [Cl–]moč > [Na+ + K+]moč je UAG negativní, což znamená, že hladina amoniaku v moči je zvýšená a je přítomna extrarenální příčina acidózy. A naopak, při pozitivním AG lze předpokládat, že příčina acidózy je renální.
2. Ztráta HCO3– ledvinami
a) Proximální renální tubulární acidóza (typ 2) – způsobena generalizovanou poruchou funkce proximálního tubulu. Typickým nálezem je Fanconiho syndrom (glykosurie + aminoacidurie + fosfáturie).
Laboratorní diagnostika = nízká HCO3– v plazmě + vysoká FEHCO3- v moči + kyselá moč (pH < 5,5).
CAVE Vzhledem k tomu, že se HCO3– v proximálním tubulu neresorbuje ani za normálních okolností se, může jeho substituce bikarbonátem zvýšit kaliurii se vznikem následné hypokalémie.
b) Klasická distální renální tubulární acidóza (typ 1) – většina pacientů má hypocitráturii a hyperkalciurii s následnou nefrolitiázou, nefrokalcinózou a kostní nemocí.
Typickým nálezem je hypokalémie + non-AG metabolická acidóza + nízká exkrece NH4+ močí + neadekvátně vysoké pH moči (pH ˃ 5,5).
c) Generalizovaná distální renální tubulární acidóza (typ 4) – funkce ledvin je různě porušená (např. koexistující diabetickou nefropatií, obstruktivní uropatií nebo chronickou tubulointersticiální chorobou). Hyperkalémie je vzhledem k renální funkci neadekvátně vysoká, protože ji dále zhoršuje acidóza a porucha exkrece draslíku. Vylučování NH4+ močí bývá také postiženo.
3. Ostatní příčiny
a) Hyporeninemický hypoaldosteronismus – působí non-AG metabolickou acidózu, nejčastěji u starších pacientů s diabetes mellitus nebo tubulointersticiální nemocí a renální insuficiencí. Laboratorní diagnostika = většinou CKD stupně IIIb – IV + mírná hyperkalémie (5,2 – 6,0 mmol/l) + metabolická acidóza. Hyperkalémie ani metabolická acidóza neodpovídá svojí intenzitou poškození ledvin. Často bývá přítomna hypertenze, event. městnavé srdeční selhání.
b) Účinek léků – non-AG metabolickou acidózu u pacientů s renální dysfunkcí mohou způsobit NSAID, trimetoprim, pentamidin a ACE inhibitory.
Metabolická alkalóza
Definice – metabolická alkalóza je dána zvýšením pH > 7,45, ↑ HCO3– a často i PaCO2 (kompenzatorní hypoventilace). CAVE:
- Často je provázena hypochlorémií a hypokalémií.
- Často se vyskytuje spolu s respirační acidózou nebo metabolickou acidózou.
Patogeneze – vzniká následkem:
- retence HCO3– (zvýšený příjem nebo zvýšená resorpce či snížení exkrece ledvinami).
- intoxikace alkáliemi.
- zvýšení exkrece nevolatilních kyselin (všechny mimo H2CO3), nejčastěji díky ztráty HCl zvracením a následné selhání ledvin a kompenzatorního zvýšení exkrece HCO3–. Děje se tak nejčastěji v terénu:
- Hypovolémie → ↓ GF + ↓ K+ a Cl–. Porucha je korigovatelná podáním NaCl a KCl.
- Autonomní hyperaldosteronismus → ↓ K+. Podání solných roztoků je neúčinné a ke korekci alkalózy je třeba i farmakologické nebo chirurgické intervence.
Diferenciální diagnostika – ke stanovení diagnózy je potřeba posoudit volumový status, krevní tlak, draslík v séru a aktivitu RAAS. Např.
- metabolická alkalóza + ↑ TK + ↓ K+ = nadbytek mineralokortikoidů (+ ↓ RAAS a normální Na+ a Cl– v moči u pacientů neužívajících diuretika)
- Metabolická alkalóza + normální TK + ↓ K+ + nepřítomnost otoků = Bartterův a Gittelmannův syndrom, deficit magnézia, zvracení, exogenní přívod alkalických látek nebo medikace diuretik. Důležité je stanovení koncentrace elektrolytů (zejména Cl–) a přítomnosti diuretik v moči:
- moč: ↑ Na+ a K+ + ↓ Cl– + alkalická moč = bezprostřední zvracení nebo užití diuretik, požití alkalických látek, Bartterův nebo Gittelmannův syndrom nebo deficit magnézia. Bartterův syndrom se od Gittelmannova odlišuje přítomnou hyperkalciurií.
- moč: ↓ Na+, K+, Cl– v kyselé moči = předchozí zvracení nebo požití diuretik, stav po respirační acidóze (posthyperkapnický stav) = následek kompenzace.
Etiologie
1. Zvýšený příjem alkálií – u zdravých jedinců s normální funkcí ledvin je velmi vzácnou příčinou metabolické alkalózy. Častěji může vzniknout při současné poruše ledvin (překročení exkreční kapacity) a podávání různých alkalizačních látek: HCO3–, acetát (parenterální hyperalimentační roztoky), citrát (transfúze), antacida + iontoměniče při hyperkalémii (hydroxid hlinitý + kalcium resonium).
2. Metabolická alkalóza při hypovolémii, hypokalémii a sekundárním hyperreninemickém hyperaldosteronismu
a) Zvracení, odsávání žaludečního obsahu nazogastrickou sondou – Ztráty H+ vedou k retenci HCO3–. Během zvracení se poměry v ledvinách mění:
- v průběhu zvracení se výrazně zvýší filtrovatelné množství HCO3– proximálním tubulem, které překročí reabsorpční schopnost ledvin a zvýší se jeho vylučování ledvinami. Moč se tak stává alkalickou s vysokou koncentrací K+.
- po ústupu zvracení přetrvává hypovolémie, hypokalémie, hypochlorémie a metabolická alkalóza, protože proximální tubulus je stále „nastaven“ na zvýšenou reabsorpci HCO3–. Ke zlepšení exkreční kapacity ledvin a vyloučení přebytku HCO3– napomůže korekce hypovolémie pomocí NaCl a substituce K+.
b) Diuretika – léky zvyšující koncentraci chloridů v moči, např. thiazidy nebo furosemid vedou:
- při akutním podání diuretik při hypovolemii a bez současného ovlivnění celkového množství HCO3– dochází ke zvýšení jeho koncentrace v plazmě a MAlk („koncentrační alkalóza“)
- při chronickém podání diuretik dochází ke zvýšení koncentrace NaCl v distálním nefronu se zvýšením exkrece K+ a H+. Metabolická alkalóza je udržována přítomností hypovolémie, sekundárního hyperaldosteronismu, hypokalémie i přímého účinku diuretik. K léčbě metabolické alkalózy je indikován fyziologický roztoku ke korekci hypovolémie.
c) Bartterův a Gitelmannův syndrom
d) Nevstřebatelné anionty a deficit hořčíku
- Podání velkého množství nevstřebatelných aniontů (penicilin, carbenicilin) zvyšuje transepiteliální elektrický gradient v distálním nefronu se zvýšením sekrece H+ a K+.
- Deficit hořčíku stimuluje RAAS v distálním nefronu podobným mechanismem.
e) Hypokalémie – při chronické hypokalémii je stimulována produkce i reabsorpce NH4+, reabsorpce HCO3– a aktivita H+ K+ ATPázy (která zvyšuje reabsorpci K+ a sekreci H+). Alkalóza se při těžké hypokalémii koriguje po podání K+ (je rezistentní k substituci NaCl).
f) Stav po korekce předchozí acidózy (laktátové, ketoacidózy, respirační) – pokud je zevní příčina odstraněna příliš rychle, zůstává kompenzační nadbytek HCO3– (jak exogenní v rámci léčby, tak syntetizován ledvinami při korekci acidobazické poruchy). Regulace syntézy i exkrece HCO3– je totiž méně pružná než samotná eliminace laktátu a ketolátek. Dalšími faktory napomáhající přetrvávání alkalózy je hypovolémie a hypokalémie vzniklé ve fázi vlastní acidózy.
Klinický obraz – centrální i periferní neurologické a kardiální příznaky jsou podobné jako při hypokalcémii, tedy zmatenost, predispozice ke křečím, parestézie, tetanie, proarytmogenní účinek. Současně bývají běžné poruchy elektrolytů, zejména hypokalémie a hypofosfatémie.
Terapie metabolické alkalózy
1. Léčba vyvolávající příčiny – základem je léčba základní choroby a zabránění další:
- retence HCO3– (např. korekce primárního hyperaldosteronismu, Cushingova syndromu nebo stenózy renální arterie)
- ztráty H+ žaludkem (inhibitory protonové pumpy) nebo ledvinami (omezení diuretik)
2. Léčba ostatních faktorů stimulujících retenci HCO3– – při hypokalémii se substituuje K+, při hypovolémii rehydratace FR.
3. Farmakoterapie
- Acetazolamid – inhibuje karboanhydrázu a zvyšuje renální exkreci HCO3–. K jeho účinku je nutná dobrá funkce ledvin, díky stimulaci exkrece draslíku močí může zhoršovat hypokalémii.
- HCl – dobrou alternativou může být 0,1 M roztok kyseliny chlorovodíkové. Musí být podáván do centrální žíly. Nejzávažnějším nežádoucím účinkem je hemolýza.
Respirační acidóza
Patofyziologie – k respirační acidóze dochází při snížení ventilace s následnou retencí PaCO2 a poklesem pH. Příčinou může být těžké plicní postižení, vyčerpání respiračních svalů nebo porucha ventilačních center v mozku:
- při akutním vzniku dochází díky celulární pufrovací kapacitě k rychlému vzestupu HCO3– typicky o 0,75 mmol/l HCO3– na každý nárůst PaCO2 o 1 kPa
- při chronické respirační acidóze (trvání > 24 hodin) se přidává i renální retence HCO3– a typický vzestup HCO3– je pak o 3 mmol/l HCO3– na každý nárůst PaCO2 o 1 kPa. Tato kompenzační retence obvykle nepřesahuje 38 mmol/l.
CAVE CO2 má vazodilatační efekt a jeho retence může působit vazodilataci, včetně mozkových tepen s pohotovostí ke vzniku nebo zhoršení edému mozku.
Klinický obraz – záleží na závažnosti a délce trvání poruchy, vyvolávající chorobě a přítomnosti hypoxémie:
- při akutním vzniku se objevuje dušnost, úzkost, zmatenost, halucinace až kóma.
- při chronické poruše jsou příznaky mírnější, patří sem poruchy spánku, paměti, spavost přes den, změny osobnosti, poruchy koordinace a motoriky, např. tremor, myoklony, asterixis. Následkem vazodilatace vzniká bolest hlavy, edém oční papily, abnormální reflexy a fokální svalová slabost.
Etiologie
1. Postižení respiračních center v mozku
- akutně – anestetika, sedativa, kraniotrauma
- chronicky – sedativa, intoxikace alkoholem, tumory mozku, hypoventilační syndromy (periferní i centrální etiologie)
2. Slabost respiračních svalů – poruchy motorických neuronů a jejich zakončení nebo choroby kosterního svalstva mohou působit hypoventilaci a respirační acidózu při nedostatečné funkci dýchacích svalů.
3. Špatně nastavená umělá plicní ventilace – zejména nedostatečným minutovým dechovým objemem v situacích:
- s vysokou produkcí CO2 (horečka, sepse, psychický neklid nebo přejedení)
- při zhoršení alveolární ventilace pro dekompenzaci plicní choroby
- vysokého PEEP u pacienta se sníženým srdečním výdejem může vést k hyperkapnii díky zvětšení mrtvého alveolárního prostoru a následnému snížení ventilace
Permisivní hyperkapnie je užívána u pacientů s těžkou chorobou CNS nebo srdce.
CAVE Těžká respirační acidóza spojená s chronickou hyperkapnií a závažnými příznaky může vyžadovat podání bikarbonátu sodného, ovšem pouze k dosažení arteriálního pH cca 7,25 (při odeznění vyvolávající choroby může totiž snadno dojít k přesmyku do metabolické alkalózy, což je nežádoucí).
4. Okluze horních dýchacích cest – může být:
- akutní, při náhlé vzniklé okluzi horních dýchacích cest nebo generalizovaném bronchospazmu (asthma, anafylaxe, inhalační popáleniny nebo toxické poranění plic)
- chronická, při konečných stádiích CHOPN. Respirační acidóza při restriktivních plicních chorobách nevzniká díky poruše ventilace, ale zvýšením produkce CO2 usilovnou činností a nakonec vyčerpáním respiračních svalů.
Diagnostika
- Základem diagnostiky je stanovení hodnoty krevních plynů a acidobazické rovnováhy.
- K objasnění příčiny respirační acidózy je důležité funkční vyšetření plic (spirometrie, vyšetření difúze, bodypletysmografie), rentgen srdce a plic event. CT hrudníku.
- K vyloučení mimoplicní příčiny je nutná detailní farmakologická anamnéza, stanovení hematokritu, abúzu alkoholu event. drog, posouzení stavu horních dýchacích cest, hrudní stěny, pleury a neuromuskulárních funkcí.
Terapie – strategie léčby respirační acidózy záleží na její závažnosti a rychlosti vzniku:
1. Při akutním nástupu může vzniknout život ohrožující porucha a vše by mělo být podřízeno obnovení alveolární ventilace. Oxygenoterapie, často OTI + UPV.
CAVE Příliš rychlá korekce hyperkapnie může provokovat stejné komplikace jako akutní respirační alkalóza (např. srdeční arytmie, snížení mozkové perfúze a křeče).
2. Chronická respirační alkalóza bývá často obtížně korigovatelná. Při dlouhodobém trvání respirační acidózy by PaCO2 mělo být regulováno postupně, aby měly ledviny dostatek času k vyloučení nadbytku HCO3–.
CAVE U pacientů s těžkou chronickou obstrukční plicní chorobou a spontánní ventilací, kteří jsou adaptování na permisivní hyperkapnii a triggerem ventilace je hypoxie, může podání kyslíku utlumit respirační centrum s dalším zhoršením ventilace i oxygenace.
Respirační alkalóza
Etiologie – příčinou bývá hyperventilace všech etiologií:
- Špatně vedená umělá plicní ventilace.
- Léky – salicyláty (přímo stimulují respirační chemoreceptory v prodloužené míše), metylxantiny teofylin a aminofylin (zvyšují citlivost respiračních center na CO2), progesteron (respirační alkalóza je proto častá v těhotenství).
- Jaterní selhání
- Časná stádia G- sepse (před rozvojem horečky, hypoxémie a hypotenze).
CAVE Při hyperventilaci z organických důvodů (hypertyreoidismus, vysokokalorická dieta nebo tělesná zátěž) se proporcionálně s ventilací zvyšuje i produkce CO2, což je důvod proč k hypokapnii nedochází.
Patofyziologie – při alveolární hyperventilaci klesá PaCO2 a roste poměr HCO3– : PaCO2. K této hypokapnii vedou všechny faktory, které stimulují alveolární ventilaci, díky čemuž plicní eliminace CO2 převýší jeho metabolickou produkci tkáněmi. pH a koncentrace HCO3– v plazmě odpovídá hladině PaCO2. Pokles PaCO2 je nepřímo úměrný vzestupu pH a zároveň i kompenzačně klesá HCO3–. Pokud je respirační alkalóza:
- akutní, zvýší se pH typicky o 0,075 a HCO3– klesne o 1,5 mmol/l na každý pokles PaCO2 o 1 kPa
- chronická (déle než 2 – 6 h), dochází k metabolické kompenzaci, se zvýšením renální exkrece HCO3– a zvýšením retence i syntézy NH4+. V tom případě se, typicky pH zvýší o 0,0225 a HCO3– klesne o 3,4 mmol/l na každý pokles PaCO2 o 1 kPa. K rozvinutí plné renální kompenzační odpovědi je potřeba několika dnů.
Klinický obraz – záleží na délce trvání, závažnosti poruchy a vyvolávající chorobě:
Akutní hyperventilační syndrom – projevuje se cirkumorálními i akrálními paresteziemi, bolestmi na hrudníku, vertigem, pocitem zkrácení dechu, vzácně tetaniemi.
Chronická respirační alkalóza – snížení perfúze mozku následkem hypokapnie (i při normální oxygenaci) může vést k závratím, zmatenosti a křečím. Kardiální příznaky jsou při respirační alkalóze jen minimální, ale při současné umělé plicní ventilaci s vysokým PEEP může dojít k srdečnímu selhání. U predisponovaných kardiaků může dojít k indukci arytmií následkem posunutí disociační křivky kyslíku směrem doleva. Akutní respirační alkalóza působí vstup Na+, K+ a PO42- do buněk a snížení ionizované frakce Ca2+ zvýšením podílu kalcia vázaného na proteiny. U neventilovaných pacientů znamená zhoršení prognózy.
Diagnostika
1. Průkaz hyperkapnie (PaCO2 typicky mezi 2 – 4 kPa), často bez současné hypoxémie. Z dalších nálezů je:
- často současná hypokalémie a hyperchlorémie
- renální exkrece bikarbonátů je v časných stádiích normální, po několika hodinách se zvyšuje s poklesem plazmatické koncentrace HCO3– (jen vzácně ˂ 12 mmol/l)
2. Zjištění vlastní příčiny poruchy (např. plicní embolie, hypertyreoidismu, nebo ICHS)
Terapie – základem je léčba vyvolávajícího onemocnění (u ventilovaných pacientů úprava ventilátoru, u rozrušených osob zklidnění, dýchání do papírového sáčku, nejsou doporučována antidepresiva ani sedativa). Beta blokátory mohou zmírnit periferní projevy hyperadrenergního stavu.