Základní funkcí mužského pohlavního systému je zajištění sexuální diferenciace a možnosti reprodukce. Vlivem FSH a LH z hypofýzy produkují Leydigovy buňky testosteron a Sertoliho buňky se účastní tvorby spermií. Během embryogeneze stimuluje testosteron další proliferaci Wolfova kanálku a virilizaci vnějšího genitálu, v dospělosti je zásadní pro spermiogenezi, libido a normální sexuální funkci.
Struktura a vývoj varlat
Po spuštění genetické kaskády, která je zahájena pomocí SRY (sex-related gene na chromozómu Y) se z nediferencovaných buněk začínají vyvíjet fetální varlata s následnou diferenciací Sertoliho buněk obklopujících germinální buňky, které spolu s peritubulárními buňkami dávají základ pro budoucí semenné kanálky. Testosteron produkovaný fetálními Leydigovými buňkami stimuluje proliferaci Wolfova kanálku, který se následně vyvíjí v nadvarle, vas deferens a semenné váčky. Testosteron je konvertován na dihydrotestosteron (DHT), který stimuluje diferenciaci prostaty a vnějších pohlavních orgánů (penis, močová trubice a skrotum). Sertoliho buňky také produkují MIS (müllerian inhibiting substance), který působí regresi Müllerova duktu, včetně vejcovodů, dělohy a vagíny.
Semenotvorné kanálky varlete jsou shluky uzavřených kliček, jejichž oba konce ústí do rete testis (siť postupně se zvětšujících eferentních duktů, které nakonec tvoří nadvarle) o celkové délce cca 600 m. Stěny těchto kanálků jsou tvořeny polarizovanými Sertoliho buňkami, které tvoří bariéru krev – varle. Většina (cca 60 %) semenotvorného epitelu je tvořena zárodečnými buňkami, které jsou obklopeny výběžky cytoplazmy Sertoliho buněk, které fungují jako jejich „chůvy“ (dodávají potřebné živiny a hydrolytické enzymy potřebné pro vytvoření zralé spermie). Při dosažení pohlavní zralosti muže procházejí primitivní zárodečné buňky (spermatogonie) řadou několika dělení. Sertoliho buňky produkují inhibin B, který snižuje sekreci FSH. Jakékoliv zničení semenotvorných kanálků (např. radiací) proto vede ke zvýšení hladiny FSH. Nově vzniklé elementy sledují jednu ze dvou následujících cest:
- mohou zůstat jako nediferencované buňky – spermatogonie typu A.
- diferenciace v průběhu následujících mitotických cyklů na spermatogonie typu B, ze kterých vznikají primární spermatocyty (46, XY) vstupující do první meiotické profáze, jejímž výsledkem jsou sekundární spermatocyty (23, X a 23, Y) vstupující velmi rychle do druhého meiotického dělení s následným vznikem spermatid. Mezi prvním a druhým meiotickým dělením neprobíhá žádná S-fáze (tedy žádná syntéza DNA), takže během druhého dělení je množství DNA zredukováno na polovinu. Po dokončení spermiohistogeneze se spermie uvolňují do lumen kanálků a jsou pasivně unášeny do nadvarlete, kde tráví 21 dnů a dále zde zrají a probíhá u nich kapacitace (změny umožňující spermii oplození vajíčka). Ty jsou poté peristaltickými kontrakcemi transportovány do ductus deferens. Kompletní diferenciace ve zralou spermii trvá cca 74 dnů. Z každé zárodečné buňky vzniknou čtyři spermie.

Normální puberta u muže
Puberta je definována jako zrání reprodukční osy u muže a vznik sekundárních pohlavních znaků. Pulzový generátor GnRH v hypothalamu je aktivní během fetálního života a těsně po narození, poté dochází vlivem glutamátu, GABA a neuropeptidu Y k potlačení jeho činnosti, která se obnovuje v časných fázích puberty (mechanismus této reaktivace není příliš jasný, důležitou roli hraje pravděpodobně kisspeptin), pro které jsou typické noční pulzy FSH a LH.
- Rozvoj sekundárních pohlavních znaků je zahájen adrenarche (začátek produkce dehydroepiandrosteronu, DHEAS, zona reticularis nadledvin) ve věku okolo 6 – 8 let. První známkou nadcházející puberty je:
- růst varlat díky zvyšujícímu se objemu semenných kanálků, později
- zhrubění hlasu a zvýšení objemu svalové hmoty díky zvýšené produkci testosteronu,
- růst prostaty, zevního genitálu, pubického ochlupení a vousů s ústupem vlasové linie konverzí testosteronu na dihydrotestosteron.
Hladina růstového hormonu a sekundárně i IGF-1 (insulin like growth factor-1) se v pubertě zvyšuje se zrychlením růstů kostí do délky. Dlouhodobá expozice pohlavním steroidům (zejména estradiolu) vede k uzavření růstových štěrbin a definitivnímu ukončení růstu.
Regulace funkce varlat
Pulzy GnRH (cca á 2 hodiny) z hypothalamu indukují pulzní produkci hypofyzárních FSH (reguluje Spermatogenezi v Sertoliho buňkách) a LH (reguluje produkci testosteronu v Leydigových buňkách). K dostatečné spermatogenezi je potřeba vysoká hladina testosteronu.
Regulace produkce androgenů – vazba LH na receptor vede k indukci tvorby StAR (STeroid Acute Regulatory) proteinu a nastartování steroidogeneze.
- 95 % testosteronu u mužů vzniká ve varlatech, zbytek v nadledvinách nebo je periferně konvertováno z androstendionu na testosteron.
- většina dihydrotestosteronu (DHT) je konvertována z testosteronu, pouze malé množství vzniká přímo ve varlatech.
- většina estradiolu u mužů vzniká konverzí z testosteronu pomocí aromatázy.
Cirkulující testosteron je vázán na SHBG (sexual hormone binding globulin), menší množství na albumin. Pouze 1 – 4 % je nevázaných a právě tato volná frakce je biologicky aktivní. Koncentraci SHBG:
- snižují androgeny, hypotyreoidismus, obezita, diabetes mellitus, nefrotický syndrom a různé genetické faktory.
- zvyšují estrogeny, hypertyreoidismus, chronické zánětlivé stavy a některá antikovulziva.
Testosteron je metabolizován zejména v játrech na androsteron, etiocholanolon, DHT a 3α-androstendiol. Tyto metabolity podléhají glukuronidaci a sulfataci a následně jsou vyloučeny ledvinami do moči.
Testosteron se váže na androgenový receptor (AR) jednak přímo, jednak po konverzi na DHT pomocí 5α-reduktázy, který je potřeba pro maskulinizaci zevního urogenitálu. Afinita DHT k AR je cca dvojnásobná oproti testosteronu.
Klinické a laboratorní vyšetření mužského reprodukčního systému
Anamnéza a klinické vyšetření – anamnesticky je nutné se ptát na průběh puberty, sexuální touhu (potřebu sexu, event. masturbace), schopnost erekce, popřípadě únavu a změny nálad. Při fyzikálním vyšetření je potřeba posoudit přítomnost sekundárních pohlavních znaků a abnormalit (růst vlasů, gynekomastie, velikost varlat), stav prostaty, výšku a tělesné proporce. Jako eunuchoidní proporce se označuje rozpětí paží o > 2 cm větší než tělesná výška.
Velikost varlat se nejlépe posuzuje Praderovým orchidometrem. Normální délka varlat se pohybuje mezi 3,5 – 5,5 cm a jejich objem pak 12 – 25 ml. Asiaté mají obecně menší varlata než Evropané.
Laboratorní odběry
- hladina testosteronu – celková hladina testosteronu zahrnuje jak vázanou, tak volnou frakci. Dostatečnou výpovědní hodnotu má jednorázový odběr ráno na lačno při absenci akutní nemoci. Hladina celkového testosteronu je obecně nižší později odpoledne a při akutní chorobě, dále je ovlivněna hladinou SHBG (obě rostou ruku v ruce, protože biologicky účinná je pouze volná frakce testosteronu). Volnou frakci je možné buď stanovit přímo nebo spočítat z koncentrace testosteronu, SHBG a albuminu).
- u mužů s prokázanou nízkou hladinou testosteronu je indikováno došetření hladiny LH. Vysoká hodnota LH znamená primární hypogonadismus (postižení produkce na úrovni varlat), nízká nebo neadekvátně normální hladina LH pak sekundární hypogonadismus (postižení osy hypothalamus – hypofýza). CAVE hladina LH fluktuuje v závislosti na pulzech GnRH (cca á 2 hodiny), při nejasnostech je tedy vhodné vyšetření hladiny LH opakovat.
- GnRH stimulační test – dnes spíše ojediněle používaný. Stanoví se bazální hladina LH a FSH, poté se podá 100 μg GnRH a měření se opakuje po 30 a 60 minutách. Normální odpovědí je nárůst hladiny LH o nejméně 100 % a FSH o nejméně 50 %.
- hCG stimulační test – stanoví se bazální hladina testosteronu, poté se podá 1500 – 4000 IU hCG a měření se opakuje po 1, 2, 3 a 5 dnech. Normální odpovědí je nárůst hladiny testosteronu o nejméně 100 %.
Analýza spermatu – vzorek se získá masturbací po 2 – 3 dnech abstinence. Norma (dle WHO 2010) je > 15 miliónu/ml. Stav spermiogramu se stále horší, proto jsou i kritéria stále benevolentnější (v roce 1951 byla norma > 80 miliónů/ml).
Biopsie varlete – v lokální anestezii se provádí biopsie tenkou jehlou, při potřebě většího množství tkáně i chirurgickou cestou. Indikací je došetření v některých případech oligo-/azoospermie a také získání spemií k ICSI (intracytoplazmatická injekce spermií) v rámci IVF.
I. Poruchy puberty
Předčasná puberta
Je definována jako přítomnost sekundárních pohlavních znaků před 9. rokem věku chlapce. Příčiny:
I. Gonadotropin dependentní předčasná puberta – u chlapců je vzácnější než u dívek. Je způsobena předčasnou aktivací pulzního generátoru GnRH v hypothalamu, nejčastěji lézemi CNS, ale často zůstávají idiopatické, často geneticky podmíněné. Typickým nálezem je neadekvátně zvýšená hladina gonadotropinů vzhledem k věku. Základním vyšetřením je MRI mozku k vyloučení tumoru, strukturálního defektu, infekce nebo zánětu.
II. Gonadotropin independentní předčasná puberta – androgeny působící předčasnou pubertu vznikají v nadledvinách nebo varlatech. Příčiny:
- kongenitální adrenální hyperplázie – chlapci s CAD, kteří nejsou pod dostatečnou supresí produkce ACTH glukokortikoidy, trpí předčasnou pubertou pro excesivní produkci testosteronu nadledvinami. Typická je nízká hladina LH a malá varlata.
- tumory – produkující hCG, hormonálně aktivní nádory varlat
- hypothyreoidismus
- familiární předčasná puberta omezená na muže – AD dědičná choroba způsobená aktivační mutací LH receptoru vedoucí k předčasné produkci testosteronu. Projevuje se předčasným rozvojem sekundárních pohlavních znaků s akcelerací růstu v dětství, ale zároveň předčasným uzávěrem růstových štěrbin s nižší konečnou výškou. Hladina testosteronu je zvýšená, hladina LH je snížená. Mezi možnosti léčby patří inhibitory steroidogeneze (např. ketokonazol, medroxyprogesteron acetát), antagonisté AR (např. flutamid, bicalutamid) a inhibitory aromatázy (např. anastrazol).
- McCune-Albrightův syndrom = sporadická aktivační mutace podjednotky Gs-α vedoucí k trvalé aktivaci adenylylcyklázy a nadprodukci cAMP. Projevuje se fibrózní kostní dysplázií, kožními změnami charakteru hyperpigmentací nebo cafe-au-lait skvrn na jedné straně těla, různými hormonální nadprodukcemi (gonády, nedledviny, hypofýza, štítná žláza). Terapie je podobná jako u aktivační mutace LH.

Diagnostika – po určení diagnózy předčasné puberty je indikováno stanovení hladiny testosteronu, FSH a LH:
- u gonadotropin dependentní předčasné puberty je indikováno neurologické vyšetření a MRI mozku. Při vyloučení organické choroby se hodnotí jako idiopatická forma.
- u gonadotropin independentní předčasné puberty by mělo být doplněno stanovení DHEAS a 17α-OH progesteronu:
- současná zvýšená hladina 17α-OH progesteronu značí možnost CAD při deficitu 21α- nebo 11α-hydroxylázy.
- současné zvýšení DHEAS značí možnost nádoru nadledvin (indikováno CT nadledvin s kontrastem).
- při normání hladině obou hormonů by měla být pečlivě vyšetřena varlata (palpace, ultrazvuk) k vyloučení tumoru z Leydigových buněk.
- při vyloučení všech předchozích bodů (včetně skrytého abúzu androgenů) by měla být zvážena aktivační mutace LH.
Terapie – léčba by vždy měla být zaměřena na vyvolávající příčinu. U idiopatické formy je vhodné použít dlouhodobě působící analoga GnRH (např. triptorelin, buserelin, goserelin). Terapie je nejúčinnější, pokud je zahájena před 6. rokem věku. Lečba by neměla být přerušena, dokud nenastane čas fyziologické puberty (při ukončení terapie se hladina testosteronu opět zvyšuje). U gonadotropin independentní předčasné puberty lze použít inhibitory steroidogeneze (např. ketokonazol, medroxyprogesteron acetát), antagonisty AR (např. flutamid, bicalutamid) nebo inhibitory aromatázy (např. anastrazol, letrozol, testolakton). Ve fázi zkoušení jsou nové inhibitory syntézy testosteronu (např. abirateron).
Opožděná puberta
Je definována jako nepřítomnost sekundárních pohlavních znaků ve 13. roce věku chlapce. Příčiny:
- konstituční příčiny, tedy neovlivnitelné (cca 60 % případů).
- funkční přičiny, např. chronická systémová choroba nebo malnutrice (cca 20 % případů).
- hypogonadotropní hypogonadismus, tedy porucha osy hypothalamus – hypofýza (cca 10 % případů).
- hypergonadotropní hypogonadismus, tedy porucha varlat (cca 15 % případů).
Diagnostika – v anamnéze je potřeba se zaměřit na chronické choroby, poruchy příjmu potravy, nadměrné cvičení, sociální a psychologické obtíže a abnormální růst během dětství. Při fyzikálním vyšetření je nutné posoudit výšku, rozpětí paží, hmotnost, zorné pole a přítomnost sekundárních pohlavních znaků (vlasová linie, objem varlat, velikost a zčervenání a ztenčení skrota). Velikost varlat > 2,5 cm značí, že dítě začíná vstupovat do puberty.
Základní obtíží je odlišení konstituční formy od těch, které jsou spojeny s patologickým procesem. Konstituční forma je pravděpodobná, pokud je současně opožděn i kostní věk, je přítomna nízká postava, je nízká hladina FSH i LH a opoždění puberty bylo přítomno i u otce, nicméně tato diagnóza by měla být stanovena per exclusionem.
Terapie – pokud je terapie indikovaná (ne vždy), je vhodné zahájit substituci testosteronem (testosteron enanthát nebo cypionát 25 – 50 mg á 2 týdny, testosteronové náplasti nebo gel). Vzhledem k aromatizaci testosteronu na estrogen je vhodné současné podávání inhibitorů aromatázy ke snížení produkce estrogenů a tak dosažení vyšší finální tělesné výšky. Substituci je vhodné přerušit cca 6 měsíců po zjištění, že došlo k začátku endogenní produkce FSH a LH.
II. Poruchy reprodukční osy u mužů v dospělosti
a) Hypogonadotropní hypogonadismus
FSH i LH jsou trofickými hormony varlat, porucha jejich sekrece vede k sekundárnímu hypogonadismu, pro který je typická nízká hladina testosteronu a nízká nebo neadekvátně „normální“ hladina gonadotropinů. Pro kompletní formy je typická absence puberty, sexualní infantilita a u některých hypospadie a nesestouplá varlata, pro inkompletní pak porušený sexuální vývoj. U závažných forem je velmi nízká bazální hladina LH a absence pulzů. Dle příčiny jej lze dělit na:
Vrozený deficit gonadotropinů
Vzniká díky nedostatečné produkci GnRH hypothalamem nebo gonadotropinů hypofýzou. Tato nedostatečnost může být subklinická a může ji demaskovat nutriční nedostatek a emoční nebo metabolický stres. U některých pacientů může být přítomna hypo-/anosmie (Kallmanův syndrom), u jiných je čich normální. U cca 10 % mužů s idiopatickým hypogonadotropním hypogonadismem léčených pohlavními steroidy může v dospělosti dojít k obnovení jejich sekrece. Byla identifikována celá řada genů působících tuto chorobu, jejichž přehled přesahuje rozsah tohoto sdělení. Nejznámější syndromy:
Prader-Williho syndrom – typická je obezita, malá postava, malé ruce i nohy, hypotonie svalstva, mentální retardace a hypogonadismus.
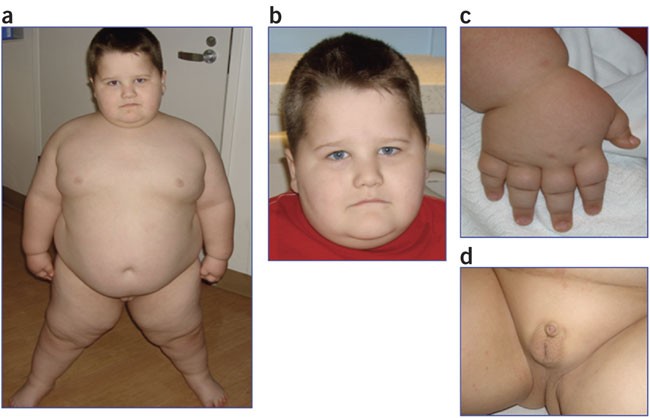
Laurence-Moonův syndrom (neboli Bardet – Biedlův syndrom) – AR dědičná choroba, typická je obezita, mentální retardace, polydaktylie a retinitis pigmentosa.

Získaný deficit gonadotropinů
- Závažné onemocnění, stres, malnutrice a neúměrná tělesná námaha jsou možné příčiny reverzibilního deficitu gonadotropinů, ale vzácnějí než u žen. Vzniká pravděpodobně díky inhibičnímu vlivu zánětu a cytokinů nebo glukokortikoidů a velmi pravděpodobě se na něm podílí i genetická predispozice. Deficit gonadotropinů je častější např. u HIV, terminálního selhání ledvin, CHOPN, maligních tumorů a chorob vyžadujících dlouhodobou terapii glukokortikoidy nebo opiáty.
- Obezita – u obézních mužů dochází k poklesu SHBG, ale díky současnému poklesu celkového testosteronu je hladina volného (biologicky aktivního) testosteronu stejná, tedy hypogonadismus ve většině případů nenastává.
- Hyperprolaktinémie – vede k hypogonadismu, protože prolaktin (PRL) je inhibitorem sekrece GnRH. Základem je terapie dopaminergními agonisty.
- Expanze selly – tumory nebo jiné léze v oblasti sella turcica mohou vést k postižení funkce gonadotropinů. Příčinou může být jednak zvýšená sekrece PRL (viz výše) jak přímo prolaktinomem, tak afunkčními adenomy (pseudoprolaktinémie, kdy je zvýšená hladina PRL způsobena útlakem stopky a tak postižením zpětnovazebné inhibice sekrece PRL dopaminem – typické jsou nižší hladiny PRL než u pravého prolaktinomu), dále adenomy hypofýzy, kranyofaryngeomy, vaskulární léze apod.
- Hemochromatóza – zvýšenou depozicí železa mohou být postižena jak varlata, tak hypofýza, která je ale k tomuto typu postižení náchylnější.
b) Hypergonadotropní hypogonadismus
Vrozené postižení varlat
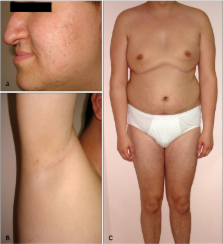
Klinefelterův syndrom – nejčastější chromozomální aberace (47, XXY) vedoucí k poruše varlat a neplodnosti s četností 1:600 všech živě narozených chlapců. Histologicky je přítomna hyalinizace semenotvorných kanálků a absence spermatogeneze, četnost Leydigových buněk se zdá být zvýšená, ale hladina celkového testosteronu je nižší a estradiolu vyšší než u zdravých jedinců. U mužů s Klinefelterovým syndromem je vyšší riziko systémového lupus erythematosus, Sjögrenova syndromu, rakoviny prsu a plic, diabetes mellitus, osteoporózy, non-Hodgkinova lymfomu a naopak, nižší riziko karcinomu prostaty. Je vhodné provádět pravidelné mamografické vyšetření. Oplození je možné dosáhnout pomocí ICSI po chirurgickém odběru spermií z varlat. Ještě závažnější příznaky lze prokázat u jedinců s karyotypem 48, XXXY nebo dokonce 49, XXXXY.
Kryptorchismus – cca 3 % zralých a cca 30 % nedonošených novorozenců má nejméně jedno nesestouplé varle, ale ve většině případů je sestup dokončen během několika prvních týdnů života. Kryptorchismus je spojen s vyšším rizikem malignity, neplodnosti, tříselné kýly a torze varlete.
Získané choroby varlat
- virové orchitidy – zánět varlete nejčastěji komplikuje příušnice (25 % postižených mužů), dále infekci echoviry a arboviry.
- radiační postižení – při dávce > 0,2 Gy lze prokázat zvýšení hladiny FSH a LH, > 0,8 Gy oligospermii nebo azospermii, u vyšších dávek dochází k obliteraci semenotvorných kanálků. Před terapeutickou radioterapií je proto nutné provést odběr spermatu a jeho uložení ve spermobance.
- léky
- ketokonazol inhibuje steroidogenezi.
- spironolakton blokuje účinek androgenů.
- marihuana zvyšuje hladinu estrogenu.
- digoxin snižuje hladinu testosteronu a zvyšuje hladinu estrogenu.
- chemoterapie obecně inhibuje spermatogenezi.
- cyklofosfamid je toxicky k zárodečným buňkám.
- alkoholismus snižuje produkci testosteronu.
- polyglandulární syndromy s tvorbou protilátek proti spermiím
- jaterní cirhóza – hypofunkce hypofýzy i varlat s přímou toxicitou alkoholu vůči zárodečným buňkám.
- febrilie vedou k přechodnému poklesu počtu spermií.
- pesticidy, kadmium, olovo, ftaláty, mikrovlnné záření, ultrazvuk.
Syndromy necitivosti k androgenům – X vázaná inhibiční mutace androgenového receptrou působí necitivost vůči testosteronu a DHT.
c) Gynekomastie
Podstatou gynekomastie je zvětšení mléčné žlázy u mužů (> 4 cm v průměru, většinou je současně zvýšena její citlivost). Je způsobena zvýšenou aktivitou estrogenů, nejčastěji jako výsledek zvýšeného poměru estrogeny : androgeny. U pacientů s gynekomastií je zvýšené riziko vzniku karcinomu prsu (přestože celkové riziko je relations nízké).
Fyziologická gynekomastie
- novorozenci – mateřské estrogeny přechází transplacentární bariérou.
- časné fáze puberty – zvýšený poměr estrogen : testosteron.
- vyšší věk – zvýšené množství tuku prsou, zvýšená aktivita aromatázy.
Patologická gynekomastie
Jakýkoliv deficit androgenů vede ke zvýšení poměru estrogeny : androgeny (i při reziduální syntéze androgenů dochází k jejich aromatizaci na estrogeny). Příčiny:
- Klinefelterův syndrom (gynekomastie je typický příznak).
- necitlivost k androgenům.
- zvýšená produkce estrogenů nádory, např. ze Sertoliho buněk, izolovaně nebo jako součást
- Peutz-Jegherova syndromu – četné polypy v tlustém střevě s vyšším rizikem vzniku kolorektálního karcinomu, ileu nebo krvácení, typické jsou četné melaninové pigmentace v oblasti úst, ústní sliznice a rtů).
- Carneyho komplexu – typické jsou mnohočetné myxomy (7 % všech srdečních myxomů je spojeno s Carneyho komplexem), kožní a slizniční pigmentové léze a tumory, které mohou postihovat různé orgány a v některých případech vést k endokrinologickým abnormalitám, dále přítomnost modrých névů.
- zvýšená konverze androgenů na estrogeny – při zvýšené koncentraci androstendionu (CAH, hypertyreoidismus) nebo jeho snížené metabolizaci (jaterní choroby) nebo jeho zvýšené aromatizaci na estrogeny (obezita), vzácně AD nebo X dědičná hyperfunkce aromatázy (popsáno u několika rodin).
- léky – působí přímo na estrogenový receptor (např. digoxin, fytoestrogeny), inhibují syntézu (např. ketokonazol) nebo účinnost (např. spironolakton) androgenů.


Diagnostika – ne každá gynekomastie vyžaduje došetření (v řadě případech je fyziologická). Mezi varovné příznaky patří rychlý vznik i růst a tuhnutí prsou u jinak štíhlého jedince. Postup:
- 1. Jde opravdu gynekomastii nebo spíše zvýšené množství tuku? Pokud jde o gynekomastii:
- 2. Je prsní žláza fixovaná?, rychle a náhle začala růst?, jsou přítomny podezřelé léky? nebo hepatopatie?, jakou má velikost?, jak jsou velká varlata?
- 3. Při jasném deficitu androgenů, prsní žláíze > 4 cm, která je tuhá nebo malých varlatech je vhodné provést odběr testosteronu, FSH, LH, estradiolu a hCG.
- nízký testosteron a zvýšený poměr estradiol : testosteron = hypogonadismus.
- zvýšené hCG = nutné vyloučení hCG produkujících nádorů.
- zvýšený estradiol, normální testosteron a zvýšený poměr estradiol : testosteron = zvýšená aromatizace androgenů (obezita, feminizující nádory, nádory ze Sertoliho buněk, vrozená hyperfunkce aromatázy).
Terapie – i při vyřešení vyvolávajícího onemocnění přetrvává většinou gynekomastie několik měsíců, pokud je její trvání dlouhé, je jedinou léčbou chirurgické odstranění (zejména při podezření na malignitu). V časných stádiích mohou být efektivní inhibitory aromatázy (anastrazol ovšem neprokázal větší účinek v redukci velikosti gynekomastie oproti placebu výraznější účinek). Při bolestivé gynekomastii je možností podání antiestrogenů (např. tamoxifen) s účinností okolo 50 %.
d) Změny v reprodukčních funkcích mužů související s věkem
Koncentrace testosteronu klesá s věkem od cca 30 let věku, pravděpodobně vlivem poklesu funkce všech složek osy hypothalamus – hypofýza – varlata (více u obézních mužů, protože u nich stoupá koncentrace SHBG a klesá tak volná frakce). Prevalence tak nízké hladiny testosteronu, že působí sexuální obtíže je u mužů ve věkové skupině 40 – 70 let cca 2 % (u starších je častější). Při zjevném nedostatku testosteronu (sexuální dysfunkce apod.) dochází po zahájení substituce ke zlepšení příznaků. Tato substituce v.s. nevede ke vzniku karcinomu prostaty, na druhou stranu pravděpodobně urychluje růst subklinických ložisek nádoru. Snížená hladina testosteronu je spojena se zvýšením mortality (zejména kardiovaskulární) a testosteron lze tak označit za jeden z markerů zdraví. Plošný screening nedostatku testosteronu, ani substituce při jeho průkazu nejsou indikovány u každého muže, ale vždy na základě individuální rozvahy.
Nedostatek testosteronu se projevuje sníženým libidem i frekvencí sexu, nedostatečnou erekcí, sníženým ochlupením, sníženou svalovou hmotou, malými varlaty a gynekomastií. Při průkazu snížené hladiny testosteronu je vhodné stanovení hladiny LH (nízká hladina = sekundární příčina při poruše hypofýzy nebo hypothalamu, vysoká nebo neadekvátně normální hladina = primární postižení varlat). Terapie nedostatku testosteronu:
Gonadotropiny – lidský menopauzální gonadotropin (hMG, extrahovaný z moče postmenopauzálních žen) obsahuje 75 IU FSH a 75 IU LH v lahvičce, hCG (extrahovaný z moče těhotných žen) má velmi nízkou FSH aktivitu a výraznou LH aktivitu stimulující Leydigovy buňky k produkci testosteronu.
Terapie se většinou začíná hCG a pouze v případě potřeby stimulace spermatogeneze se mění na hMG. Nejlepším markerem účinku terapie gonadotropiny je zvětšení objemu varlat.
Substituce testosteronem – zlepšuje přítomnost sekundárních pohlavních znaků, libido i celkovou sexuální aktivitu, zvyšuje svalovou hmotu, hemoglobin i hematokrit, dále kostní hustotu a snižuje množství tělesného tuku. Substituce je přínosná pouze u mužů s prokázaným deficitem, nikoliv profylakticky. Testosteron je následně konvertován aromatázou na estradiol a 5α- reduktázou na 5α – dihydrotestosteron.
- orální podání – testosteron je sice dobře perorálně absorbován, ale téměř kompletně degradován během prvního průchodu játry. Jeho 17α-alkylované deriváty jsou sice vůči tomuto first-pass efektu poměrně odolné, na druhou stranu jsou poměrně hepatotoxické (riziko cholestatického ikteru, peliózy a tumoru jater). Naopak jsou plně indikovány u heredirátního angioedému při deficitu C1 esterázy, protože stimulují její jaterní produkci.
- injekční podání – esterifikací na 17β-OH pozici se testosteron stává hydrofobním prodlouží se tak jeho účinek (čím je tento esterifikující řetězec delší, tím je hydofobnost delší, tedy testosterony enantát, cypionát a undekaonát mají delší účinek než propionát).
- testosteronová náplast
- testosteronový gel
- bukální tablety
- intranazální podání
- subkutánní pelety s udržením normální hladiny po dobu 3 – 4 měsíců
- nové preparáty – 7α-methyl-19-nortestosteron je androgenem, který nemůže být redukován na 5α pozici, má proto menší negativní účinek na prostatu. Ve vvývoji je řada modulátoru androgenního receptoru (SARM, Selective Androgen Receptor Modulator), které rovněž šetří prostatu.
Z neendokrinologických indikací lze testosteron použít:
- u mužů s AIDS, kteří začali kachektizovat ke zvýšení jejich aktivní tělesné hmoty.
- suprafyziologické dávky testosteronu (např. 200 mg enantátu týdně) snižují produkci FSH a LH a působí azospermii u 50 % bílých mužů a > 95 % Asiatů a zkoumá se tak možnost jeho použití jako mužská antikoncepce.
Doporučené dávkování – estery testosteronu 75 – 150 mg i.m. týdně, undekaonát v dávce 750 mg v úvodní dávce, poté po 4 týdnech a následně trvale každých 10 týdnů. Gely se aplikují na kryté části těla, kde je znemožněn přenos na jiné osoby, náplasti poté na záda, stehna nebo paže mimo místa tlaku, bukální tablety 2x denně, intranazální sprej pak 3x denně.
Možnými nežádoucími účinky je mastná kůže s akné, zvětšení a tuhost prsou a otoky dolních končetin. Dále je zahájení substituce testosteronem spojeno s:
- cca 3 % nárůstem hladiny hemoglobinu díky zvýšení hladiny erytropoetinu, dostupnosti železa pro erytropézu, pokles aktivity hepcidinu a tak celkové zvýšení erytropoézy. Při vzestupu hematokritu > 0,54 by subsituce měla být pozastavena dokud neklesne hematokrit < 0,50.
- zvýšením rizika exacerbace a růstu karcinomu prostaty (tedy nikoliv jeho novotovorba, ale spíše urychlení růstu mikroložisek). U mužů by se tedy měla provádět pravidelná urologická kontrola se stanovením PSA.
Od 50 let 20. století jsou androgeny také zneužívány atlety ke zvýšení jejich výkonnosti. Odhaduje se, že v USA zneužívá androgeny ke stimulaci sportovního výkonu cca 3 milióny lidí. Mimo androgeny jsou používány i růstový hormon, stimulátory erytropoézy, inzulíny, amfetaminy, klenbuterol, kokain, efedrin a tyroxin. K redukci jejich nežádoucích účinků pak hCG ke stimulaci vlastní produkce testosteronu, inhibitory aromatázy a antagonisté testosteronu. Jedna finská studie uvádí 4,6x vyšší riziko smrti u elitních powerlifterů než u kontrolního vzorku stejného věku (nejčastějšími příčinami smrti byla sebevraždam infarkt myokardu a jaterní kóma). Dlouhodobé užívání anabolických steroidů vede k:
- nevratnému poklesu FSH a LH s poklesem produkce testosteronu a nekvalitní spermiogenezí
- zvýšení rizika psychických obtíží (zejména mánie)
- zvýšení inzulínové rezistence.
- u perorálního podání (17α-alkylované deriváty) je zvýšené riziko hepatopatie, cholestatického ikteru, indukce nádorů jater a peliózy.
- poškození šlach a vazů (nedokážou se dostatečně rychle adaptovat na enormí nárůst síly).
Podezření na abusus anabolických steroidů by mělo být vysloveno u svalnatých jedinců s polyglobulií, nízkým FSH, LH i testosteronem, zvýšeným LDL a s malým objemem varlat i nekvalitním spermiogramem.