Úvod – čtyři příštítná tělíska jsou lokalizována dorzálně od štítné žlázy. Jejich normální hmotnost je 25 mg. Jako první si podobnosti primárního hyperparatyreoidismu a paraneoplastické hyperkalcémie všiml Allbright v roce 1941.
Parathormon (PTH)
Funkce – hlavní funkcí je udržení normální hladiny kalcia v séru. PTH brání vzniku hypokalcémie za cenu demineralizace kostí. Každý den dochází k obratu 12 mmol (500 mg) kalcia mezi extracelulární tekutinou a kostmi.
Účinek je vyšší účinek na kostní tkáň, než na ledviny:
- 1. Kostní tkáň
- Indukce resorpce kosti s uvolněním kalcia do krevního oběhu, zvyšuje buněčnost kosti (jak osteoblasty, tak osteoklasty) s její následnou remodelací (tento účinek začíná až po několika hodinách od zvýšení hladiny PTH a přetrvává hodiny po jeho snížení). Osteoblasty obsahují přímo PTH/PTHrP receptory, osteoklasty je postrádají. Aktivita osteoklastů je zprostředkována nepřímo (osteoblasty uvolňují cytokiny, které aktivují osteoklasty).
- Chronická (trvalá) expozice zvýšené hladině PTH (hyperkalcémie) vede k osteoresorpci. Naopak intermitentní expozice PTH 1 – 2 hod denně vede k novotvorbě kostí (účinek je nejvyšší u trabekulární kosti – páteř, pánev a to zejména v kombinaci s estrogenem).
- 2. Ledviny
- zvýšení reabsorpce kalcia v distálním tubulu
- snížení reabsorpce fosfátů v proximálním tubulu
- stimulace 25(OH)D-1α-hydroxylázy se zvýšením konverze kalcidiolu na kalcitriol (1,25(OH) vitamín D), který zvyšuje resorpci kalcia z gastrointestinálního traktu.
Syntéza a struktura – PTH je syntetizován jako preproparathormon (115 aminokyselin), po odštěpení 25 aminokyselin (proparathormon) a dalších 6 aminokyselin vzniká parathormon (84 aminokyselin). K uvolnění PTH z buněk příštítných tělísek dochází několika způsoby:
- nejrychlejší (minuty) – uvolnění již syntetizovaného PTH jako reakce na hypokalcemii
- pomalejší (hodiny) – zvýšení exprese mRNA jako reakce na hypokalcémii
- nejpomalejší (dny) – indukce buněčné replikace a zvětšení celkové hmoty žlázy
- …tedy expedice skladových zásob, zrychlení výroby, zvětšení výrobních prostor.
PTH je protein o velikosti 84 aminokyselin s jedním řetězcem:
- N terminální část (1 – 34) je kritická pro biologickou funkci parathormonu, zejména její fragment 1 – 11, který aktivuje PTH/PTHrP receptor
- C terminální část se také váže separátně na cPTH-R, ale bez výraznějšího účinku
- určité fragmenty N terminální části naopak inhibují některé funkce jak biologicky aktivního fragmentu PTH (1 – 34), tak kompletní molekuly PTH (1 – 84)
Regulace – hladina PTH je regulována zpětnovazebně. Jeho produkci snižuje:
- Kalcium inhibuje sekreci PTH vazbou kalcia na CaSR (calcium sensing receptor) potlačuje sekreci PTH. Receptor se nachází v buňkách příštítných tělísek, C buňkách štítné žlázy, ale i mozku a ledvinách. Naopak, maximální sekreci PTH (5x oproti normálu), je dosaženo při kalcémii < 1,9 mmol/l, kdy je nejdůležitější jeho ionizovaná frakce. Nízká hladina kalcia a jeho vysoký příjem inhibuje proteolýzu depotního PTH (řádově během minut) a normální hladina kalcia a 1,25(OH)2D3 inhibuje transkripci (řádově během hodin). Heterozygotní bodové mutace těchto receptorů jsou hypofunkční (syndromy familiární hypokalciurické hyperkalcémie) nebo hyperfunkční (hypokalcémie připomínající hypoparatyreoidismus).
- Vitamín D (přes nukleární receptor)
- Hypomagnezémie (snižuje sekreci PTH)
- FGF 23(fibroblast growth factor 23), tzv. fosfáturický hormon
Metabolismus – k proteolýze PTH dochází zejména v játrech a ledvinách. Metabolismus PTH již není hladinou kalcia ovlivněn.
V oběhu se (kromě imunoreaktivního a biologicky účinného PTH, obsahujícího N-terminální část, která je kritická pro biologickou funkci) nachází i biologicky neúčinné fragmenty (střední a C-terminální řetězce). Toto někdy může být problém při měření hladiny PTH v séru. Imunochemické metody (1. a 2. generace), pomocí kterých se stanovuje hladina PTH, nereagují pouze s kompletní molekulou PTH, ale i s inkompletními N-terminálními fragmenty, které jsou přítomny, jak u normální populace, tak u uremiků. U pacientů s indukovanou hyperkalcémií a pacientů v chronickém renálním selhání je koncentrace těchto fragmentů vyšší, než u eukalcemických nebo hypokalcemických. Tyto fragmenty mají jen část biologicky účinné frakce molekuly PTH (zejména fragment 7-84) a mohou působit naopak jako inhibitory účinku PTH. Zejména u pacientů s chronickým renálním selháním, může snaha o prevenci sekundárního hyperparatyreoidismu (podávání analog vitamínu D, vyšší příjem kalcia, vyšší hladina kalcia v dialyzačním roztoku, snížení příjmu fosfátů) vést k oversupresi biologicky aktivního PTH se vznikem adynamické kostní nemoci (u dětí retardace růstu, u dospělých zvýšené riziko fraktur). Nejlepší cestou je měření hladiny PTH novými imunochemickými vyšetřeními (3. generace), kdy jsou protilátky namířeny proti extrémně N-terminálním epitopům a posuzují tedy pouze hladinu kompletní molekuly PTH (nikoliv fragmentů).
Parathyroid-hormone related peptide (PTHrP)
PTHrP je odpovědný za většinu případů paraneoplastické hyperkalcémie (syndrom připomíná hyperparathyreoidismus, ale bez elevace PTH). Tento peptid je produkován většinou tkání (mozek, pankreas, srdce, plíce, prsní žláza, placenta, endotelie a hladké svalstvo). U plodů řídí PTHrP kalciový transport transplacentárně. U matek dochází k sekreci velkého množství PTHrP do mateřského mléka (biologická signifikance zůstává neznámá). Dále hraje důležitou roli ve formaci enchondrální kosti, morfogenezy mammy a pravděpodobně při kontrakci dělohy a řadě dalších biologických funkcí. Funkce PTH a PTHrP jsou podobné. Gen pro PTHrP je ale rozsáhlejší a obsahuje řadu exonů, jejichž kombinacemi mohou vznikat různé finální produkty zejména o velikosti 139, 141 a 173 aminokyselin (navíc jejich specifickým proteolytickým štěpením v různých tkáních vznikají další peptidové produkty). Není jasné, zda je u dospělých jedinců jakékoliv množství v krvi fyziologické. Parakrinně může určité množství vznikat, ale je ihned lokálně likvidováno. PTHrP má u zdravých pacientů jen malý vliv na hladinu kalcia s výjimkou přítomnosti velkých tumorů (zejména dlaždicobuněčného karcinomu a karcinomu ledvin), u kterých excesivní produkce vede k hyperkalcémii.
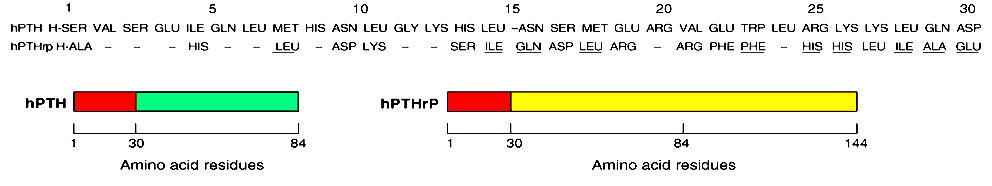
Receptory a biologická funkce – PTH receptory jsou velice konzervativní, evolučně je lze vystopovat až k rybám. PTH1R(PTH/PTHrP receptor) – člen rodiny GPCR (podobně jako receptory pro kalcitonin, glukagon, sekretin, VIP a některé ostatní). Přestože oba ligandy aktivují PTH1R, každý působí jinak. Extracelulární doména receptoru váže ligand, intracelulární doména váže podjednotku G proteinu, která přenáší signál dál stimulací tvorby „druhého posla“.PTH2R – je citlivý na stimulaci PTH (nikoliv na PTHrP) a TIP39 (tubular infundibular peptide of 39 residues – endogenní hypotalamický peptid). Je primárně exprimován v mozku, pankreatu a varlatech. Intracelulární domény receptorů se váží na podjednotku G proteinu, které aktivují proteinkinázy (A a C) a Ca 2+ transportéry, které jsou zodpovědné za řadu orgánově specifických pochodů: Dle myších modelů bylo zjištěno, že PTHrP má životně důležitou roli ve fetálním vývoji kosti (homozygotní mutace vede k akceleraci maturace chondrocytů s letální chondrodysplazií, u heterozygotů dochází k redukci kostní denzity s následnou osteoporózou). Dle myších modelů bylo zjištěno, že PTHrP má životně důležitou roli ve fetálním vývoji kosti (homozygotní mutace vede k akceleraci maturace chondrocytů s letální chondrodysplazií, u heterozygotů dochází k redukci kostní denzity s následnou osteoporózou).
Kalcitonin
Funkce a použití – peptidový hormon působící jako antagonista PTH, užívá se k léčbě těžké hyperkalcémie a Pagetovy choroby a diagnosticky jako nádorový marker při medulárním karcinomu štítné žlázy. Receptory pro kalcitonin jsou strukturálně podobné PTH1R. Mimo výše uvedené jsou přítomné i v gastrointestinálním traktu.
Účinek
- Kost – inhibice osteoklastů a resorpce kosti.
- Ledviny – snížení reabsorpce kalcia v distálním tubulu a zvýšení kalciurie.
- Mozek – analgetický efekt přímým působením na buňky hypothalamu.
Struktura – peptidový hormon o velikosti 32 aminokyselin. Kalcitonin z lososa má 10 – 100x vyšší biologický účinek než lidský kalcitonin.
Syntéza – k syntéze dochází v C buňkách štítné žlázy (z neurální lišty, během vývoje migrují do ultimobranchiálních tělísek, původem z 5. žaberního oblouku). Existují dva různé geny kódující kalcitonin:
- α – transkripcí vznikají dvě různé mRNA:
- 1. Pro preprokalcitonin
- 2. Pro CGRP (calcitonin gene related peptide), který je exprimován všude, kde je exprimována mRNA pro kalcitonin (např. i medulární karcinom štítné žlázy). CGRP má funkci kardiovaskulární, působí jako neurotransmiter a má pravděpodobně úloha při vývoji CNS
- β – transkripcí vzniká mRNA pro CGRP v CNS, ale již ne pro preprokalcitonin
Hladina cirkulujícího kalcitoninu je velice malá a za fyziologických podmínek se v ovlivnění kalciového a fosfátového metabolismu neuplatňuje. Je užíván terapeuticky k supresi kostní resorpce při Pagetově chorobě a osteoporóze a v léčbě paraneoplastické hyperkalcemie. Jeho jednoznačná fyziologická úloha není zatím jasná (genetické afunkční mutace genu pro kalcitonin na myším modelu vedou k redukci kostní denzity). Definitivně ještě není uzavřena otázka významu deficitu (pacienti po totální tyreoidektomii vyžadují substituci pouze tyroxinu) nebo nadbytku kalcitoninu (medulární karcinom štítné žlázy).
Hyperkalcémie
Nejčastější příčinou hyperkalcémie bývá hyperparathyreoidismus a poté malignita. Tyto dvě jsou odpovědny za 90 % všech případů hyperkalcémie.
Klinický obraz – při primárním hyperparatyreoidismu jsou pacienti většinou jinak asymptomatičtí. Naopak, při paraneoplastické hyperkalcémii je choroba již většinou symptomatická a tito pacienti obvykle nepřežívají déle než 6 měsíců, proto, pokud trvá hyperkalcémie nebo její komplikace (nefrolitiáza) déle než 1 rok, je malignita jako příčina vysoce nepravděpodobná. Při hypervitaminóze D, vysokém kostním obratu nebo renálním selhání často pomůže důsledně odebraná anamnéza. Lehká hyperkalcémie (2,75 – 2,9 mmol/l) bývá většinou asymptomatická a mírné příznaky se mohou projevit u citlivých nebo predisponovaných jedinců. Ty se většinou objevují až při závažnější hyperkalcémii (˃ 3,2 mmol/l), zejména pokud vznikla akutně:
- Obecné – slabost a ztráta hmotnosti
- Gastrointestinální – lehčí hyperkalcémie je zvýšená predispozice k peptickým vředům, u závažnějších forem se objevuje nauzea, nechutenství, zácpa a přidává se vysoké riziko vzniku pankreatitidy.
- Renální – zvýšené riziko nefrolitiázy a zhoršení koncentrační schopnosti ledvin s rozvojem polyurie a polydipsie.
- Při chronické hyperkalcémii bývá bolestivost kostí se zvýšením rizika fraktur.
- Kardiální – při chronické hyperkalcémii je zvýšená predispozice k hypertenzi. U závažných forem dochází k bradykardii s AV blokádami a zkrácením QT intervalu s rizikem srdeční zástavy v systole.
- Psychické – u lehké hyperkalcémie si citlivější osoby mohou stěžovat na přechodné neuropsychické příznaky, např. zhoršení koncentrace, změny osobnosti nebo deprese. U závažnější hyperkalcémie mohou příznaky progredovat do letargie, soporu až kómatu.
Závislost klinického obrazu na hladině kalcia je velmi individuální. Při hladině kalcia:
- > 3 mmol/l se většinou objevují první klinické příznaky.
- > 3,2 mmol/l se vyvíjí se kalcifikace ledvin, kůže, srdce a cév, plic a žaludku s možným rozvojem renální insuficience
- > 4,0 mmol/l – emergentní situace s rizikem kómatu a srdeční zástavy
Etiologie
I. Pseudohyperkalcémie
Vždy je ji nutné vyloučit (odběr je vhodné zopakovat). Většinou vzniká při výrazné hemokoncentraci nebo elevaci sérových proteinů (albumin).
II. Hyperkalcémie související s příštítnými tělísky
1. Primární hyperparatyreoidismus – epidemiologie – v populaci nad 60 let je incidence 1:100, diagnostikovaných 1:500, nejčastější věk záchytu je 30 – 50 let.
Etiologie
- 1. Solitární tumory příštítných tělísek – 80 % primárního hyperparatyreoidismu, většinou adenomy (karcinomy jsou vzácné).
- 2. Hyperplazie – většinou vrozené a spojené s jinými endokrinopatiemi.
- 3. Hereditární syndromy – dědičnost je AD, u MEN 1 byla popsána i AR.
- MEN 1 = adenom příštítných tělísek + hypofýzy + tumor pankreatu (tedy příštítná tělíska + hypofýza + pankreas). Často gastrinom (Zollinger – Ellisonův syndrom).
- MEN 2a = adenom příštítných tělísek + medulární karcinom štítné žlázy + feochromocytom.
- MEN 2b = viz MEN2a + neurofibromy, často chybí hyperparatyreoidismus.
- 4. Hyperparatyreotický tumor čelisti – často v rodinách s výskytem tumorů příštítných tělísek ve spojení s benigními tumory čelisti.
- 5. Nesyndromální familiární izolovaný hyperparatyreoidismus – u některých dětí s vrozeným hyperparatyreoidismem bez ostatních endokrinopatií. Spekuluje se o podobné příčině jako u MEN 1, MEN 2 nebo hyperparatyreotického tumoru čelisti, ale s jejich limitovanou expresí.
Patologie
- Adenomy – často lokalizovány ve spodních příštítných tělískách (v 6 – 10 % ektopicky v thymu, štítné žláze, perikardu nebo za jícnem). Nejčastější velikost je 0,5 – 5 g (mohou mít i 10 – 20 g).
- Hyperplázie – u hyperplazie dochází (podobně jak u adenomů) ke zvětšení zejména hlavních buněk s vymizením tuku, často bez nutného zvýšení hmotnosti žlázy.
- Karcinom je často neagresivní, pokud je zachycen v časném stadiu a extirpován en-block bez poškození capsuly, je dlouhodobé přežití běžné. Při recidivě roste velice pomalu, většinou s lokálním šířením. Někdy je svým růstem agresivní s metastazováním do plic, jater a kosti (histologicky přítomny častější mitózy a zvýšená fibrotizace). Klinicky je nerozlišitelný od jiných příčin primárního hyperparatyreoidismu, bývá těžší klinický průběh (kalcium v séru často > 3,5 mmol/l). CAVE Při exstirpaci je vždy je nutná snaha o zachování neporušené capsuly.
Molekulárně-genetická podstata jednotlivých poruch – jako u jiných typů hyperfunkčních tumorů je přítomna hyperfunkce protoonkogenů nebo afunkce tumor supresorových genů.
MEN I – Mutace na genovém lokusu MEN1 na chromozómu 11q13. Vrozená ztráta funkce jedné alely a následující získaná ztráta alely druhé vede ke vzniku monoklonální expanze. Mutace MEN1 je ale přítomna i v 15 – 20 % sporadických adenomů příštítných tělísek (ta samá mutace vede k izolovanému postižení příštítných tělísek, ale i vyjádřenému syndromu MEN I). MEN II – AD mutace genu RET(pro tyrozinkinázový receptor) vede k jeho konstitutivní aktivaci. Adenomy příštítných tělísek – 1. Mutace stále nedefinovaného genu na chromozómu 1p (40 % pacientů s primárním hyperparatyreoidismem). 2. Hyperfunkční mutace genu PRAD-1 (translokace, chromozóm 11, vedle promotoru pro PTH, kóduje cyklin D, protein hrající klíčovou roli v regulaci proliferace buněk). Lze nalézt u 20 – 40 % pacientů s adenomem příštítných tělísek). Karcinom příštítných tělísek – 1. Bialelická ztráta genu HRPT2 pro parafibromin (531 aminokyselin) se podílí na vzniku až 75 % všech tumorů příštítných tělísek. Původně identifikována jako příčina hyperparatyreotického tumoru čelisti. 2. Mutace genu Rb (chromozóm 13q14, kóduje tumorový supresor). Původně spojena s retinoblastomem, často se ale objevuje i u pacientů s karcinomem příštítných tělísek.
Klinický obraz – více než 50 % pacientů je asymptomatických. Postižení se manifestuje nejvíce na ledvinách a kostech:
- 1. Ledviny (20 % pacientů) – depozice kalcia v parenchymu ledvin s recidivující nefrolitiázou (z kalcium oxalátu nebo kalcium fosfátu), dále predispozice k obstrukci, infekci a zhoršení renálních funkcí.
- 2. Kosti – Osteitis fibrosa cystica – mnohojaderné osteoklasty ve vroubkovaných oblastech na povrchu kosti (Howshipovy lakuny) resorbují zejména kortikální kost (s relativním zachováním spongiózní kosti), která je následně nahrazena vazivem. Manifestuje se jako celková subperiostální resorpce (prokazatelné hlavně na koncích falang). Vyskytuje se u 10 – 25 % pacientů ve věku nad 50 let (pro časnější diagnostiku choroby je stále vzácnější). Množství kostní hmoty lze odhadnout dle DEXA (dual – energy x-ray absorption) nebo nových modalit CT. Kostní resorpce se dále manifestuje jako kostní cysty a hnědé tumory. Dále jsou přítomny komplikace hyperkalcémie.
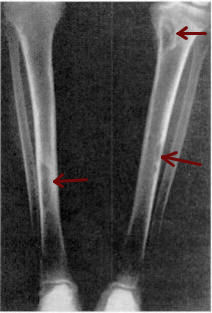

- 3. Nervový systém – závažné psychiatrické poruchy související s hyperkalcémií.
- 4. Muskuloskeletální – proximální svalová slabost s atrofií svalstva, únavnost, může imitovat primární nervosvalovou poruchu, ale na rozdíl od ní, po paratyreoidektomii dochází ke kompletnímu ústupu obtíží.
- 5. Gastrointestinální – často jen jako lehký břišní dyskomfort, predispozice ke vzniku akutní pankreatitidy (nejasný mechanismus vzniku). Při MEN I bývají součástí obrazu i žaludeční vředy z důvodu hypergastinémie (Zolinger – Ellisonův syndrom).
- 6. Kardiální – hypertrofie levé komory, srdeční selhání a endoteliální dysfunkce, predispozice ke vzniku arteriální hypertenze.
U většiny pacientů, kteří nejsou léčeni chirurgicky, mohou stav komplikovat kardiovaskulární a neuropsychiatrické příhody, často s dlouhodobými kostními poruchami.
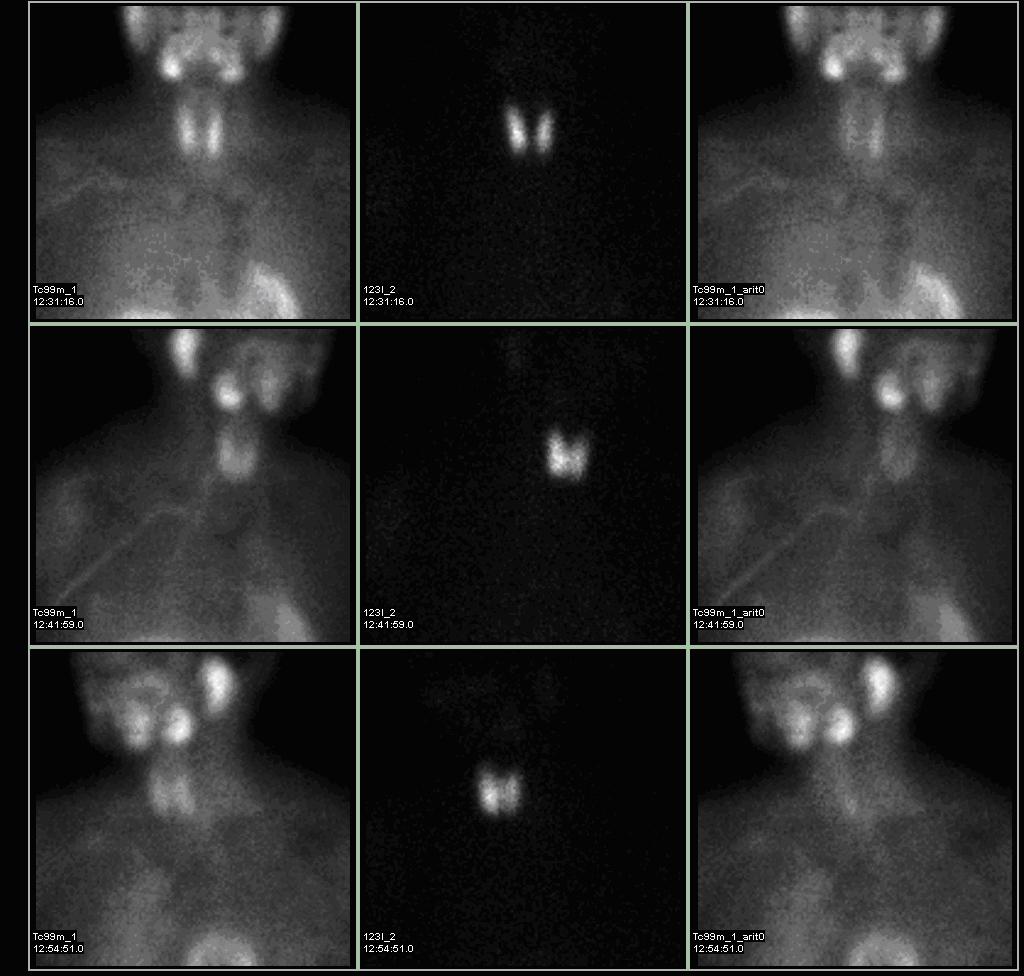
Diagnostika – laboratorním vyšetřením, lze prokázat hyperkalcémii, hypofosfatémii (při renálním postižení mohou být fosfáty v normě) a zvýšenou hladinu PTH. Zobrazovací metodou první volby je ultrazvuk příštítných tělísek, zvýšenou produkci PTH poté prokáže scintigrafie pomocí technecium sestamibi (99mTc).
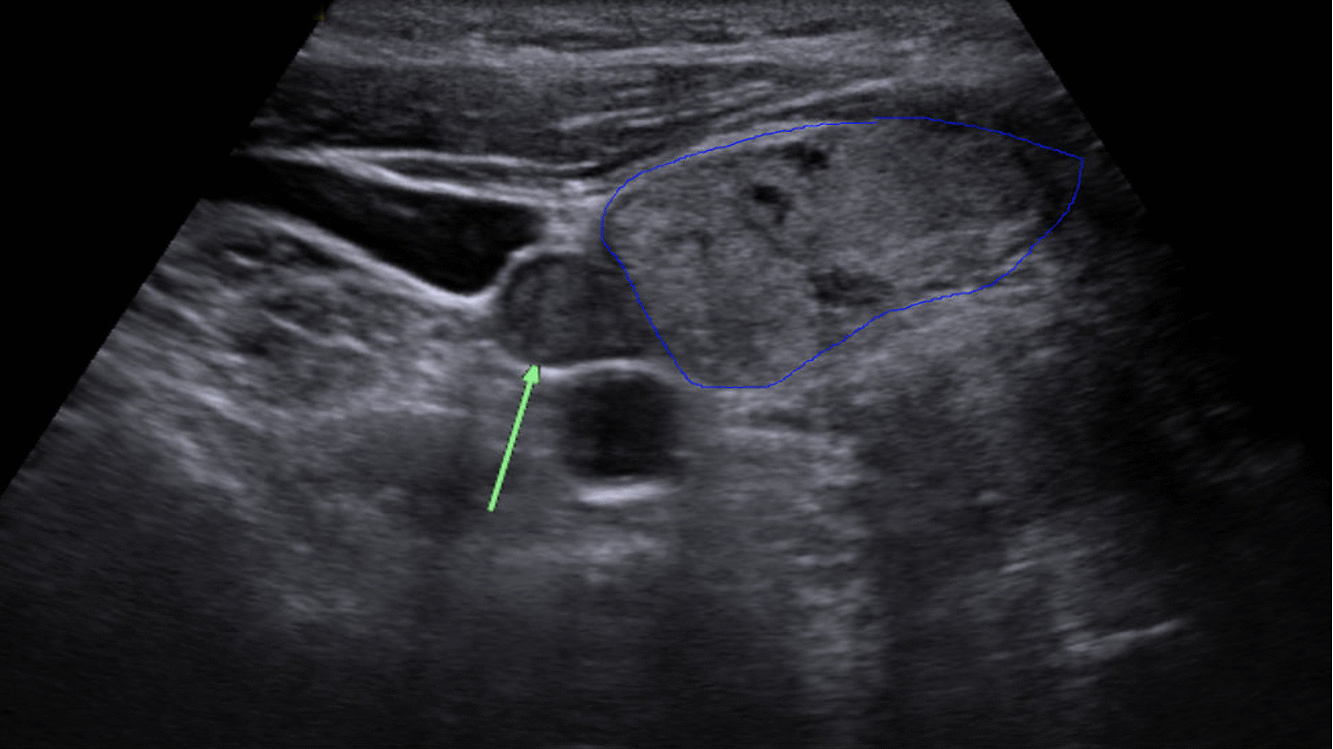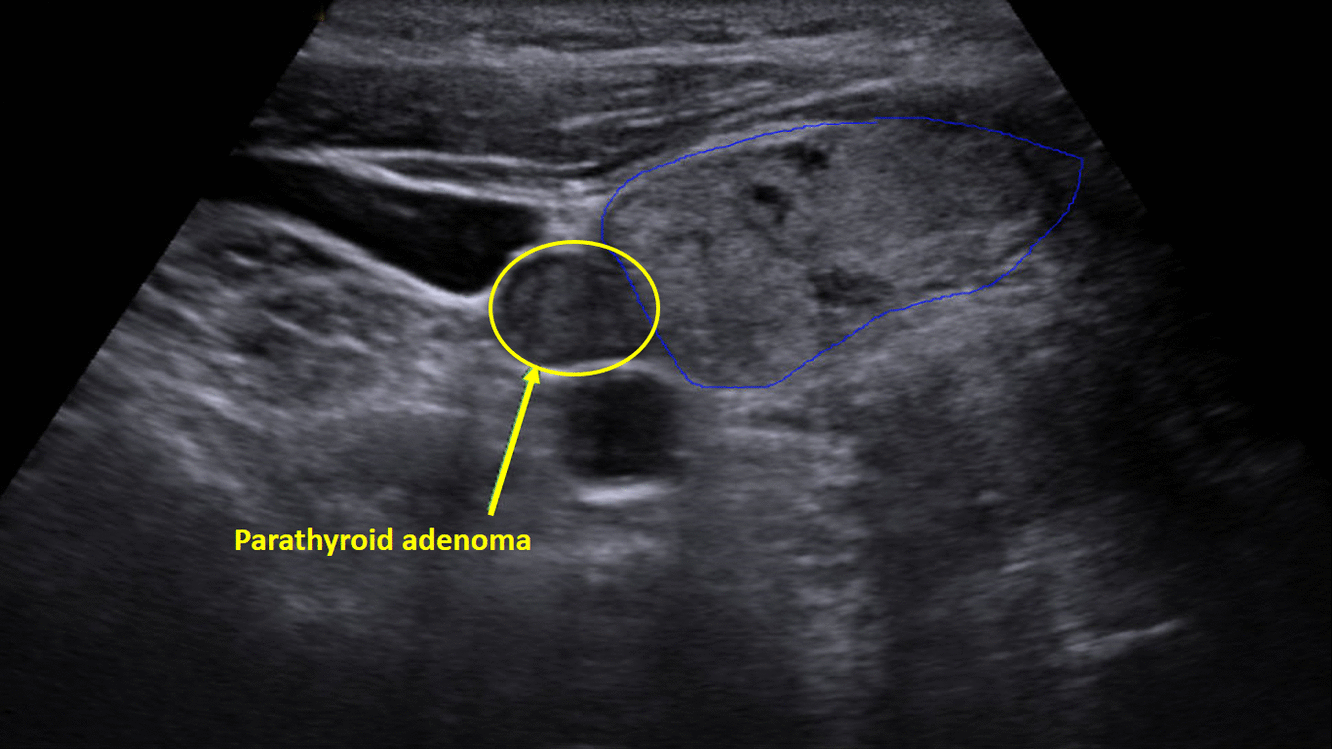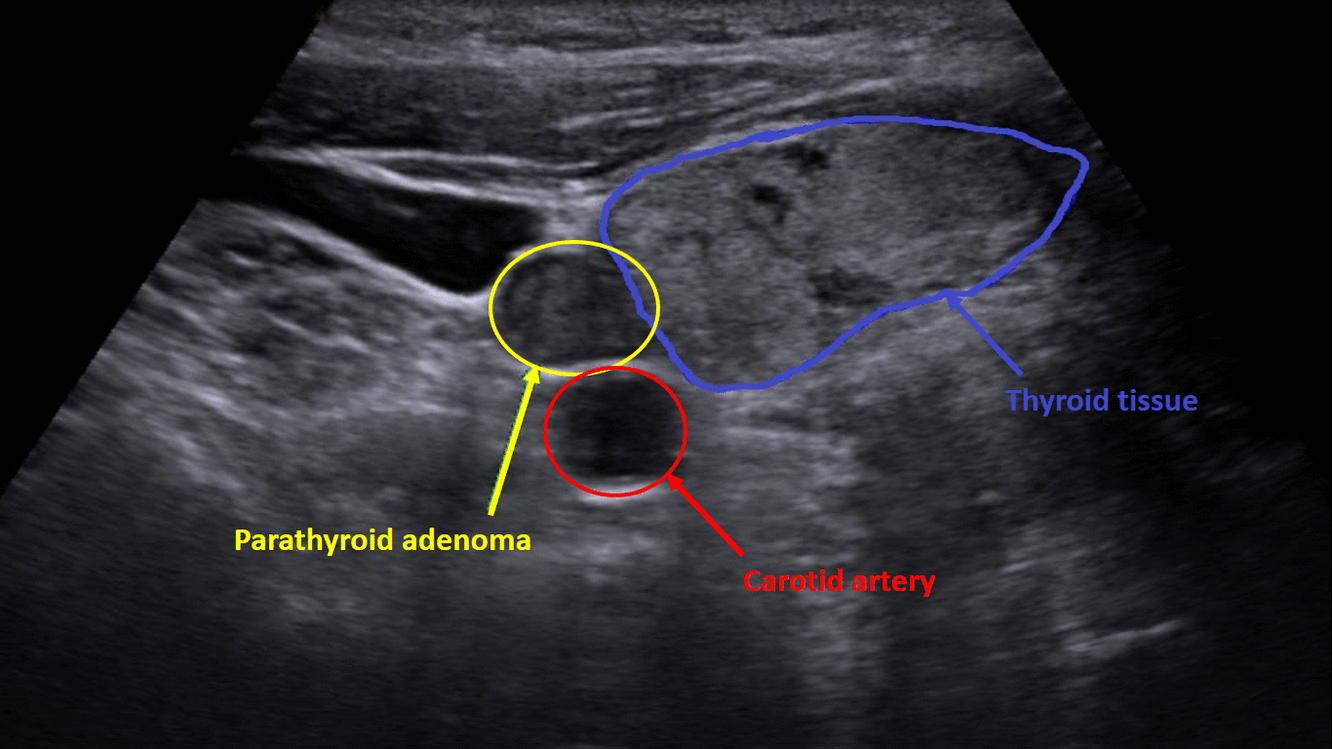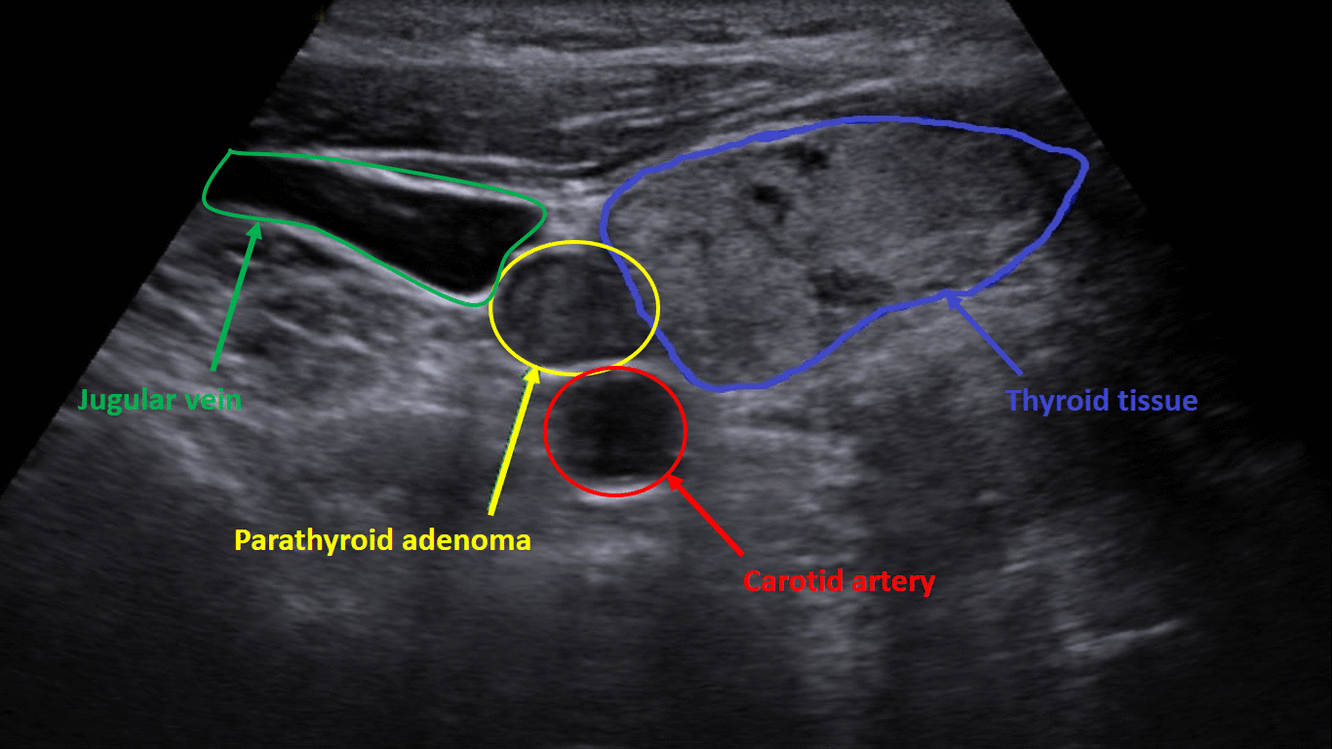
Terapie –
I. Farmakoterapie – některé asymptomatické pacienty lze léčit medikamentózně, musí ale splnit tyto kritéria (stále častěji je ale primárně preferována chirurgická intervence):
- Ca2+ < 3,0 mmol/l
- Glomerulární filtrace ˃ 1 ml/s
- Denzita kosti – T skóre < – 2,5 ve všech měřených lokalitách (vyloučení osteoporózy)
- Věk ˃ 50 let
Tedy starší pacienti s normální funkcí ledvin, bez výrazné hypokalcémie a bez osteoporózy (kontrola těchto parametrů by měla být prováděna minimálně 1x ročně). U ostatních pacientů by měla být provedena paratyreoidektomie. Z dlouhodobého hlediska (˃ 8 let) dochází i u těchto pacientů k poškození kostní hmoty. Používané léky:
- Bisfosfonáty – zvyšují kostní denzitu beze změny hladiny kalcia.
- Kalcimimetika – snižují hladinu kalcia, ale bez efektu na kostní denzitu.
- Estrogeny – sice také zvyšují kostní denzitu, ale nejsou doporučovány pro řadu jiných nežádoucích účinků
II. Chirurgická terapie – jde o definitivní vyřešení choroby. Léčbou volby je paratyreoidektomie v lokální anestezii minimálně invazivním přístupem nebo v celkové anestezii s otevřenou explorací krku. Vždy je snahou odstranit adenom příštítného tělíska, v případě podezření na karcinom je důraz na nepoškození jeho obalů.
1. Paratyreoidektomie s otevřenou explorací krku- s možností několika přístupů: 1. Přístup, že je vždy zvětšena jen jedna žláza a na ostatních není třeba další intervence- minoritní přístup, že by se měla odstranit většina tkáně všech žláz, protože je vysoké riziko zvětšení i na dalším tělísku a druhý výkon, v terénu pooperačních změn, sebou nese velké riziko iatrogenního hyporatyreoidismu. Převládá konsensus, že pokud je nalezena jedna žláza zvětšená a zbývající tři normální, je léčbou volby odstranění pouze zvětšené žlázy. 2. Paratyreoidektomie minimálně invazivním přístupem – Nová metoda, při které se předoperačně pomocí 99mTc sestamibi SPECT vyšetření stanoví přibližná poloha abnormální žlázy. Poté se suspektní adenom odstraní a následují laboratorní odběry PTH á 5 minut. Pokud je odebraná žláza správná, dochází k rychlému poklesu PTH (o více než 50 %) k normálním hodnotám. Tato metoda je nevhodná u pacientů se sekundárním hyperparatyreoidismem nebo MEN syndromem. 3. Při podezření na karcinom příštítných tělísek je nutná široká excize žlázy s důrazem na nepoškození obalu a tak zábranou lokální diseminace nádorových buněk. 4. U MEN syndromu je situace komplikovaná a musí být vizualizovány všechny čtyři žlázy. Existují dva přístupy: kompletní odstranění tří žláz a parciální odstranění čtvrté (musí být kladen důraz na zachování krevního zásobení ponechané části žlázy) nebo kompletní odstranění všech příštítných tělísek s následnou transplantací části jednoho tělíska do svaloviny předloktí. Při recidivě hyperparatyreoidismu je excize ze svalstva předloktí jednodušší, než z krajiny krku. Pokud není možné najít abnormální žlázu při potvrzeném primárním hyperparatyreoidismu, je nutné pokračovat v další exploraci, protože byly popsány případy pěti nebo dokonce i šesti příštítných tělísek. Při reoperaci je v nepřehledném pooperačním terénu nutné kombinovat ultrazvukové, CT, izotopové i angiografické mapování s možností využití perioperačních hladin PTH. V jednom US centru se využívá metody selektivní embolizace adenomu příštítného tělíska. Po úspěšné operaci dochází k rapidnímu poklesu PTH i sérové hladiny kalcia (začíná za 1 den po operaci a normalizuje se během 3 – 5 dnů).
Pooperační hypokalcémie vzniká při odstranění všech čtyř žláz. Projevuje se pooperačním poklesem kalcia < 2 mmol/l a nárůstem hladiny fosfátů. Pacienti s hyperparatyreoidismem zvýšeně resorbují dietní kalcium ze střeva díky vysokým hladinám 1,25 (OH)2D (způsobeno vysokou hladinou PTH). Pooperačně někdy (jako důsledek paratyreoidektomie) vzniká hypokalcémie. Pacienti by měli následně perorálně medikovat vysoké dávky kalcia. Při hladině kalcia < 2 mmol/l jsou typické křeče a svalové záškuby, úzkost a jiné psychické poruchy a pozitivní Chvostkův a Trousseaův příznak. Při symptomatické hypokalcémii se podává kalcium i.v. v dávce 0,5 – 2 mg/kg/hod. Pokud hypokalcémie přetrvává více než 2 – 3 dny, je vhodné k perorální suplementaci kalcia (2 – 4 g/den) přidat vitamín D, zejména kalcitriol v dávce 0,5 – 1 μg/den (rychlý nástup účinku). U pacientů po iatrogenně vzniklém hypoparatyreoidismu je vhodné pravidelně kontrolovat hladinu PTH. Při opětovném nárůstu PTH a hladiny kalcémie je pravděpodobná obnova funkce žlázy.
2. Hyperparatyreoidismus spojený s podáváním lithia – lithium pravděpodobně přímo stimuluje PTH receptor a snižuje tak jeho citlivost ke kalciu (k potlačení sekrece PTH je potřeba vyšší hladiny kalcia). Podávání lithia (bipolární afektivní porucha) je spojeno s hyperkalcémií u 10 % pacientů, která se spontánně normalizuje po jeho vysazení. Při pokračování medikace může vést kontinuální stimulace příštítných tělísek ke vzniku adenomu. Terapeuticky je nutná záměna lithia jiným psychiatrickým lékem.
III. Genetické defekty spojené s hyperparatyreoidismem
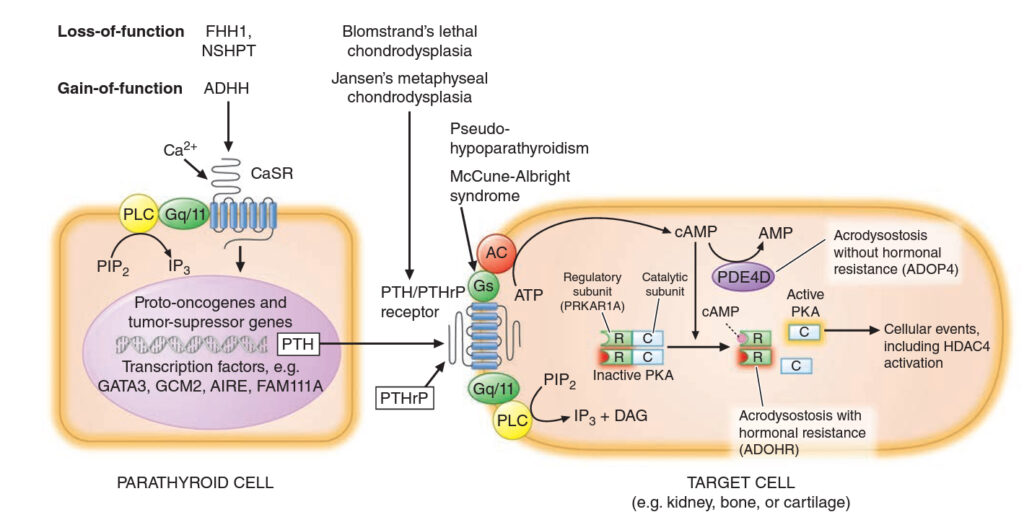
Některé genetické mutace postihující buňky příštítných tělísek nebo cílových tkání.
1. Familiární hypokalciurická hyperkalcémie (FHH) – AD dědičná inaktivační mutace CaSR, která vede k snížení schopnosti receptorů vázat kalcium a ty si následně „myslí“, že je přítomna hypokalcémie a stimulují sekreci PTH. Velmi vzácně vzniká hypokalciurická hyperkalcémie při přítomnosti anti-CaSR protilátek, většinou sekundárně při jiné autoimunitní nemoci. Většina pacientů je odhalena genetickým vyšetřením rodiny pacienta s hyperkalcémií. Metodou volby je léčba základní choroby. Diferenciální diagnostika:
- Věk manifestace – FHH < 10 let, primární hyperparatyreoidismus, MEN ˃ 10 let.
- Reabsorpce kalcia – FHH ˃ 99 % reabsorpce kalcia v ledvinných tubulech (primární hyperparatyreoidismus < 99 % reabsorpce).
- PTH – u FHH většinou normální hladina (může být i zvýšené), u primárního hyperparatyreoidismu je vysoká.
Paratyreoidektomie je nevhodná! Výjimkou je homozygotní mutace (většinou u příbuzenských svazků) se vznikem těžké novorozenecké hyperkalcémie, kdy je paratyreoidektomie ultimum refugium.
Několika pacientům se chybně provedla paratyreoidektomie, vedoucí k permanentnímu hypoparatyreoidismu, i přesto ale nadále přetrvávala hypokalciurie (důkaz, že hypokalciurie není závislá na PTH, ale na abnormalitě calcium sensing receptoru). Příštítná tělíska byla u těchto pacientů morfologicky normální.
2. Jansenova choroba – AD dědičná hyperfunkční mutace PTH/PTHrP receptoru. Přítomen nanismus s krátkými končetinami z důvodu abnormální maturace chondrocytů v růstových zónách dlouhých kostí. V dospělosti jsou v kostech mnohočetná ložiska osteoresorpce podobná primárnímu hyperparatyreoidismu. Laboratorně hyperkalcémie, hypofosfatémie, nízká nebo nedetekovatelná hladina PTH.

IV. Paraneoplastická hyperkalcémie
U cca 20 % onkologických pacientů (nejčastěji dlaždicobuněčný karcinom plic, dále karcinom ledvin, urogenitálního traktu a karcinomy v oblasti hlavy a krku), většinou ve již stádiu diseminace, někdy ale i při tumoru dosud ještě neobjeveném. Mechanismy vzniku hyperkalcémie:
- Sekrece PTHrP (zejména dlaždicobuněčný karcinom a tumory ledvin) se zvýšením resorpce kosti mechanismem podobným primárnímu hyperparatyreoidismu (přítomna je i hypofosfátémie).
- Autonomní produkce kalcitriolu u některých lymfomů.
- Přímá osteolýza zejména u hematologických malignit (leukémie, lymfomy, mnohočetný myelom) díky sekreci mnoha humorálních faktorů (PTHrP, OAF). OAF (osteoclast activating factor) je název pro několik různých působků (IL-1, TNF-α, lymfotoxin), které mají schopnost aktivovat osteoklasty.
Diagnostika je jednoduchá, protože ve stádiích tumoru, kdy je přítomna hyperkalcémie je tumor většinou již symptomatický (váhový úbytek, svalová slabost, nevysvětlitelná kožní erupce nebo specifické změny):
- 1. Laboratorní testy – kalcium ↑, fosfáty ↓ (hyperfosfáturie), PTH ↓, kalcitriol ↓ nebo normální. PTHrP ↑ zvýšený (ne všechny laboratoře umožňují detekci). U zdravých jedinců je nedetekovatelný (mimo těhotenství, hladina PTHrP je vysoká v lidském mléku).
- 2. Zobrazovací metody – RTG skeletu – průkaz osteolytických metastáz, scintigrafie s Tc značeným bisfosfonátem (senzitivita vysoká, specifita nízká).
Léčba je založena na léčbě základní choroby (zmenšení masy tumoru vede často k vyřešení hyperkalcémie, v pozdních stádiích tumoru může být hyperkalcémie výhodná, protože má mírné sedativní účinky) a léčbě akutní hyperkalcémie.
V. Hyperkalcémie související s vitamínem D
Může být způsobena požitím nadměrného množství vitamínu D (intoxikace) nebo autonomní produkcí (granulomatózní choroby). Metabolismus je regulován aktivitou renální 1α-hydroxylázy (zajišťuje vznik 1,25(OH)2D). Tato regulace není dostatečně vyvinuta u dětí a syntéza probíhá pouze v renálních tubulech. Ektopická tvorba 1,25(OH)2D vysvětluje hyperkalcémii u dětí s Williamsovým syndromem a dospělých se sarkoidózou nebo lymfomy.
1. Intoxikace vitamínem D – ke vzniku signifikantní hyperkalcémie je zapotřebí chronická dávka 40 – 100x přesahující fyziologickou potřebu organismu a je spíše způsobena nadměrným množstvím vitamínu 25(OH)D, než aktivním metabolitem 1,25(OH)2D. 25(OH)D má také (i když malý) biologický účinek (zejména na kosti a střeva) a navíc je jeho syntéza regulována méně precizně než 1,25(OH)2D. K diagnóze je nutné stanovení hladiny 25(OH)2D > 100 μg/l. Léčbou je ukončení příjmu vitamínu D, restrikce kalcia ve stravě spolu s dostatečnou hydratací a vyvarování se slunění. U těžkých intoxikací je indikováno podání glukokortikoidů (hydrokortizon 100 mg/den nebo jeho ekvivalent).
CAVE Hyperkalcémie může být dlouhodobá, protože vitamín D se ukládá v tuku a odtud se uvolňuje velmi postupně.
2. Sarkoidóza a jiné granulomatózy – hyperkalcémie spojená s granulomatózami se týká sarkoidózy, tuberkulózy a mykóz. Nadbytečná konverze 25(OH)D na 1,25(OH)2D, který je ektopicky syntetizován zejména v makrofázích, ale i ostatních buňkách granulomů (vysoká hladina 1,25(OH)2D s hyperkalcémií byla zaznamenána i u pacientů po bilaterální nefrektomii se sarkoidózou), kdy je deregulována aktivita 1α-hydroxylázy. Pokud není současně přítomen hyperparatyreoidismus, je hladina PTH nízká. Léčba v podstatě odpovídá intoxikaci vitamínem D, tedy vyvarování se slunění, restrikce kalcia a vitamínu D v potravě, dostatečná hydratace a glukokortikoidy (v ekvivalentní dávce 100 mg hydrokortizonu/den) pomáhají kontrolovat hyperkalcémii, pravděpodobně blokádou nadbytečné syntézy 1,25(OH)2D.
3. Williamsův syndrom – AD dědičná mikrodelece v lokusu pro elastin na chromozómu 7. Vzniká abnormální senzitivita vůči vitamínu D nejasného mechanismu. Charakteristický obraz: hyperkalcémie + supravalvulární stenóza aorty + mentální retardace + obličej skřítka. Laboratorně lze nalézt elevace 1,25(OH)2D (150 – 500 ng/l).

VI. Hyperkalcémie související s vysokým kostním obratem
1. Hypertyreóza – u 20 % pacientů s hypertyreózou se vyskytuje hyperkalcémie, protože osteoresorpce převyšuje osteosyntézu. Přítomna je většinou jen mírná hyperkalcémie spolu s hyperkalciurií. Léčbou je korekce hypertyreózy, (TSH má osteoprotektivní účinek).
2. Imobilizace – při imobilizaci převyšuje osteoresorpce osteosyntézu. Většinou se vyskytuje u dětí, jen vzácně u dospělých (často u para- nebo kvadruplegiků). Imobilizace může zároveň precipitovat tendenci k hyperkalcémii u komorbidit (např. Pagetova choroba). Ke korekci hyperkalcémie dochází po mobilizaci pacienta.
3. Intoxikace vitamínem A – vzniká nejčastěji díky dietním absurditám. Dochází ke zvýšení osteoresorpce. Kalcémie je většinou 3,0 – 3,5 mmol/l po chronickém užívání 50 – 100 tisíc IU vitamínu A (10 – 20ti násobek minimální doporučené denní dávky). Laboratorně lze prokázat hypekalcémii, hyperfosfatémii, nízký PTH i PTHrP a zvýšenou hladinu vitamínu A. Na RTG skeletu je periostální osteoresorpce (zejména kostí ruky). Léčbou je vysazení vitamínu A a podání glukokortikoidů (hydrokortizon 100 mg/den nebo jeho ekvivalent).
VII. Hyperkalcémie související s renálním selháním
1. Sekundární hyperparatyreoidismus – příčinou může být:
- 1. Pseudohypoparatyreoidismus
- 2. Deficit vitamínu D
- 3. Renální selhání
- 3a. Renální osteodystrofie– sekundární hyperparatyreoidismus při CKD
- 3b. Adynamická kostní choroba při iatrogenní oversupresi
- 3c. Léčba aluminiovými vazači fosfátů, při které dochází k depozici hliníku v zónách mineralizace osteoidu s inhibicí aktivity osteoblastů i inkorporace kalcia do skeletu. K hyperkalcémii dochází po zahájení léčby vitamínem D nebo jeho analogy (kalcium, které se nadbytečně vstřebá je pouze minimálně inkorporováno do skeletu). Porucha je vzácná, protože aluminiové vazače fosfátů jsou v současnosti již jen málo používané.
Patofyziologie – hlavní příčinou je rezistence k normálním hladinám PTH s následným rozvojem hypokalcémie, která vede ke kompenzatornímu zvětšení příštítných tělísek. Přítomno je zvýšení hladiny FGF23, fosfáturického hormonu, který je produkovaný osteocyty a pravděpodobně i osteoblasty s následným zvýšením hladiny PTH. Je také silným inhibitorem renální 1α-hydroxylázy, se snížením hladiny 1,25(OH)2D, což také stimuluje sekreci PTH.
Klasifikace hyperparatyreoidismu
- Primární – autonomní a ireverzibilní růst příštítných tělísek
- Sekundární – růst příštítných tělísek je kompenzatorní a ustupuje po odstranění příčiny
- Terciární – klonální, ireverzibilní růst příštítných tělísek jako následek dlouhodobé stimulace sekundárním hyperparatyreoidismem (zejména chronické renální selhání).
Klinický obraz – bolestivost kostí, ektopické kalcifikace, pruritus
Terapie
- 1. Režimová opatření – snížení příjmu fosfátů + opatrná substituce vitamínem D
- 2. Farmakoterapie
- vazače fosfátů – kalcium karbonát (preferován před aluminiovými látkami jako prevence kostní choroby indukované aluminiem), sevelamer v případě nevhodnosti substituce kalcia.
- vitamín D – kalcitriol (0,25 – 2 μg/den, úvodem možno podávat intravenózně)
- 3. Chirurgická terapie – v případě přechodu do terciárního hyperparatyreoidismu s těžkým průběhem (začátek autonomního růstu příštítných tělísek) je nutná paratyreoidektomie.
2. Milk-alkali syndrom – po zavedení PPI namísto antacid je velice vzácný. Vzniká vysokým příjmem kalcia+ absorbovatelných antacid (mléko nebo kalcium karbonát). Velmi důležitá je individuálně daná frakční resorpce kalcia ze střeva (u některých pacientů se milk-alkali syndrom vyvine, u jiných při stejné dávce ne).
Zvýšený příjem kalcia vede k hyperkalcémii s aktivací CaSR v renálních tubulech. To vede k inhibici Na-K-2Cl antiportu v Henleove kličce a poklesu ADH. Dochází k indukci natriurézy a vzniku hypovolémie. Tento stav stimuluje reabsorpci bikarbonátu v renálních tubulech se vznikem alkalózy, která zase stimuluje reabsorpci kalcia v distálním tubulu.
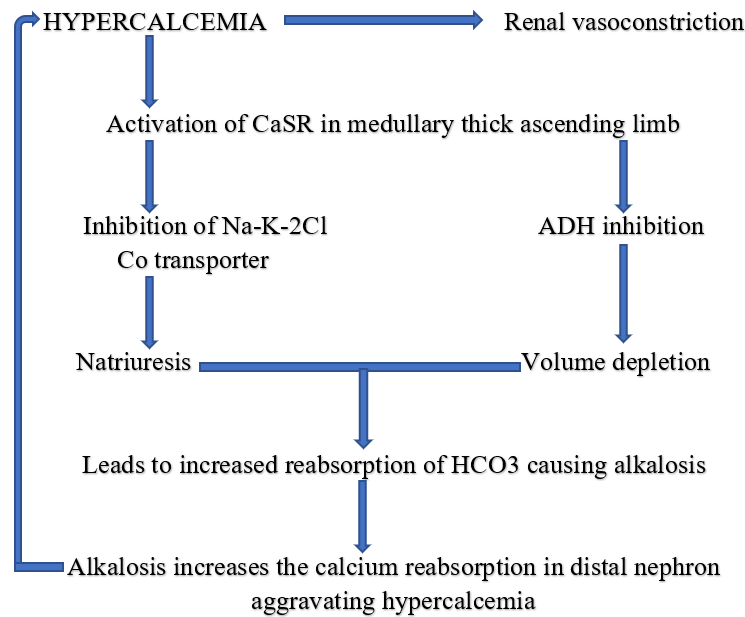
Klinicky je spojen s hyperkalcémií + alkalózou + renálním selháním. Má různý průběh:
- akutní nebo subakutní je reverzibilní po zastavení příjmu kalcia a antacid
- chronický (Burnettův syndrom) je spojen s ireverzibilním poškozením ledvin
Diferenciální diagnostika hyperkalcémie
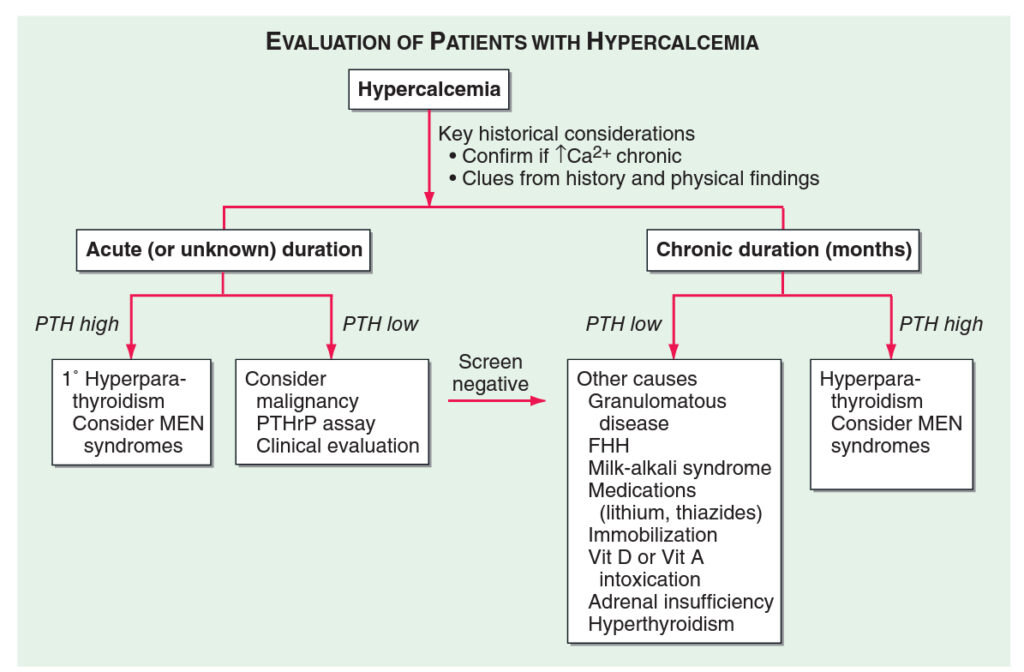
Více než 90 % hyperkalcémií je způsobeno primárním hyperparatyreoidismem nebo paraneoplasticky (v případě, že je hyperkalcémie přítomna déle než jeden rok, paraneoplastická příčina je vyloučena, protože paraneoplasticky se hyperkalcémie vyskytuje až v pozdních stádiích onkologického onemocnění a tito pacienti by tak dlouho nepřežily). Kroky:
1. Stanovení hladiny albuminu – 50 % plazmatického kalcia je v ionizované formě. Tato frakce je laboratorně stanovitelná, ale vlastní hodnota je často ovlivněná nesprávnou technikou odběru nebo laboratorní chybou, proto je snadnější celkové kalcium korigovat na hladinu albuminu:
Cakorig = Cacelk + 0,02 · ( 41,3 – S-albumin)
Jinými slovy, při poklesu koncentrace albuminu v séru dochází k nárůstu ionizovaná frakce v séru (pro zapamatování: „ta část, která by byla navázána na albumin, se uvolní do séra“).
2. Důsledný odběr anamnézy (to by ale měla být samozřejmost 🙂 – anamnesticky i fyzikálním vyšetřením je nutné se zaměřit na dvě nejdůležitější příčiny chronické hyperkalcémie a to primární hyperparatyreoidismus a maligní tumory. Z dalších příčin na užívanou medikaci, předchozí chirurgické zákroky v oblasti krku (zejména na štítné žláze) a příznaky sarkoidózy nebo lymfomu.
3. Stanovení hladiny PTH – příčinou zvýšení PTH (často provázeno současnou hypofosfatémií) bývá většinou primární hyperparatyreoidismus. Nutné vyšetření renálních funkcí, protože při hyperkalcémii dochází k jejich alteraci se současným snížením renálního clearance PTH. Další příčinou je lithiem indukovaná hyperkalcémie. Ektopická sekrece PTH je extrémně vzácná. Vždy je potřeba vyloučit familiární hypokalciurickou hyperkalcémii. K tomuto bývá zapotřebí stanovit poměr clearance kalcium/kreatinin:
Clearance Ca/kreat = (Camoč / Caplazma) / (kreatmoč / kreatplazma)
Při poměru ˂ 0,01 a zejména pozitivní rodinné anamnéze asymptomatické hyperkalcémie je pravděpodobnost FHH poměrně vysoká.
Při snížení PTH a současné hyperkalcémii bývá příčina mimo příštítná tělíska, nejčastěji z důvodu přítomného maligního tumoru. Pokud laboratoř umožňuje stanovení hladiny PTHrP, tak její zvýšení toto podezření potvrzuje s nejvyšší pravděpodobností. Při přítomnosti osteolytických metastáz bývá hladina PTHrP normální.
4. Stanovení hladiny 1,25-OH vitamínu D – velice nespecifická i nesenzitivní.
- Zvýšená – primární hyperparatyreoidismus (většinou), sarkoidóza, některé lymfomy.
- Normální nebo snížená – ostatní druhy hyperkalcémií.
5. Hladina PTHrP (pokud je technicky možné)
Terapie hyperkalcemických stavů
- Lehká hyperkalcémie (< 3 mmol/l) – hydratace
- Střední hyperkalcémie (3,1 – 3,7 mmol/l) – nutná agresivnější terapie
- Závažná hyperkalcémie (> 3,8 mmol/l) – život ohrožující stav, nutná akutní léčba
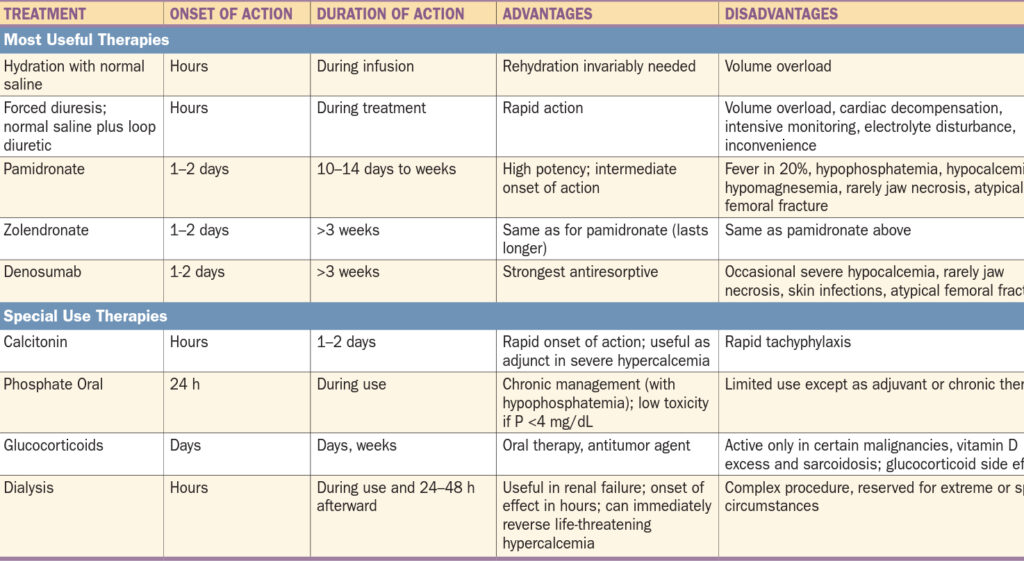
Je vždy nutné zaléčit pacienta ve smyslu vyvolávající příčiny:
- Paraneoplastická hyperkalcémie vzniká excesivním uvolněním kalcia z kostí, je vhodné podání bisfosfonátů (téměř nezareaguje na dietní restrikci kalcia).
- Hyperkalcémie spojená s vitamínem D vzniká excesivní absorpcí kalcia ze střeva a proto reaguje příznivě na dietní restrikci kalcia.
- Při hyperkalcémii spojené s renálním selháním klesá renální exkrece kalcia a proto je příznivá reakce na hydrataci.
1. Hydratace fyziologickým roztokem – mnoho pacientů s hyperkalcémií je dehydratovaných pro časté zvracení, vyčerpání a poruchu koncentrační schopnosti ledvin. Prerenální poškození ledvin dále zhoršuje vylučování natria a kalcia. Rehydratace normalizuje vylučování kalcia močí (2,5 – 7,5 mmol/den).
2. Forsírovaná diuréza – zvýšení exkrece natria močí (400 – 500 mmol/den) zvyšuje i exkreci kalcia. Tohoto se dosahuje současným podáním furosemidu. Forsírovanou diurézou (fyziologický roztok + kličkové diuretikum) lze dosáhnout exkrece kalcia ˃ 12,5 mmol/den. Je nutné se vždy vyvarovat deplece draslíku a magnézia a také hypo-/hypervolémie.
3. Bisfosfonáty – jsou vhodné u paraneoplastické hyperkalcémie. Analoga pyrofosfátu s vysokou afinitou ke kosti (zejména v oblastech vysokého kostního obratu), kde inhibují osteoklasty a osteoresorpci. Recentně se objevují důkazy o souvislosti léčby bisfosfonáty se vznikem nekrózy čelisti (zejména po stomatochirurgických výkonech). Bisfosfonáty jsou in vivo stabilní, protože fosfatázy neumějí hydrolyzovat centrální -C-P-C- skupinu.
Mechanismus účinku je komplexní. Molekula bisfosfonátu obsahuje aminoskupinu v bočním řetězci, která interferuje s prenylací proteinů (přidání hydrofobní molekuly) s následnou apoptózou buňky, vysoce aktivní neaminové skupiny se mohou také metabolizovat na cytotoxické produkty.
- 1. generace – klodronát – zejména k léčbě hyperkalcémie spojené s malignitou (BONEFOS 400, 800 mg, 1x denně 1600 – 3200 mg úvodem, dále dle kalcémie). četné nežádoucí účinky (zejména současná blokáda osteoprodukce)
- 2. generace – alendronát, pamidronát
- 3. generace – ibandronát (BONVIVA ,150 mg 1x měsíčně), zolendronát (ACLASTA 5 mg/100 ml 1x ročně), risendronát, tiludronát, olpadronát
4. Kalcitonin – přes receptory na osteoklastech působí blokádu osteoresorpce. Účinek začíná po několika hodinách a přetrvává maximálně jeden den. Proto se kalcitonin používá spolu s rehydratací a forsírovanou diurézou ke zvládnutí akutního stavu, než začnou účinkovat účinnější léky (např. bisfosfonáty). Dávka 2 – 8 IU/kg i.v., s.c. nebo i.m. každých 6 – 12 hodin.
Ostatní terapie – plicamycin inhibuje osteoresorpci, ale je nyní užíván pouze zřídka (stejně účinný jako bisfosfonáty, ale s mnohem většími nežádoucími účinky). Doporučená dávka je 25 μg/kg i.v. Gallium nitrát inhibuje osteoresorpci, nyní téměř neužíván.
5. Glukokortikoidy – indikovány u paraneoplastické hyperkalcémie, předávkování vitamínem D a sarkoidóze. Při primárním hyperparatyreoidismu jsou bez efektu. Zvyšují exkreci kalcia močí a snižují jeho střevní absorpci, na druhou stranu, ale negativně ovlivňují skelet jako jejich obecný nežádoucí účinek. Efekt léčby se objevuje během několika dnů. Běžná dávka je 40 – 100 mg prednisonu (nebo ekvivalentu) rozdělené ve čtyřech dávkách.
6. Fosfáty – korekce hypofosfátémie snižuje sérové kalcium (zejména změna kostního obratu kalcia). Mají limitovaný význam, intravenózní podání fosfátů může vést k fatální hypokalcémii, proto je jejich podávání vyhrazeno pouze pro nejzávažnější hyperkalcemické krize, kde není možné použít hemodialýzu. Podává se 1,0 – 1,5 g fosforu denně během několika dní.
7. Hemodialýza – při těžké hyperkalcémii (zejména ve spojení s renálním selháním). Během hemodialýzy dochází k velkým ztrátám anorganického fosfátu s možností zhoršení hyperkalcémie, proto se fosfatémie po dialýze musí kontrolovat. Podobně snižuje kalcémii i peritoneální dialýza s bezkalciovým roztokem.
Hypokalcémie
Patofyziologie – akutní hypokalcémie se vyskytuje zejména při akutních stavech:
- při hypoalbuminémii se zvyšuje podíl ionizované frakce (˃ 50 % pacientů na ICU má koncentraci sérového kalcia < 2,1 mmol/l)
- u těžké sepse bývá snížena i hladina ionizovaného kalcia
- při alkalóze se ionizované kalcium zvýšeně váže na proteiny
- při akutní pankreatitidě vyvazují nekrózy kalcium (tíže hypokalcémie odpovídá závažnosti pankreatitidy)
Klinický obraz
- Svalové příznaky- karpopedální, faciální spasmy, v extrémním případě i laryngospasmus a křeče s respirační zástavou. Pozitivní Chvostkův a Trousseauv příznak.
- Kardiální příznaky – prodloužení QT intervalu, zhoršení účinku digitalisu
- Neurologické příznaky – při dlouhodobé, závažné hypokalcémii může vzniknout edém mozku a papily, kalcifikace bazálních ganglií a extrapyramidový syndrom.
- Psychiatrické příznaky – podrážděnost, deprese, psychózy
- Oční příznaky – lentikulární katarakta (při včasné léčbě často reverzibilní)
- Kožní příznaky- chronické změny nehtů a vlasů
- Gastrointestinální příznaky – steatorea, pro nedostatečnou produkci pankreatických enzymů a žlučových kyselin
Etiologie
- akutní hypokalcémie – akutní renální selhání, alkalóza, akutní pankreatitida, hypoalbuminémie (popáleniny, sepse) nebo následek medikace (velké množství transfúzí s citrátovou krví, heparin, protamin, glukagon).
- chronické hypokalcémie – hypoparatyreoidismus, deficit vitamínu D, pseudohypoparatyreoidismus, hypomagnézémie (porucha sekrece i rezistence vůči PTH, snížená hladina PTH).
I. Hypokalcémie při nízkém PTH
Vrozená nebo získaná. Při vrozené příčině bývá vývoj pozvolný a je spojen s řadou jiných poruch.
a) Vrozená
1. DiGeorgův syndrom – AD dědičný defekt genu DSG1 (22q11.2, pro transkripční faktor TBX1, mikrodelece) nebo DSG2 (10p). Pacienti umírají v dětství na závažné infekce, kardiovaskulární komplikace nebo hypokalcémii (při inkompletně vyjádřené formě se mohou dožít i dospělosti). Mimotechnická pomůcka k zapamatování příznaků: CATCH 22
- Cardiac abnormality (nejčastěji Fallotova tetralogie, vzácněji přerušení aortálního oblouku nebo jen defekt septa síní nebo komor).
- Abnormal face (hypertelorismus, široké philtrum, malá brada, nízce položené a dozadu rotované uši) + mentální retaradace
- Thymic aplasia (T-lymfocytární imunodeficit různé závažnosti)
- Cleft (rozštěp rtů)
- Hypoparathyreoidismus (v dospělosti se jen vzácně klinicky projevuje, může být zvýšená kazivost zubů)
- 22. chromozóm

2. HDR syndrom – AD dědičná translokace na chromozómu 10 (gen pro transkripční faktor GATA3), který je důležitý pro embryonální vývoj a je exprimován v příštítných tělískách, uších a ledvinách). Triáda: Hypoparatyreoidism + Deafness + Renal dysplasia (hypoparatyreoidismus, hluchota, renální dysplázie).
Následující dva syndromy vykazují defekt proteinu TBCE, který souvisí s funkcí tubulinu:
- Kenney-Caffeyho syndrom – hypoparatyreoidismus + malá postava + osteoskleróza + silná kortikální kost.
- Sanjad-Sakatiho syndrom – AR dědičná choroba, vyskytuje se zejména na Středním Východě (hlavně Saudská Arábie).
Následující syndromy jsou spojeny s mitochondriální dysfunkcí a myopatií:
- Kearns – Sayreho syndrom – oftalmoplegie + pigmentová retinopatie.
- MELAS syndrom – Mitochondriální dysfunkce + Encefalopatie + Laktátová Acidóza + Stroke-like epizody
3. Autoimunitní polyglandulární syndrom I. typu – defekt genu AIRE (autoimmune regulator, 21q22.3). Hypoparatyreoidismus + adrenokortikální insuficience + rekurentní mukokutánní kandidóza + ovariální dysfunkce + alopecie s vitiligem + perniciózní anémie + defekt imunity.
4. Autozomálně dominantní hypokalcemická hyperkalciurie – aktivační mutace genu pro CaSR. Receptor vyhodnocuje mylně okolní koncentraci kalcia jako vysokou s následnou supresí sekrece PTH a excesivním vylučováním kalcia močí, což vede k hypokalcémii.
CAVE Zahájení léčby vitamínem D vede k extrémnímu zhoršení hyperkalciurie (až několik gramů denně) s rozvojem nevratného poškození ledvin a vznikem ektopických kalcifikací.
5. Autoprotilátky aktivující CaSR – přítomnost autoprotilátek proti CaSR, které jej aktivují, vedou k supresi PTH a hypokalcémii.
6. Bartterův syndrom typ V – hyperfunkční mutace receptoru CaSR s následnou hypokalcémií a hyperkalciurií.
7. Inaktivační mutace GCMB – AR nebo AD dědičná inaktivační mutace transkripčního faktoru GCMB specifického pro příštítná tělíska.Bylo popsáno několik vzácných izolovaných defektů:AD forma – bodová mutace v signální sekvenci, která je kriticky důležitá v intracelulárním transportu prekurzorů hormonu. Záměna Arg → Cys může působit jako trigger apoptotických buněčných mechanismů. 1. AR forma – blokuje štěpení prekurzoru PTH na zralou molekulu PTH 2. AR forma – defekt jednoho nukleotidu vede k poruše připojení exonu, který obsahuje promoter , nedochází tedy k transkripci genu. X forma – postiženi pouze muži, defektní je SOX3 gen (Xq26-q27).
b) Získaná
1. Primární – iatrogenně po odstranění příštítných tělísek (zejména při tyreoidektomii nebo při odebrání příliš velké hmoty příštítných tělísek po paratyreoidektomii).
2. Sekundárně – útlak cév zásobujících příštítná tělíska následkem fibrotizace po operaci krku, radiační poškození po ozáření krku nebo podání radiojódu, hemochromatóza, tranzientní hypoparatyreoidismus po paratyreoidektomii (po různě dlouhém období se normalizuje).
Terapie hypoparatyreoidismu – p.o. kalcium a vitamín D nebo kalcitriol. Dávky ≥ 1 gram kalcia a 40000 – 120000 U/den (přitom normální dávka je 200 U/d, u starších pacientů 800 U/d). Mnozí lékaři nyní používají přímo 1,25(OH)2D v dávce 0,25 – 1,0 μg/den (zejména u obtížně kontrolovatelných pacientů), protože oproti vitamínu D má kalcitriol mnohem kratší poločas – týdny v.s. dny). U většiny pacientů se kalcémie normalizuje, někdy ale pacienti fragilně alternují mezi hypo- a hyperkalcémií. Tato léčba nezvyšuje resorpci kalcia v ledvinách, proto je po substituci třeba počítat se zvýšeným vylučováním kalcia moči a rizikem nefrokalcinózy nebo nefrolitiázy. U pacientů s nízkou hladinou PTH a nízkosodíkovou dietu mohou výrazně snižovat odpad kalcia močí thiazidy. U obtížně kontrolovatelných pacientů je možné použít přímo substituci PTH s následným zvýšením kalcémie a snížením kalciurézy. Tato léčba ale dosud nebyla schválena.
c) Hypomagnezémie
Magnézium se ve vztahu k PTH chová podobně jako kalcium, tedy nízké hladiny magnesia vedou ke zvýšení PTH (odpověď je méně výrazná, proto jsou potřeba větší změny v koncentraci magnézia než u kalcia), na druhou stranu velmi těžká hypomagnezemie (< 0,4 mmol/l) sekreci PTH paradoxně snižuje vzhledem k poruše sekrece PTH buňkami příštítných tělísek (magnesium je kofaktorem adenylát cyklázy). Hypomagnézémie navíc snižuje periferní odpověď na PTH. Tedy i přes těžkou hypokalcémii jsou při těžké hypomagnezémii velice nízké hladiny PTH a normální hladina fosfátů (na rozdíl od vrozeného nebo získaného hypoparatyreoidismu). Základem je suplementace magnézia, která by měla probíhat i.v. podáním. Pro přítomný intracelulární deficit, je třeba pokračovat v substituci i přes normalizaci sérového magnézia (po rychlém vysazení může dojít k opětovnému vzniku hypomagnézémie).
II. Hypokalcémie při normálním nebo zvýšeném PTH
a) Porucha funkce vitamínu D
1. Chronické renální selhání
Patofyziologie – při porušené konverzi kalcidiolu na kalcitriol v buňkách proximálního tubulu při postižení ledvin se snižuje resorpce kalcia ve střevech, vzniká hypokalcémie se sekundárním hyperparatyreoidismem a následná renální osteodystrofie. Hyperfosfátémie vzniká až v pozdních stádiích CKD a snižuje hladinu kalcia několika mechanismy:
- extraoseální kalcifikace
- zhoršení funkce PTH (osteoresorpce a funkce osteoklastů)
- snížení syntézy kalcitriolu v reziduální tkáni ledvin
Zvýšená hladina FGF23 je přítomna již v časných stádiích CKD a velice dobře koreluje s mortalitou. Nyní je snaha o snížení hladiny FGF23 (snížením střevní absorpce fosfátů). Panuje obava, zda suplementace vitamínem D nezvyšuje i hladinu FGF23.
Terapie
- Snížení hladiny fosfátů, nutná restrikce fosfátů v dietě (sušenky, koláče, sladkosti, mléčné výrobky, ořechy, luštěniny, sušené výrobky, např. polévky, zmrzliny, majonézy, maso nebo vnitřnosti) a užití vazačů fosfátů (sevelamer). Vyvarovat se fosfátovým antacidům obsahujících aluminium.
- Suplementace kalcia (1 – 2 gramy/den) a kalcitriolu (0,25 – 1 µg/den).
Cílem terapie je normalizace sérového kalcia (prevence osteomalacie a těžkého sekundárního hyperparatyreoidismu nebo dokonce přechodu v terciární hyperparatyreoidismus, doporučuje se udržení hladiny PTH mezi 100 – 300 ng/l) a sérové hladiny fosfátů. Je nutné se vyvarovat přílišnému snížení hladiny PTH jako prevence adynamické kostní nemoci. U těchto pacientů by mělo být kontrolován sérový PTH pouze metodami 2. nebo 3. generace k prevenci změření falešně vysokých hodnot PTH.
2. Terapie antikonvulsivy – hypokalcémie vzniká zvýšením konverze vitamínu D na inaktivní metabolity a vznikem rezistence k jeho účinku.
3. Deficit vitamínu D při nedostatečném dietním příjmu nebo nedostatečné expozici Slunci – neadekvátní příjem vitamínu D nebo nedostatečná expozice Slunci se vyskytuje zejména u lidí v severních nadmořských šířkách a ve starším věku (až u 25 % starších pacientů). Laboratorně lze prokázat sníženou hladinu 25(OH)D, dochází k sekundárnímu hyperparatyreoidismu, hypokalcémie proto nebývá tak závažná, jako hypofosfátémie. Při kostní biopsii lze nalézt osteomalácii. Léčbou je subsituce kalciem a vitamínem D.
4. Vitamín D dependentní rachitis typu I – AR dědičná porucha 25(OH)D 1α hydroxylázy působí skutečný nedostatek vitamínu D. Na rozdíl od typu II je méně závažná a po substituci 1,25(OH)2D3 je reverzibilní. Projevuje se hypokalcémií (tetanie nebo křeče), hypofosfátémií, sekundárním hyperparatyreoidismem a osteomalácií (deformity skeletu). Laboratorně elevace ALP a nedostatek 1,25(OH)2D3, jehož podání je léčebné.
5. Vitamín D dependentní rachitis typu II – vzniká mutací genu receptoru pro vitamín D s následnou rezistencí periferních tkání ke kalcitriolu. Klinický obraz je podobný typu I + částečná nebo úplná alopecie. Laboratorně lze nalézt elevaci 1,25(OH)2D3. Terapie je obtížná, jsou nutné kontinuální (často i noční) infuze kalcia.
6. Ostatní příčiny – snížená hladina 25(OH)D může být při hepatocelulárních chorobách (např. cirhóza) nebo malabsorpci při různých chorobách střev.
b) Pseudohypoparatyreoidismus (PHP)
Definice – pacienti s PHP mají hypokalcémii se současnými změnami na skeletu, ale zároveň vysokou hladinou PTH s rozvojem hyperplazie příštítných tělísek. Porucha je způsobena defektní odpovědí buněk proximálních renálních tubulů na PTH.
Etiologie – příčinou PHP-Ia, PHP-Ib a PPHP jsou mnohočetné defekty na GNAS lokusu (chromozóm 20q13.3, kóduje α podjednotku G-proteinu a řadu dalších produktů) se vznikem poruch ve střihových junkcích a snížením produkce mRNA, bodovými mutacemi, inzercemi a/nebo delecemi, které vedou přímo k defektní funkci nebo pouze snížení aktivity Gsα.
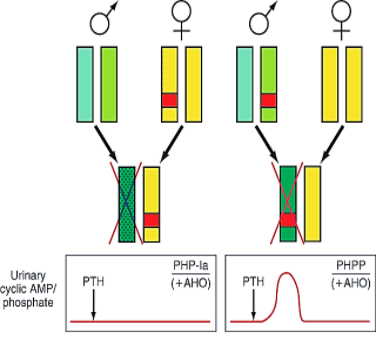
Vpravo – jestliže je gen obdržen od mužského nosiče, není přítomna žádná biochemická anomálie, podání PTH způsobuje adekvátní nárůst močového cAMP a exkrece fosfátů, tzv. pseudo-PHP.
Obě formy choroby vedou k Albrightovy renální osteodystrofii, pravděpodobně při deficienci haplotypu (pro normální vývoj kosti musí být v pořádku obě kopie pro G
sα).
Klasifikace – založena na:
- přítomnosti inefektivity PTH (snížené kalcium, zvýšené fosfáty, hladina PTH)
- odpovědi močové cAMP na exogenní PTH (měření podjednotky Gsα adenylát cyklázy)
- přítomnosti Albrightovy hereditární osteodystrofie
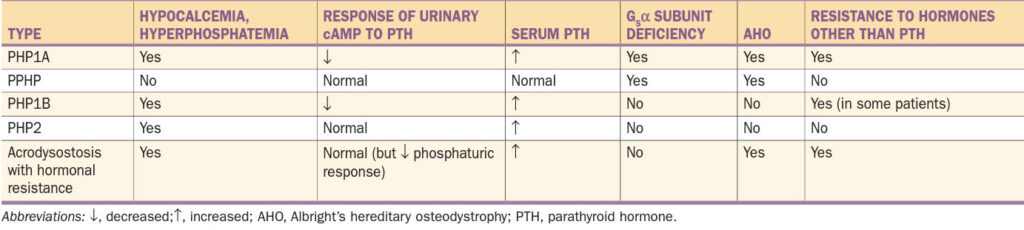
Pseudohypoparatyreoidismus typu I
1. Podtyp Ia – nejčastější forma PHP, kterou mohou přenášet pouze ženy, nikoliv muži. Jinak řečeno, PHP-Ia a PPHP nemohou existovat v jedné generaci. V případě transkripce Gsα musí být (k plné manifestaci choroby s postižením proximálního tubulu) defektní alela přenesena pouze od matky, nikoliv od otce. Proto je u PHP-Ia (mimo hypokalcémie, hyperfosfátémie a rezistence k PTH) i často přítomna rezistence k jiným hormonům signalizujících přes G protein. Imprinting je selektivní pouze pro některé tkáně. Jelikož je podjednotka Gsα důležitá při embryonálním vývoji, dochází při jejím defektu k Albrightově hereditární osteodystrofii. Laboratorně je přítomen deficit močového cAMP po podání exogenního PTH a snížené množství podjednotky Gsα adenylát cyklázy v lehce dostupných buňkách (erytrocyty, lymfocyty a fibroblasty)…tedy všechny markery jsou pozitivní.
Albrightova hereditární osteodystrofie – jedinci jsou malého vzrůstu s kulatým obličejem. Mají zkrácené metakarpy, metatarzy a falangy při předčasném uzávěru růstových štěrbin (typicky kratší IV. a V. metakarp a metatarz …Archibaldovo znamení), většinou bilaterálně, časté jsou exostózy a zahnuté radiální kosti. Běžné jsou heterotopické kalcifikace, amorfní depozita kalcia a fosfátů, zejména v bazálních gangliích (50 % pacientů). Byly i popsány postižení čichových a chuťových funkcí.

2. Podtyp Ib – způsoben mikrodelecemi uvnitř GNAS genu nebo před ním, které jsou spojeny se ztrátou metylace DNA na jednom nebo více lokusů mateřské alely, což vede k rezistenci vůči PTH v proximálním tubulu ledvin. V ostatních tkáních není exprese Gsα postižena a množství podjednotky Gsα adenylát cyklázy je normální. Není přítomna Albrightova hereditární osteodystrofie…postižena pouze oblast ledvin (tedy hypokalcémie a deficit močového cAMP po podání exogenního PTH, ve ostatní je v normě).
3. Pseudohypoparatyreoidismus typu II – defekt je distálně od genu pro cAMP. Projevuje se hypokalcémií a hyperfosfatémií. Charakteristická je normální hladina cAMP v moči, ale porušená fosfáturickou odpověď na PTH. Zatím není jasné, proč je rezistence k PTH u některých lidí s PHP II. typu léčitelná vitamínem D.
4. Pseudopseudohypoparathyreoidismus – vzniká při přenosu defektního genu od otce a je fenotypově zrcadlovým obrazem PHP Ib. Je přítomna Albrightova hereditární osteodystrofie a je postižena exprese Gsα v ostatních tkáních, jinak je vše ostatní v normě.
Diagnostika PHP – diagnóza je jasná při rodinném výskytu Albrightovy hereditární osteodystrofie a hypokalcémie. Odlišnosti:
- 1. Fenotypové abnormality – Albrightova hereditární osteodystrofie přítomny u PHP-Ia a PPHP
- 2. Laboratorní testy – hypokalcémie, hypofosfátémie u všech forem mimo PPHP
- PTH zvýšený u PHP-Ia, PHP-Ib a PHP-II
- odpověď močového cAMP na PTH – snížení u PHP-Ia a PHP-Ib
CAVE Před stanovením diagnózy PHP-II musí být vyloučen deficit vitamínu D.
Terapie PHP – podobná hypoparatyreoidismu, ale potřebné dávky kalcia a vitamínu D jsou obvykle nižší.
c) Hypokalcémie při nadbytku PTH
Vyskytuje se v případech, kdy je ztráta kalcia z exracelulární tekutiny tak markantní, že ani zvýšená produkce PTH toto nemůže kompenzovat. Může vznikat velice rychle.
1. Akutní pankreatitida – u nekrotických forem akutní pankreatitidy, hypokalcémie znamená horší prognózu.
2. Akutní těžká hyperfosfatémie – výrazné poškození tkání (rhabdomyolýza, crush syndrom, tumor lysis syndrom a zejména hematologické malignity), kdy dochází k uvolnění fosfátů z tkáně v kombinaci s možným renálním poškozením a následnou neschopností vyloučení nadbytečného fosforu. Vzniklá hyperfosfatémie vede k lehké nebo středně závažně hypokalcémii. Po reparaci tkáně, zlepšení funkce ledvin a normalizaci hladiny fosforu se hladina kalcia také normalizuje. Při těžké hyperfosfatémii dochází k masivním depozitům kalcia do svalů, po reparaci může dojít k přesmyku do lehké hyperkalcémie, protože se kalcium ze svalů částečně uvolňuje. Dalšími příčinami hyperfosfatémie jsou hypotermie a masivní jaterní selhání. Hladina kalcitriolu může být během epizody hyperfosfatémie snížená s úpravou po normalizaci hladiny fosforu. Léčba spočívá ve snížení fosfátémie podáním vazačů fosfátů (sevelamer) nebo dialýzou a suplementaci kalcia při těžké, symptomatické hypokalcémii. CAVE Podávání kalcia při hyperfosfatémických stavech zhoršuje ukládání depozi kalcia do tkání a jejich poškození.
3. Osteitis fibrosa po paratyreoidektomii – vzácná komplikace hyperparatyreoidismu léčeném chirurgicky. Na rentgenu se projevuje obrazem „pepře a soli„, při těžkém průběhu až vznik hnědých cyst. Léčí se podáním kalcia a a kalcitriolu, často s nutností podávání až do zhojení kostních defektů.
Diferenciální diagnostika hypokalcémie
- 1. Anamnéza a fyzikální vyšetření
- Vznik poruchy
- – v adolescenci – hypoparatyreoidismus a pseudohypoparatyreoidismus
- – v dospělosti – nutriční deficit, renální selhání, deficit vitamínu D při střevních poruchách, hypoparatyreoidismus po výkonech na krku
- Známky vrozené poruchy – pseudohypoparatyreoidismus
- Známky rachitidy – nedostatek nebo inefektivita vitamínu D
- Nutriční zvyklosti – snížený příjem kalcia nebo vitamínu D
- Alkoholismus – deficit magnézia
- Anamnéza epilepsie – možnost léčby antikonvulzivy
- Vznik poruchy
- 2. Laboratorní vyšetření – stanovení hladiny:
- vápníku, fosforu, hořčíku a albuminu
- PTH
- při snížení PTH bývá příčinou primární hypoparatyreoidismus (poškození nebo ageneze příštítných tělísek), těžká hypomagnézémie
- při zvýšení PTH je nejčastější příčinou nedostatek 1,25-OH vitamínu D z nejrůznějších příčin. Při nutričním deficitu vitamínu D je snížená i hladina 25-OH vitamínu D, která odráží celkové zásoby vitamínu D v organismu.
- vitamínu D
- 25(OH)D – nízká – nedostatek vitamínu D (nedostatečná expozice UV záření, snížený příjmu nebo střevní malabsorpci)
- 1,25(OH)2D – snížená – chronická renální insuficience
- odpověď močového cAMP na podání exogenního PTH
- Hypokalcémie + hyperfosfatémie (při absenci renálního selhání nebo masivní destrukce tkáně) = téměř vždy hypoparatyreoidismu nebo pseudohypoparatyreoidismu.
- Hypokalcémie + hypofosfatémií = nedostatek nebo inefektivita vitamínu D
Terapie hypokalcémie – při hypoparatyreoidismu, pseudohypoparatyreoidismu, chronickém renálním selhání a vrozeném deficitu vitamínu D je vhodná substituce kalcia a vitamínu D.
- Kalcium – v dávce 2 – 3 gramy/den p.o. (při hypoparatyreoidismu)
- Vitamínu D
- profylakticky – (např. u starších pacientů) vhodnější podávat vitamín D než jeho metabolity pro jeho nižší účinek a vyšší bezpečnost
- léčebně – vhodnější kalcitriol, protože má kratší poločas, rychlejší účinek a je bezpečnější než vitamín D, který je nutno podávat ve vysokých terapeutických dávkách. K prevenci rachitidy je potřeba 1000 U (2 – 3 μg, více u starších osob) vitamínu D denně nebo 0,25 – 1 μg kalcitriolu denně. Naopak u hypoparatyreodismu je potřeba podat 40000 – 120000 U (1 – 3 mg) vitamínu D denně, zatímco kalcitriolu je potřeba podat stále stejné množství (defekt je ve funkci 25(OH)D-1α-hydroxylázy).
- Thiazidová diuretikum – mohou stabilizovat situaci u velmi fragilní hypokalcémie, která se střídá s epizodami hyperkalcémie.