Hlavní funkce imunitního systému – imunitní systém patří k základním homeostatickým mechanismům, které brání organismus proti vnějším i vnitřním noxám. Má dva základní funkční okruhy:
- obranyschopnost, kdy brání proti vnějším (mikroorganismy) i vnitřním škodlivinám (likvidace starých, poškozených a mutovaných, tedy i nádorových buněk).
- autotolerance, kdy umožňuje existenci složek organismu vlastních.
Imunitní systém má dvě hlavní složky:
I. Vrozený (nespecifický) imunitní systém
Předem připravené (vrozené) mechanismy reagující na určité nespecifické podněty a struktury, které jsou společné mnoha různým patogenům (PAMP, pathogen-associated molecular patterns, molekulární struktury, které exprimují různé velké skupiny mikroorganismů) a jsou vázané např. povrchovými receptory granulocytů a monocytů (CD14) nebo Toll-like receptory monocytů, makrofágů a dentritických buněk (zatím objeveno 10 typů s různými ligandy), které tyto buňky aktivují a propojují tak nespecifický a specifický imunitní systém (zejména u TLR4 vede jeho aktivace lipopolysacharidovými komponenty buněčné stěny G- bakterií k uvolnění velkého množství cytokinů a šoku). Po rozeznání PAMP dochází ke komplexnímu ději (aktivace komplementu, produkce cytokinů a efektorových molekul) a zároveň i aktivace dendritických buněk, které poté prezentují antigen buňkám specifického imunitního systému.
Mimo nespecifické složky imunitního systému sem lze zařadit i obranné mechanismy fyzikální (pohyb řasinek, kožní bariéra), chemické (pH žaludeční tekutiny) a mikrobiální (komenzálové tlustého střeva).
Mezi složky vrozeného imunitního systému patří:
- receptory (TLR, Nod-like receptor, které po aktivaci tvoří velké cytoplazmatické komplexy, inflamazomy apod.)
- antimikrobiální peptidy (defensiny apod.)
- buňky (makrofágy, dendritické buňky, NK buňky, neutrofily, eozinofily, bazofily, mastocyty apod.)
- komplement
- cytokiny
1. Buňky nespecifického imunitního systému
Monocyty a makrofágy (norma 0,3 – 0,5 · 109/l) – vznikají z prekurzorů v kostní dřeni. Jejich poločas v oběhu je 1 – 3 dny, poté migrují kapilární stěnou extravaskulárně a formují se ve tkáňové makrofágy (nejvíce v lymfatických uzlinách, slezině, kostní dřeni, peritoneu, pleuře, kůži a dále speciálně pojmenované jako alveolární makrofágy, osteoklasty, Kupfferovy buňky v játrech, mikroglie centrálního nervového systému a synoviální makrofágy). Lze říci, že jde o buňky prvního kontaktu, které:
- fagocytují patogen, likvidují jej svými agresivními substancemi (oxid dusnatý, peroxid vodíku, prostaglandiny, leukotrieny, PAF) a fungují jako APC.
- pomocí cytokinů (IL-1, TNF-α, IL-6, IL-12) přitahují ostatní složky imunitního systému (neutrofily).
- na svém povrchu mají velké množství různých receptorů (např. k Fc oblasti IgG, komplementu apod.).
Při své činnosti mohou být naopak sami infikovány intracelulárními mikroorganismy). Pokud se tak stane, mohou být sami rozeznáni např. dendritickými buňkami a odsouzeny k apoptóze.
Dendritické buňky – dendritické buňky (DC) lze rozdělit na dva základní typy:
- myeloidní, které po zjištění antigenu (TLR) maturují a pomocí cytokinů přitahují ostatní buňky a prezentují tento antigen buňkám specifického imunitního systému.
- plazmacytoidní, sice nepůsobí jako APC (antigen prezentující buňky), ale jako odpověď na virovou infekci produkují množství IFN-α a aktivují NK, které buňky infikované virem zabijí.
Po aktivaci oba typy DC produkují cytokiny, které přitahují Th, Tc i B lymfocyty a neutrofily. TLR upreguluje MHC třídy II, které dále zvyšuje schopnost prezentace antigenu. DC jsou jedním z hlavních mechanismu propojení nespecifické a specifické imunity.
Natural killers (norma 0,1 – 0,6 · 109/l) – natural killers (NK) buňky vznikají v thymu i kostní dřeni. Nemají schopnost fagocytózy, ale mají na svém povrchu řadu receptorů:
- KIRs (killer cell immunoglobulin-like activating or inhibitory receptors), jejichž ligandy jsou HLA molekuly třídy I. Pokud jich má buňka dostatek inaktivuje tím NK (cílové buňky NK jich mají málo a jsou proto likvidovány, HLA I. třídy je jakýsi „identifikační průkaz“).
- Fc receptory pro IgG, které jsou odpovědné za ADCC (protilátkami zprostředkovanou buněčnou cytotoxicitu), při které dochází k vazbě Fc receptoru NK buňky na protilátkou označenou buňku (většinou maligní nebo infikovanou intracelulárním mikroorganismem) s její následnou lýzou. Hypofunkce NK buněk bývá pozorována u Chédiak – Higashiho syndromu.
- Některé NK (NK-T buňky) mají na svém povrchu CD3 a invariantní řetězce TCR-α, které při prezentaci antigenu pomocí APC rozpoznávají lipidové fragmenty intracelulárních bakterií (TBC, listerie) a poté zahajují produkci efektorových cytokinů IFN-γ (aktivace makrofágů) a IL-4 (stimulace Th-2 reakce).
Ve svém důsledku je aktivita NK regulována převahou aktivačních nebo inhibičních signálů.
Granulocyty
Participují na téměř všech druzích zánětu a vznikají z kmenových buněk kostní dřeně. Jejich zvýšená akumulace vede k destrukci okolní tkáně (např. systémové vaskulitidy).
Neutrofily (norma 3 – 6 · 109/l) – na místo zánětu jsou přitahovány chemokiny (zejména IL-8). Obsahují Fc receptor pro IgG i C3b složku komplementu. Po jejich aktivaci kontaktem s protilátkami opsonizovanými bakteriemi nebo imunokomplexy jsou uvolněna azurofilní (obsahují myeloperoxidázu, lyzozym, elastázu apod.) a specifická granula (obsahují laktoferin, lyzozym, kolagenázu apod.) a na jejich povrchu se tvoří superoxidové radikály (O2–). To vše vede k poškození tkání i samotné buňky.
Eozinofily (norma 0,05 – 0,25 · 109/l) – silné složky obrany proti mnohobuněčným parazitům, které jsou regulovány pomocí IL-5 z antigen specifických Th2 lymfocytů (specifický imunitní systém reguluje nespecifický). Obsahují granula s hlavním bazickým proteinem, eozinofilním kationickým proteinem a neurotoxinem, které mohou přímo ničit okolní tkáň (hypereozinofilní syndrom).
Bazofily (norma 0,0 – 0,1 · 109/l) – na svém povrchu mají velké množství receptorů
- pro složku komplementu C3a a C5a
- pro IgE, po jejichž aktivaci vazbou na IgE dochází k degranulaci a uvolnění substancí (histamin, eozinofilní chemotaktický faktor, neutrální proteáza) se vznikem anafylaxe.
- TLR
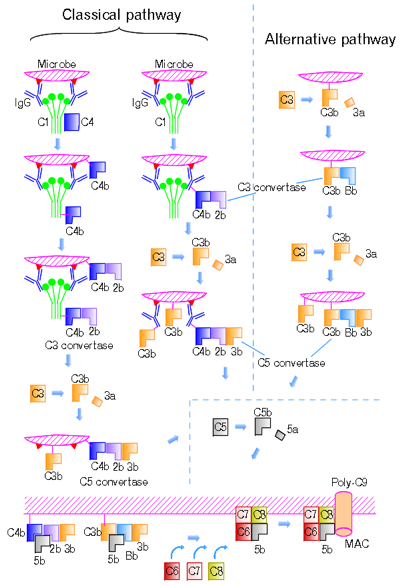
2. Komplement
Hlavními složkami komplementu je 9 sérových proteinů C1-C9). Ústřední složkou je C3. Terminální produkt (C5b, C6, C7, C8, C9) se označuje jako MAC (membrane attack complex). Hlavní funkce komplementu:
- opsonizace (C3b)
- chemotaxe (C3a, C5a)
- osmotická lýza (MAC)
Tři cesty aktivace:
Alternativní cesta
- C3 se s nízkou frekvencí samovolně štěpí na C3a + C3b.
- V C3b se odhalí velmi reaktivní thioesterová skupina, která je v C3 skryta a rychle reaguje s vodou a inaktivuje se. V případě, že se předtím zachytí na povrchu nějaké částice (např. mikrob), kovalentně se zde naváže a zůstává aktivní.
- Následně se k ní připojí faktor B, který je štěpen faktorem D na Ba a Bb. Vzniklý komplex C3bBb je stabilizován faktorem P. C3bBb působí jako tzv. alternativní C3 konvertáza, tj. enzym, který štěpí dále C3 na C3a a C3b (mnohonásobná amplifikace reakce).
- Z některých molekul C3 konvertázy vzniká ještě další komplex C3bBbC3b, tzv. alternativní C5 konvertáza, která štěpí C5 na C5a a C5b.
- Vznikem C5b je zahájena terminální lytická fáze aktivace komplementu.
Klasická cesta
- Na protilátce navázané na mikrobiální povrch se odhalí vazebné místo pro protein C1.
- C1 po vazbě na protilátku pozmění svůj tvar, začne mít proteolytickou aktivitu a štěpí proteiny C2 a C4.
- Jejich fragmenty C2a a C4b se naváží na povrch napadeného mikroorganismu a tvoří klasickou C3 konvertázu(C4bC2a), která štěpí C3 na C3a a C3b (mnohonásobná amplifikace reakce).
- Následně se vazbou C3b vytvoří klasická C5 konvertáza (C4bC3bC2a), která štěpí C5 na C5a a C5b.
- Vznikem C5b je zahájena terminální lytická fáze aktivace komplementu.
Lektinová cesta
Podobná klasické cestě, ale místo protilátky je iniciována sérovým lektinem MBL (lektin vážící manózu), který se váže na některé mikrobiální povrchy přímo (bez přítomnosti protilátek) a působí jako C1.
Terminální lytická fáze
Fragmenty C5b tvoří s C6, C7, C8 komplex, ke kterému se do kruhu připojí 13 – 18 molekul C9 se vznikem póru v membráně a osmotické lýzi buňky.
Regulace komplementu
- C1 inhibitor – inhibuje C1 klasické cesty
- CD55 (DAF) – inhibuje C3 konvertázu
- Faktor I – inhibuje C3b
- Faktor H – soutěží s faktorem Bb a tím snižuje tvorbu alternativní C5 konvertázy a dále je kofaktorem faktoru I
- CD59 – váže se mezi C8 a C9, brání polymeraci C9 a inhibuje vznik MAC
3. Cytokiny
Základní regulátory imunitního systému, které jsou secernovány leukocyty a jinými buňkami, které působí prostřednictvím specifických receptorů na různé buňky imunitního systému i mimo něj). Ve snaze o jednotnou klasifikaci se začaly označovat jako interleukiny a číslovány podle pořadí, ve kterém byla jejich struktura poznána, u některých byl ponechán tradiční název (např. interferony, TGF, CSF). Toto vedlo k zavedení obecnějšího termínu cytokiny. Klasifikace:
- interleukiny – IL-1 – 35 (heterogenní skupina látek ovlivňující leukocyty)
- chemokiny – IL-8 a ostatní látky s chemotaktickou aktivitou
- interferony – IFN-α, -β, -γ (důležité složky neadaptivní ch antivirových mechanismů)
Kompletní seznam viz: https://cs.wikipedia.org/wiki/Cytokin
II. Adaptivní (specifický) imunitní systém
Podstatou specifického imunitního systému je, že pokud se organismus jednou setká s antigenem, je tento antigen uložen do jeho „imunologické paměti“ a opakovaný kontakt vede k výrazně rychlejší imunitní reakci. Hlavními složkami specifického imunitního systému jsou B lymfocyty, které vznikají a dozrávají v kostní dření a T lymfocyty, které sice vznikají v kostní dření, ale následně k maturaci migrují do thymu. Normální celková hladina lymfocytů v periferní krvi je 1,5 – 3,0 · 109/l.
1. T lymfocyty
Norma – muži 0,6 – 2,0 · 109/l, ženy 0,8 – 2,2 · 109. T lymfocyty vznikají v kostní dřeni a v thymu maturují. Jejich pool vzniká záhy po narození a je obnovován jednak novou produkcí, jednak klonální expanzí naivních T lymfocytů do paměťových buněk, které poté setrvávají v periferních lymfatických orgánech:
- zralé T lymfocyty dělají cca 75 % všech lymfocytů periferní krve (CAVE krevní pool je pouze 2 % celkového poolu).
- v lymfatických uzlinách se nacházejí zejména parakortikálně (B lymfocyty v germinálních centrech).
- ve slezině periarteriálně v bílé hmotě
Nejčasnějšími identifikovatelnými prekurzory T-buněk jsou CD34+ pro-T buňky v kostní dřeni (zatím bez TCR). Po migraci do thymu začíná syntéza složek CD3 komplexu. Poté dochází k diferenciaci do dvou subtypů:
- TCR-αβ – většina T lymfocytů v krvi, lymfatických uzlinách a a slezině, které se dále diferencují do CD4+ a CD8+ lymfocytů
- TCR-γδ – cirkulují v malém množství v krvi a pravděpodobně hrají roli v obraně proti intracelulární infekci. Na rozdíl od předchozích, které jsou schopny rozeznávat pouze aminokyselinové sekvence, může jejich TCR rozeznávat i lipidy původem např. mykobakterií (např. TBC).
CAVE Antigeny bakteriálních lipidů nejsou rozeznávány pomoci TCR, ale spíše pomocí molekul CD1 molekul T lymfocytů-γδ.
Jako nezralé kortikální T lymfocyty dochází k expresi povrchového TCR. Na základě toho zde i dochází jejich první selekci. Ty buňky, které mají ideální afinitu k vlastním MHC antigenům jsou pozitivně selektovány, ty s afinitou příliš vysokou (budoucí zdroj autoimunitní choroby) nebo příliš nízkou (budoucí zdroj imunodeficitu) jsou určeny k apoptóze. Následně dozrávají do CD4+ a CD8+ buněk, které migrují do dřeně thymu, kde interagují s vlastními MHC peptidy a mohou procházet další selekcí.
T lymfocyty lze podle povrchových antigenů rozdělit na:
- CD4+ (norma – 0,5 – 1,35 · 109/l) – obecně jsou primárními regulátory T i B lymfocytů a monocytů a hrají důležitou roli v indukci izotypového přesmyku. Jejich vlastností je, že rozeznávají antigeny pouze na molekulách MHC třídy II.
- CD8+ (norma – 0,3 – 1,0 · 109/l)- rozeznávají antigeny pouze na molekulách MHC třídy I. Jsou prekurzory cytotoxických Tc lymfocytů.
- Imunoregulační index (poměr CD4+ a CD8+) je nomrálně 0,8 – 3,3.
Aktivací T lymfocytů se spouští ještě diferenciace T buněk do paměťových, které mají subtypy:
- periferní efektorové – sídlí v nelymfatických tkáních a na opakovanou infekci rychle reagují produkcí cytokinů s následnou likvidací infikované buňky
- centrální paměťové – nachází se v lymfatických orgánech, kde při potřebě doplňují T buňky
Molekulární podstata funkce T lymfocytů
TCR je složen z:
- modulu rozeznávajícího antigen ze dvou transmembránových řetězců α a β (u menší části T lymfocytů z γ a δ)
- CD3 komplexu, který je složen z řetězců γ, δ, ε, ζ a η a jejichž intracelulární části jsou asociovány s protein kinázami Src
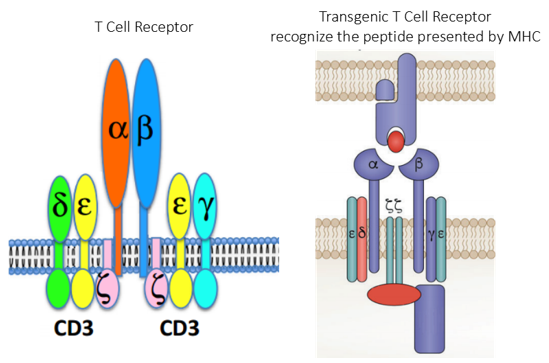
Při rozpoznávání antigenu spolupracují s TCR tzv. koreceptory CD4 (pomáhají vázat komplexy obsahující MHC gp II. třídy) a CD8 (pomáhají vázat komplexy obsahující MHC gp I. třídy).
Řetězce řetězců α, β, γ a δ jsou strukturálně velmi podobné imunoglobulinům, což jim zajišťuje možnost velké variability. α řetezec je kódován na chromozómu 14 a jeho gen je složen z řady sekvencí V (variable), J (joining) a C (constant). β řetězec je kódován na chromozómu 7 a je složen z mnoha sekvencí V, J, C a navíc i D (diversity). Rozmanitost TCR je dána možností mnoha kombinací V, D, J segmentů. I při maturaci T lymfocytů v thymu dochází k pozitivní a negativní selekci s likvidací autoreaktivních klonů. T lymfocyty neumí rozeznávat celé sekvence proteinů nebo polysacharidy, místo toho jsou schopny identifikovat pouze krátké aminokyselinové sekvence, které jsou jim předloženy APC. Tato prezentace se děje dvěma způsoby:
- exogenní cesta – antigen je fagocytován, poté intracytoplazmaticky rozštěpen, jeho fragment je navázán na MHC II a následně vystaven na povrchu APC, kde je rozeznáván CD4+ T lymfocyty.
- endogenní cesta – intracelulárně vzniklý antigen (typicky virus) je štěpen na malé peptidy pomocí komplexu proteáz (proteazom). Tyto fragmenty jsou pomocí TAP (transporters associated with antigen processing) transportovány do lumen endoplazmatického retikula, kde jsou spojeny s molekulami MHC I, poté do Golgiho aparátu a na povrch buňky, kde jsou rozeznány CD8+ T lymfocyty.
Při vazbě T lymfocytu na MHC dochází na jeho povrchu k expresi řady molekul (např. ZAP-70, který se používá jako prognostický marker u chronické lymfoidní leukémie), po jejich aktivaci se spouští řady signálních drah a zvyšuje se aktivita proteinkináz (src (fyn a Lck), ZAP-70, Syk, dále downregulace kalicenurinové a ras cesty i aktivita proteinkinázy C).
K aktivaci T lymfocytů je potřeba i tzv. kostimulační signál, spojení CD28 na T lymfocytu spolu s CD80 nebo CD86 na dendritické buňce. Pouze současná vazba MHC a TCR spolu s kostimulačním signálem může plně aktivovat T lymfocyt.

Existují ale i tzv. superantigeny (typicky bakteriální toxiny u stafylokokového syndromu toxického šoku), které aktivují nespecificky celou řadu T lymfocytu a to bez nutnosti zapojení APC. Konvenční antigen aktivuje < 1 z 10 tisíc přítomných T lymfocytů, zatímco superantigen je jich schopen aktivovat 20 %. Toto vede k uvolnění extrémního množství cytokinů se vznikem hypotenze a šoku.
2. B lymfocyty
Norma v krvi 0,13 – 0,33 · 109/l. Zralé B lymfocyty vznikají v kostní dřeni a dělají:
- 10 – 15 % lymfocytů periferní krve
- 25 % lymfocytů lymfatických uzlin
- 50 % lymfocytů sleziny
- 10 % lymfocytů kostní dřeně
B lymfocyty mohou také sloužit jako APC a na svém povrchu exprimují řadu receptorů:
- BCR – povrchový receptor B lymfocytů je intramembránový imunoglobulin, který má podobnou signální funkci jako TCR. Na rozdíl od TCR, je BCR schopen rozpoznání nativního antigenu, tedy bez nutnosti účasti APC.
- Fc receptor pro IgG
- receptor pro aktivovanou složku komplementu C3b nebo produkt jejího štěpení C3d

Vývoj B lymfocytů lze rozdělit na dvě fáze. Nezávislá na přítomnosti antigenu probíhá v primárních lymfatických tkáních a závislá na přítomnosti antigenu v sekundárních lymfatických tkáních (slezina, lymfatické uzliny, Peyerské plaky apod.).
Nejčasnější fáze prekurzorů (časné pro-B buňky) ještě neobsahují Ig, velké pre-B lymfocyty mají hojně přítomný pre-BCR (složené z těžkého řetězce μ a pre-B lehkého řetězce V pre-B). Tyto prekurzory jsou dále stimulovány k maturaci pomocí cytokinů kostní dřeně (zejména IL-7). Ve stádiu malých pre-B lymfocytů dochází k přeuspořádání lehkých řetězců s expresí již zralého BCR a povrchového IgM. U zralých B lymfocytů je mimo povrchový IgM přítomen i povrchový IgG. v tomto okamžiku je vývoj v B buněk kostní dření ukončen, ty ji opouští a migrují do sekundárních lymfatických orgánů (např. lymfatické uzliny a slezina), aby se zde setkaly se svým antigenem (jeho vazbou na BCR) a zahájily zde somatickou hypermutaci, kdy pomocí bodových mutací v genech pro těžké a lehké řetězce vznikají dceřiné B lymfocyty s povrchovým Ig, který afinitu k antigenu s nižší nebo vyšší než povrchový Ig původního B lymfocytu. Podstatou je přeuspořádání jednotlivých segmentů genu, nejdříve pro těžké řetězce (D segmenty s J segmenty, poté V segmenty s nově vzniklými D-J sekvencemi, se kterými se poté spojí C segment za vzniku V-D-J-C), později vznikají i lehké řetězce díky přeuspořádáním V na J segmenty). Díky tomu vzniká B lymfocyt s protilátkou jedinečně specifickou proti určitému antigenu.
Aby tyto dceřiné buňky přežily, musí obdržet dostatečně silné signály prostřednictvím BCR a cytokinů. Aby se tak stalo, BCR musí vázat antigen s dostatečnou afinitou (všechny méně produktivní mutanty hynou). Tento selekční tlak stále stoupá, protože množství dostupného antigenu klesá. Intenzivní proliferace doprovázená masivním úhynem odpovídá mikroskopicky tvorbě sekundárního lymfatického folikulu. Zralé B lymfocyty se poté diferencují v plazmatickou buňku, a produkují protilátky IgG, IgA, IgE. K tomu je potřeba i tzv. kostimulačního signálu (vazba CD40L ligandu Th2 lymfocytů na CD40 B lymfocytů). Zároveň v zárodečných centrech periferních lymfatických orgánů probíhá i tzv. izotypový přesmyk (záměna konstantní části produkovaných protilátek, kdy místo IgM vzniká IgA, IgE, IgG). To jaké izotypy vznikají, závisí na přítomném cytokinovém prostředí (IL4 → IgG + IgE, TGF-β, IL10 → IgA, IFN-γ → IgG2b, IgG3).
3. Imunoglobuliny
Jsou produkovány plazmocyty a slouží jako humorální část specifické imunity. Jejich hlavní funkcí je vazba na antigen a následně:
- neutralizace antigenu (blokáda aktivity toxinů, virů a jiných mikroorganismů)
- opsonizace antigenem označené struktury (vazbou protilátky na mikroorganismus je umožněno jeho pohlcení fagocyty, nebo napadení poškozené buňky NK lymfocyty)
- aktivace komplementu (protilátky mohou aktivovat komplement klasickou cestou, mimo IgG4 a IgA)
- indukce apoptózy poškozené buňky
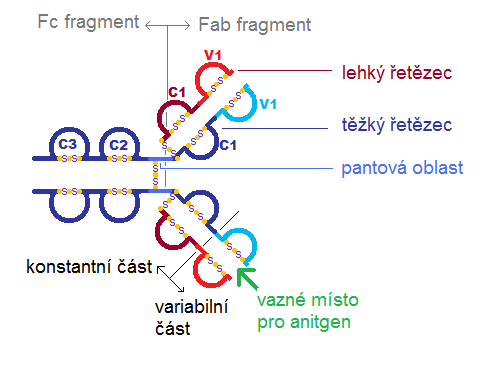
Imunoglobuliny jsou složeny z dvou těžkých (H) řetězců, spojenými disulfidickými (cystinovými) můstky, ke každému z nich jsou cystinovými můstky připojeny lehké (L) řetězce:
- Těžké řetězce – μ, δ, γ (čtyři subtypy), α, ε (ze 4 nebo 5 domén)
- Lehké řetězce – κ, λ (ze dvou domén)
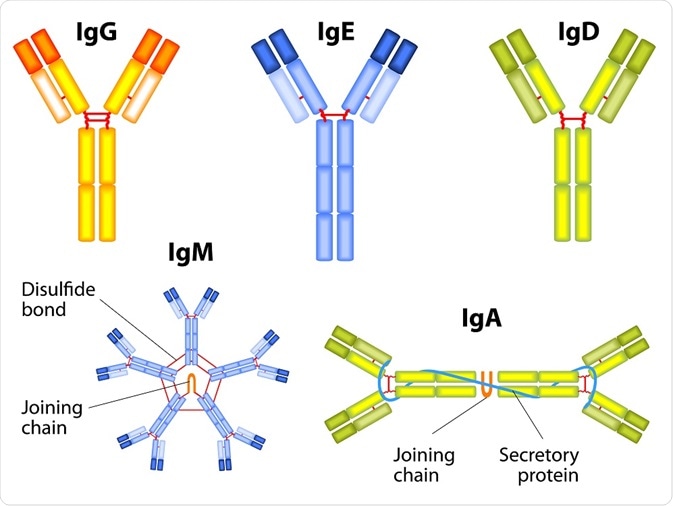
Domény na N konci těžkého i lehkého řetězce jsou variabilní (VH, VL), které se výžou na antigen a právě díky své variabilitě zajišťují obrovskou rozmanitost protilátek. Ostatní domény jsou konstantní (CH, CL) a zajišťují biologickou funkci protilátky. Domény jsou číslovány od N konce k C konci. Použitím enzymu papainu lze získat dva identické fragmenty Fab a fragment Fc. Molekuly některých tříd imunoglobulinů (IgM, IgA) jsou složeny z několika základních jednotek (L2H2) a jsou spojeny řetězcem J.
Třídy imunoglobulinů – jednotlivé řetězce L (κ i λ) jsou si velice podobné a jednotlivé třídy imunoglobulinů jsou dány typem H řetězce:
IgM – složen z μ2L2 ve formě penta, někdy hexameru. Má plazmatický poločas 5 dnů. Jde o první izotyp protilátek, který se tvoří po setkání s antigenem. Dobře váže komplementový protein C1, neváže Fc receptor.
IgG – lze rozlišit čtyři subtypy IgG1-4, γ1-4L2 (IgG1 je nejhojnější). Má plazmatický poločas 21 dnů. Jeho funkce:
- vazba na Fc receptory fagocytů – nejlépe IgG1, IgG3 → hůře IgG4 → nejhůř IgG2
- aktivace komplementu – nejlépe IgG1, IgG3 → hůře IgG2 → neaktivuje IgG4
IgA – složen z α2L2, má plazmatický poločas 6 dnů. Neaktivuje komplement, váže se na Fc receptor fagocytů. Lze rozlišit dvě formy:
- slizniční – dimer spojený J řetězcem
- sérová – monomer, dimer nebo trimer
IgE – složen z ε2L2, má plazmatický poločas 2 dny. Uplatňuje se zejména v obranných reakcích proti mnohobuněčným parazitům. Váže se na povrchové receptory mastocytů a bazofilů s indukcí jejich degranulace.
IgD – monomer, složen z δ2L2, je spolu s IgM markerem zralých naivních B lymfocytů.
Buněčná interakce v regulaci normální imunitní odpovědi
CD4+ lymfocyty se dělí na několik subtypů:
Th1 – mají zásadní úlohu v likvidaci patogenů přežívajících v makrofázích, které je fagocytovaly díky jejich aktivaci:
- Makrofág „vystaví“ fragmenty mikroorganismu na svém povrchu navázané na MHC II + produkuje IL12 (diferenciační faktor Th1).
- Zde je rozeznává Th prekurzor pomocí svého TCR (MHC II – TCR).
- Upevnění kontaktu pomocí adhezinů (ICAM-1) na povrchu makrofágů a receptoru LFA-1 na povrchu T lymfocytu (ICAM-1 – LFA-1).
- Kostimulační signál CD86 na povrchu makrofágů – CD28 na povrchu Th prekurzorů (CD86 – CD28).
- Diferenciace v efektorovou Th1 buňku, která na postižené makrofágy secernuje IFN-γ, čímž je aktivuje a produkuje IL-2 jako autokrinní růstový faktor, čímž amplifikuje svůj růst a produkci
Th2 – mají zásadní úlohu v regulaci produkce protilátek a izotypového přesmyku. Interagují s B lymfocyty, které byly aktivovány antigenem a následně se množí.
- K diferenciaci Th prekurzoru ve zralou Th2 je třeba interakce prekurzorové buňky s APC za splnění několika podmínek:
- antigen je prezentovaný na MHC gp II a interaguje s TCR (MHC gp II – TCR).
- dochází k upevnění kontaktu pomocí adhezinů (ICAM-1 – LFA-1).
- přítomen kostimulační signál CD86 a CD 80 makrofágů – CD28 Th prekurzorů (CD86, CD80 – CD28).
- přítomen IL4
- Diferenciace v efektorovou Th2 buňku, která stimuluje k dělení B lymfocyty:
- produkcí IL4, IL5, IL6.
- mezibuněčným kontaktem CD40L (ligand Th2) a CD40 receptorem B lymfocytů.
Mutace CD40L působí neschopnost izotypového přesmyku, což vede k nedostatku paměťových B buněk a vzniku imunodeficitu s názvem X-vázaný hyper-IgM syndrom.
Th17 – produkují IL-17, mohou aktivovat NK buňky, zajišťují pravděpodobně obranu proti bakteriím a houbám, zejména na buněčných površích a hrají roli v autoimunitních chorobách.
O tom, zda se budou prekurzorové CD+ Th buňky vyvíjet směrem k Th1 nebo Th2 rozhoduje poměr IL 12 a IL 4.
- IL-12 je produkován makrofágy a dendritickými buňkami. Začne-li proces u makrofágů, ty začnou produkovat IL-12, dochází ke stimulaci Th1 se zahájením produkce IFN-γ, které podporuje Th1 diferenciaci a inhibuje Th2.
- IL-4 je produkován bazofily a mastocyty, dochází ke stimulaci Th2 se zahájením produkce IL4 a IL10, které podporuje Th2 diferenciaci a inhibuje Th1.
Imunitní reakce založená na CD8+ cytotoxických T lymfocytech
Cytotoxické (Tc) buňky rozeznávají buňky infikované virem nebo jinak poškozené a ničí je bezprostředním, těsným kontaktem. Aktivace probíhá několika kroky:
- Prekurzory Tc musí přes svůj TCR rozeznat komplexy MHC II – antigen na APC (makrofágy, dendritické buňky) a současně mít kostimulační signál CD80, CD86 – CD28, který je k aktivaci nezbytný. Aby APC mohly Tc aktivovat, musí být samy aktivovány (exprimovat CD80, CD86, IL-1 a IL-12).
- Poté se prekurzor začíná dělit a diferencovat v klon zralých Tc buněk. Tento proces optimalizuje přítomnost IL-2 z Th1 buněk.
- Efektorové Tc jsou poté roznášeny po organismu krevním oběhem.
Existují 3 typy cytotoxických mechanismů.
- Cytotoxická granula v cytoplazmě migrují směrem k cytoplazmě a zde se degranulují. Obsahují perforiny, které tvoří v cytoplazmě póry a buňka buď hyne osmotickou lýzou nebo se těmito otvory do buňky dostávají granzymy, které aktivují apoptotickou cestu.
- FAS ligandy (FasL) na povrchu Tc, které se vážou na apoptotický receptor Fas (CD95) a indukují apoptózu.
- Produkce lymfotoxinu (dříve TNF-β), který působí stejně jako FasL apoptózu.
CD4+ a CD8+ T regulační lymfocyty – produkují IL-10 a α řetězec receptoru pro IL-2 a tlumí T i B lymfocyty. Ztráta jejich funkce vede ke vzniku autoimunitních onemocnění.
Slizniční imunita
Lymfatická tkáň spojená se sliznicí (MALT) obsahuje 80 % všech imunitních buněk. Mají za úkol ochranu sliznic proti invazivním patogenům, komenzálům, dále patogenům z jídla, vzduchu apod. a zároveň brání nadbytečné imunitní reakci proti nim. Hlavním složkou jsou membránové buňky, které jsou druhem APC, dále B lymfocyty (produkují sekreční typ IgA a IgG), T lymfocyty atd. Zásadní složkou slizniční imunity střevní flóra, bez které dochází k postižení zejména slizniční Th1 imunitní odpovědi. Nekontrolovaná MALT imunitní odpověď na potravinové antigeny může způsobit např. celiakii.
Molekulární podstata interakce lymfocyt – endotelová buňka
Všechny druhy migrace lymfocytu jsou zahájeny zachycením lymfocytu ve specifických oddílech cév, tzv. HEV (žilky s vysokým endotelem) díky aktivaci a konformační změně. Tato migrace má několik fází:
- Zachycení a rolling, kdy lymfocyt opouští hlavní proud v postkapilární žilce a „koulí“ se po stěně cévy. Toto koulení je zprostředkováno L selektiny (LECAM-1, LAM-1, CD62L) a dochází k „brždění lymfocytu“.
- Poté následuje pevná adheze na povrch endoteliální buňky za pomoci chemoatraktantů nebo cytokinů (např. IL-8, PAF, leukotrienu B4 C5a složky komplementu). Poté dochází k „zastřešení“ L-selektinů pomocí CD11b/18 nebo CD11a/18 díky jejich upregulaci. Podobným, mechanismem (souhrnně označen jako PNAd, peripheral node addressin) s expresí specifických molekul zvládnout trefit „domů“ na své místo určení např. lymfocyty Peyerských plaků.
- V další fázi se váže lymfocytární integrin CD11a/18 (LFA-1) na svůj ligand na HEV ICAM.
- První tři fáze trvají pouze několik sekund, zatímco čtvrtá fáze teansendotelilární migrace trvá cca 10 minut. Významnou roli v penetraci lymfocytů přes endotel hrají i metaloproteinázy, které jsou schopny trávit bazální membrábu bohatou na nefibrilární kolagen.
CAVE Tento mechanismus hraje experimentálně roli např. ve vývoji diabetes mellitus I. typu a blokáda L selektinů a integrinů vede u experimentálních zvířat ke blokádě vývoje diabetes mellitus I. typu.

Základní typy imunopatologických reakcí
Adaptivní imunita je za fyziologických podmínek významným faktorem obrany proti infekci, může ale vést k poškození vlastních tkání (hypersenzitivní reakce). V roce 1968 byly Coombsem a Gellem rozděleny do čtyř kategorií:
I. Reakce časné přecitlivosti
Při prvním setkání s antigenem dochází k senzibilizaci pacienta, kdy se diferencují Th2 lymfocyty s tvorbou IL-4 a sekrecí IgE, které se navážou na vysokoafinní IgE receptory mastocytů a bazofilů. Při opakovaném setkání s antigenem se přemostí IgE molekuly a uvolnění granul, které obsahují tři typy substancí:
- Zvyšující permeabilitu cévní stěny a kontrakci hladkého svalstva (např. histamin, PAF apod.).
- Chemotakticky přetahující ostatní zánětlivé buňky (např. leukotrien B4).
- Modulující zánětlivou odpověď (např. PAF).
II. Reakce cytotoxická
Protilátky IgG1,2,3 a IgM mají schopnost aktivovat komplement nebo reakci typu ADCC (na protilátkách závislá buněčná cytotoxicita přes NK buňky). Protilátky svým Fc koncem aktivují NK-buňky a fagocyty, které poškozují cílové buňky označené příslušnou protilátkou (ABO a Rh inkompatibilita, autoimunitní cytopenie, bazální membrány glomerulů při Goodpastureově syndromu, pemphigus apod.). Možnosti:
- Aktivace komplementového systému, jehož faktory opsonizují buňky, které jsou následně fagocytovány a destruovány fagocyty, které exprimují Fc-receptory (AIHA, ATP, transfúzní reakce).
- Působení protilátek ve tkáních, na které se Fc receptory váží neutrofily a makrofágy, které se aktivují. Jejich produkty působí poškození tkání (Goodpatureův syndrom).
- ADCC (na protilátkách závislá buněčná cytotoxická reakce) zprostředkovaná NK-buňkami, které nesou receptor FcγRIII (CD16)
- Vazba protilátek na receptory buněk s jejich aktivací (Graves-Basedowova nemoc) nebo inhibicí (protilátky proti acetylcholinovým receptorům u myasthenia gravis).
III. Reakce imunokomplexová
Vysoce účinným mechanismem odstranění volných antigenů je tvorba imunokomplexů mezi antigenem, komplementem a protilátkou. V určitých situacích některé imunokomplexy antigeny mohou volně cirkulovat, a pokud nejsou vychytány buňkami retikuloendoteliálního systému, precipitují v krevních cévách (např. glomeruly), kde aktivují komplement se spuštěním kaskády poškozujících reakcí s hlavní rolí přilákaných neutrofilů a akcesorní rolí mastocytů. Dochází tak ke vzniku vaskulitidy (např. glomerulonefritidy).
Deficit raných složek komplementu bývá častý u imunokomplexových vaskulitid, deficit pozdních složek komplementu bývá spojen s recidivujícími neissseriovými infekce.
IV. Reakce pozdní přecitlivělosti
Dělí se na 2 podtypy:
1. Buněčná imunopatologická reakce (tuberkulinový typ)
Jde o typickou Th1 reakci, která je za normálních podmínek namířena proti intracelulárním parazitům, histoplazmóze, mykobakteriím, chlamydiím, helmintům, jako reakce na toxiny a organické prachy. Následkem bývá vznik granulomů.
Intradermálně vpravený antigen podporuje růst Th1 lymfocytů. Po opakovaném intradermální expozici antigenu do místa vpichu nejdříve migrují Th1 lymfocyty (proto prodleva vzniku kožní reakce 48-72 hodin od doby podání) a makrofágy s následným vznikem tvrdého otoku s hlavními změnami v koriu. Při dlouhotrvající stimulaci se makrofágy mohou měnit na mnohojaderná syncytia, takzvané obrovské buňky. Recentně se prokázal i významný vliv NK buněk.
2. Buněčná cytotoxická reakce (ekzémový, epidermální, kontaktní typ)
Reakce podobná tuberkulinovému typu, ale Th1 buňky při ní aktivují CD8+ T lymfocyty s následnou lýzou buněk.
Hlavní histokompatibilní komplex
Gen pro MHC se nachází na chromozómu č. 6. MHC glykoproteiny I. třídy jsou přítomny na všech buňkách, II. třídy pouze na APC. Lidské MHC se označují jako HLA. Typy:
Klasické izotypy MHC gp I (HLA-A, -B, -C)
Transmembránový řetězec α (tři domény) a s ním asociovaný β2 mikroglobulin. Vážou peptidové fragmenty proteinů produkovaných buňkou a vystavují je na svém povrchu tak, aby byly snadno rozpoznatelné TCR receptory T lymfocytů. Vazebná místa na MHC gp I jsou na obou koncích uzavřená a váží pouze peptidy o délce 8 – 10 aminokyselin.
Neklasické izotypy MHC gp I (HLA-E, -F, -G)
- HLA-E se vyskytuje na mnoha typech buněk, váže signální N-terminální peptidy pocházející z biosyntetických perkurzorů HLA-A, -B, -C, -G.
- HLA-F je exprimován na na proliferujících lymfoidních i monocytárních buňkách.
- HLA-G se nachází pouze na povrchu trofoblastu.
HLA-E a -G jsou rozeznávány specifickými inhibičními receptory NK buněk.
CD1 váží na namísto peptidů mikrobiální (CD1a, b, c, poté rozeznávány αβ T lymfocyty) popř. organismu vlastní glykolipidy (hlavně CD1d, poté rozeznávány NK-T buňkami).
MHC gp II (HLA-DR, -DQ, -DP)
Dvě transmembránové podjednotky α a dvě β. Váží peptidové fragmenty proteinů pohlcených buňkou a vystavují je na svém povrchu tak, aby byly snadno rozpoznatelné T lymfocyty. Vazebná místa na MHC gp I jsou otevřená a mohou vázat i peptidy o délce 15 – 35 aminokyselin, které na obou koncích přečnívají.

Role subtypu HLA v pravděpodobnosti vzniku choroby
Některé haplotypy HLA molekul jsou spojeny s vyšším rizikem některých autoimunitních chorob:
- Ankylozující spondylitida – B27
- Reaktivní artritida – B27
- Psoriatická spondylitida – B27
- Přední uveitida – B27
- Systémový lupus erythematosus – DR3
- Sjögrenův syndrom – DR3
- Revmatoidní artritida – DR4, DR1
- Juvenilní artritida – DR8
- Céliakie – DQ2
- Dermatitis herpetiformis – DR3
- Psoriáza – Cw6
- Pemfigus – DR4
- Diabetes mellitus I. typu – DR2, -DR3, -DR4, -DQ8
- Graves-Basedowova choroba -DR3
- Adrenální insuficience – DR3
- Myasthenia gravis – B8
- Sclerosis multiplex – DR2
- Goodpastureův syndrom – DR2
- Hypersenzitivita k abacaviru – B57
- Kongenitální adrenální hyperplázie – B47
Zdroje:
Základy imunologie, V. Hořejší, J. Bartůňková, Triton, 2017Harrison’s Principles of Internal Medicine, 20e, New York, NY: McGraw-