Definice – choroby, které jsou spojeny s porušenou absorpční schopností jedné nebo více látek.
Fyziologie střevní absorpce
Délka tenkého střeva je cca 3 – 5 m, v případě tlustého je to cca 80 cm. Nicméně, efektivní funkční plocha je cca 600 x vyšší než je vypočítaná plocha této trubice. Tohoto je dosaženo přítomností velkého množství řas, klků a mikroklků. Střevní epitel má několik funkcí:
- Trávení a absorpce
- Bariérová a imunitní funkce (syntéza IgA)
- Absorpce tekutin a elektrolytů – ve střevě dochází k absorpci cca 7 – 8 litrů tekutin denně (z toho 1 – 2 litru z potravy a 6 – 7 litrů endogenních tekutin, např. sliny, žaludeční šťávy, pankreatická tekutina, žluč a střevní tekutina).
- Syntéza a sekrece některých aminů (např. 5-hydroxytryptofan) a peptidy, které slouží jako parakrinní a hormonální mediátory střevní funkce.
Tenké a tlusté střevo se odlišuje anatomicky (klky jsou přítomny v tenkém střevě, v tlustém střevě chybí) i funkčně (v tenkém střevě dochází k trávení a absorpci živin, v tlustém nikoliv). Živiny, minerály a vitamíny bývají absorbovány pomocí jednoho nebo více aktivních membránových transportních mechanismů, které jsou energeticky vysoce náročné a umožňují přesun látek proti koncentračnímu gradientu nebo bez jeho přítomnosti. Absorpce aminokyselin a monosacharidů v tenkém střevě (např. glukózy) je zprostředkována sekundárně aktivním transportem, který je Na+ dependentní a probíhá díky pohybu Na+ apikální membránou. Tento Na+ gradient je udržován činností Na+, K+ ATPázy v bazolaterální membráně, která transportuje Na+ ven z buněk a udržuje tak koncentrační gradient přes apikální membránu. Výsledkem je aktivní absorpce glukózy a glukózou stimulovaná absorpce Na+, které vyžadují jak apikální membránový transportní protein SGLT1, tak bazolaterální Na+, K+ ATPázu. Glukóza navíc také stimuluje absorpci Na+ i tekutin, což je podstatou orální rehydratační terapie při léčbě průjmů.
Enterohepatický cyklus žlučových kyselin
Žlučové kyseliny nejsou přítomny v potravě, ale jsou syntetizovány během několika enzymatických kroků až v játrech. Jejich syntéza se překrývá s katabolismem cholesterolu, proto přerušení enterohepatického cyklu vede k poklesu sérové hladiny cholesterolu až o 10 % (dokud se neustaví nová rovnováha). Žlučové kyseliny jsou:
- primární – v játrech syntetizovány z cholesterolu v množství cca 500 mg a následně konjugovány s taurinem nebo glycinem. Hlavními zástupci jsou kyselina cholová a chenodeoxycholová.
- sekundární – vznikají činností bakteriálních enzymů ve střevě, hlavními zástupci jsou kyselina deoxycholová a litcholová.
Hlavní funkcí žlučových kyselin je:
- Zajištění toku žluči.
- Zkapalnění cholesterolu a fosfolipidů tvorbou smíšených micel ve žlučníku.
- Trávení a absorpce tuků (tvorbou smíšených micel) v proximální části tenkého střeva.
Žlučové kyseliny jsou primárně absorbovány aktivním Na+ dependentním transportem, lokalizovaným pouze v ileu, mimo to mohou být absorbovány v menším množství i pasivně jejunu, ileu a tlustém střevu. Konjugované žlučové kyseliny, které vstoupí do tlustého střeva, jsou rychle dehydroxylovány na sekundární žlučové kyseliny a dekonjugovány bakteriálními enzymy tlustého střeva, rychle absorbovány mechanismem neiontové difúze a poté se vrací cestou portální žíly do jater, odkud jsou opět vylučovány.

Syntéza žlučových kyselin je regulována 7α-hydroxylázou, enzymem zahajujícím degradaci cholesterolu (snížení celkového množství žlučových kyselin, které se vrací do jater ze střeva zvyšuje katabolismus cholesterolu a tak i zvýšení syntézy žlučových kyselin, což pomáhá k udržení relativní konstantní velikosti celkového poolu žlučových kyselin). Možnost zvýšení syntézy je omezená a dosahuje pouze 2 – 2,5 násobek oproti „běžnému stavu“. Poté jsou vylučovány do žluče a mezi jídly a v noci jsou poolovány ve žlučníku. Přítomnost potravy v duodenu indukuje uvolnění cholecystokininu, který stimuluje žlučník ke kontrakcím, čímž se žluč dostává do duodena. Žlučové kyseliny jsou primárně absorbovány cestou Na+ dependentního transportéru, který se nachází výhradně v ileu. Jen malé množství žlučových kyselin (cca 500 mg denně) se ztrácí stolicí a je nahrazeno jejich jaterní syntézou. Celkové množství žlučových kyselin v těle se odhaduje na cca 4 g a během 24 hodinové periody podstoupí enterohepatální cyklus celkem 6 – 8 x. Defekt v jakékoliv fázi enterohepatálního cyklu může vést ke snížení koncentrace konjugovaných žlučových kyselin v duodenu s následnou steatoreou. Jinými slovy, steatoreu může způsobit porucha syntézy žlučových kyselin v játrech, omezení jejich vylučování a porucha funkce nebo reabsorpce ve střevě:
- Porušená syntéza (např. jaterní cirhóza) – při běžné cirhóze není steatorea běžná, na druhou stranu při primární biliární cirhóze je téměř vždy přítomna, protože je navíc přítomen i defekt kanalikulární exkrece organických iontů.
- Snížení konjugované frakce (např. při syndromu bakteriálního přerůstání).
- Snížení možnosti reabsorpce při poškození distálního ilea (st.p. resekci, Crohnova choroba), kdy někdy pomůže terapie cholestyraminem.
Trávení lipidů
Průměrný Američan přijme potravou cca 120 – 150 g tuků denně a jejich absorpce je přímo úměrná právě jejich příjmu. Určité množství je uvolněno žlučí do duodena a celkové množství lipidů, které dorazí do ilea je tak ještě větší. Porucha trávení lipidů se nejčastěji projevuje steatoreou (světlá, mazlavá, zapáchající stolice). S ohledem na stupeň steatorey a dietní příjem lipidů může docházet k váhovému úbytku, průjmu, který dobře reaguje na omezení tuků v dietě a deficienci vitamínů rozpustných v tucích, které je nutné substituovat. Tuky se skládají ze 3 typů mastných kyselin:
- Mastné kyseliny s dlouhým řetězcem (LCFAs, long-chain fatty acids)
- Mastné kyseliny se středním řetězcem (MCFAs, medium-chain fatty acids)
- Mastné kyseliny s krátkyým řetězcem (SCFAs, short-chain fatty acids)
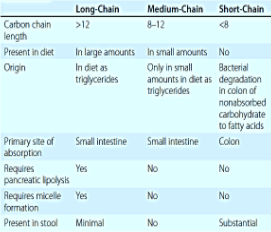
I. Trávení LFCA (14C a více) – tuk z potravy je složen téměř výhradně z triacylglycerolů (TAG) složených z LFCA, tedy glycerol + 3 LFCA, nejčastěji o délce 16C (palmitová) nebo 18C (stearová). Trávení má tři fáze:
- 1. Intraluminární – dvě podfáze:
- lipolýza – základem je dobré rozmělnění potravy (v dutině ústní žvýkáním, v žaludku kontrakcemi). V dutině ústní, žaludku a duodenu (vlivem pankreatické sekrece) působí lipáza. Kofaktorem pankreatické lipázy je kolipáza (usnadňuje se průnik lipázy k TAG). K defektu této fáze trávení dochází při chronické pankreatitidě nebo cystické fibróze (k zachování dostatečné lipolýzy bývá většinou potřeba pouze 5 % normálkní sekrece pankreatické lipázy – steatorea je tedy projevem pokročilé choroby).
- tvorba micel – nad plazmatickou membránou enterocytu se nachází hydrofilní vrstva, kterou musí lipofilní TAG prostoupit. Dochází tak ke tvorbě smíšených micel, které jsou rozpustné ve vodě (vznikají, když koncentrace konjugovaných žlučových kyselin v tenkém střevu překročí kritickou hranici pro tvorbu micel). K poruše této fáze trávení dochází buď při poklesu koncentrace žlučových kyselin ve střevě nebo zvětšení tloušťky hydrofilní vrstvy, např. při syndromu bakteriálního přerůstání).
- 2. Slizniční – transportní proteiny přenáší mastné LCFA, které se poté reesterifikují za vzniku TAG. K porušení této fáze dochází např. při celiakii nebo resekci tenkého střeva, což má opět za následek steatoreu.
- 3. Postabsorpční – vznikají chylomykrony, které jsou složeny z beta-lipoproteinů a obsahují estery cholesterolu, fosfolipidy a následně vstupují do lymfatických cest (nikoliv portální krve) a odtud do systémové krve.

II. Trávení MCFA (8 – 12C) – jsou přítomny bohatě v kokosovém oleji. Ke svému trávení nevyžadují přítomnost pankreatické lipázy a tak mohou být TAG s MCFA resorbovány bez jakékoliv změny. Naopak, pokud je pankreatická lipáza v dostatečné koncentraci, tak není potřeba tvorba micel. Jinými slovy, k vstřebání MCTs je nutná přítomnost buď pankreatické lipázy, nebo micel, ne ale obojího. Po vstřebání vstupují do portální krve a vážou se na albumin.
III. Trávení SCFA (< 8C) – SCFAs nejsou součástí potravy, ale jsou produkovány v tlustém střevě bakteriálními enzymy degradací nevstřebatelných sacharidů. Hlavními zástupci ve stolici jsou kyselina octová (2C), propionová (3C) a butanová (4C, hlavní nutriční látkou epitelových buněk tlustého střeva – její nedostatek bývá spojen některými druhy kolitid). Jejich hlavní výhodou je získání energie i ze sacharidů nevstřebatelných v tenkém střevě.
IV. Ostatní lipidy – fosfolipidy se štěpí pankreatickou fosfolipázou a fosfodiesterázou a vstřebávaji do portální krve. Estery cholesterolu se štěpí pankreatickou fosfolipázou a stávají se součástí micel vlivem mastných kyselin a fosfolipidů. Cholesterol se pak vstřebá pasivní difuzí.
Trávení sacharidů
Sacharidy jsou v potravě přítomny ve formě škrobů, disacharidů (sacharózy a laktózy) a glukózy. Jsou absorbovány pouze v tenkém střevě ve formě monosacharidů, na které musí být škrob a disacharidy rozštěpeny pomocí pankreatické amylázy a disacharidáz kartáčového lemu enterocytů před svou absorpcí . Tyto enzymy štěpí disacharidy na monosacharidy, které už mohou být vstřebány pomocí Na+ dependentního transportéru SGLT1 enterocytů a to nejvíce ve střední části jejuna.
Trávení proteinů
Proteiny v potravě jsou přítomny téměř výhradně ve formě polypeptidů a před svou absorpcí vyžadují hydrolýzu na aminokyseliny a di- až tripeptidy. K proteolýze dochází v žaludku i tenkém střevě:
- 1. Hlavní buňky žaludku produkují pepsinogen, který se v přítomnosti pH < 5 aktivuje na pepsin.
- 2. Buňky pankreatických acinů dále syntetizují trypsinogen, který je na trypsin aktivován enterokinázou (enzymem kartáčového lemu enterocytů) a následně i samotným trypsinem.
- 3. Pankreatické proteázy
- 4. Peptidázy kartáčového lemu enterocytů
Vstřebávají se pasivní difúzí až na výjimky, které užívají aktivní transport (prolin, hydroxyprolin, neutrální a bazické aminokyseliny).
Voda a ionty
Vstřebávají se nejvíce v jejunu, Na+ a Cl- na základě aktivního transportu, K+ pasivně, HCO3- v jejunu a je secernován v ileu výměnou za H+ ionty. Fe se vstřebává zejména v duodenu aktivním trasnportem a to pouze ve formě Fe2+ (poté se mění na Fe3+ a tvoří komplex s feritinem).
Diagnostika
Zlatým standardem při steatoree je sběr stolice na množství tuku po dobu 72 hodin (v praxi prováděno minimálně). Při steatorey lze předpokládat deficienci vitamínů rozpustných v tucích (A, D, E, K). Dále dostupné:
- xylózový absorpční test – zhodnocení absorpce sacharidů a funkce sliznice proximální části tenkého střeva, kde je téměř výhradně vstřebávána D-xylóza. Provedení – podá se 25 g D-xylózy a následně se sbírá moč po dobu 5 hodin.
- biopsie tenkého střeva
- Schilingův test – p.o. je podán 58Co-kobalamin s následným 24 hodinovým sběrem moči (test je závislý na normální funkci ledvin i močového měchýře). Jednu hodinu po jeho podání se i.m. aplikuje 1 mg kobalaminu, aby došlo k nasycení kobalaminových receptorů v játrech. Potom již lze předpokládat, že močová exkrece kobalaminu odpovídá míře jeho absorpce ve střevě.
- sekretinový test – po intravenózním podání sekretinu a následném sběru pankreatické šťávy lze přímo stanovit produkci pankreatických enzymů. Abnormální výsledek bývá při chronické pankreatitidě.
I. Poruchy trávení v lumen střeva
Ia. Intra- a extrahepatální cholestáza
Vzniká blokádou tvorby, transportu a odtoku žluči do střeva s poruchou emulzifikace lipidů. Je nedostatečný přísun žlučových kyselin do střeva, do dalších etáží střeva se tak dostane více LCFA, pacient trpí plynatostí, meteorismu a průjmem, pokud je porucha výrazná, objevuje se steatorea se všemi důsledky (hypovitaminóza A, D, K, E, osteoporóza)
Ib. Insuficience zevní sekrece pankreatu
Dochází k nedostatečné lipolýze tuků v potravě s následnou steatoreou. K tomu, aby se porucha projevila, musí být úroveň sekrece < 5 – 10 % normy, Nejčastější příčinou je chronická pankreatitida.
Ic. Žaludeční hypersekrece a achylie
Nízké pH při vysoké produkci žaludeční kyseliny (Zollinger-Ellisonův syndrom) inaktivuje pankreatickou lipázu a výrazně zrychluje pasáž tráveniny přes tenké střevo, podobně i nepřítomnost kyselé žaludeční sekrece při atrofii žaludku nebo po totální gastrektomii může být příčinou průjmu i malabsorpce.
II. Porucha absorpce na úrovni enterocytů
IIa. Polékové poškození enterocytů
- NSAID působí přímo toxicky na střevní sliznici
- metotrexát a cyklofosfamid působí mukositidu
- olmesartan vyvolává obraz podobný celiakii
IIb. GIT infekce
Příčinou malabsorpce může být infekce Giardia lamblia, vzácně chronicky probíhající kryptosporidióza, yersionióza nebo salmonelóza.
IIc. Autoimunitní enteropatie
Velmi vzácná klinická jednotka, která byla odlišena od celiakie až v posledních letech. Dochází k totální atrofii klků a sliznice v proximální části tenkého střeva. Dochází k těžkému malabsorpčnímu syndromu, který nereaguje na bezlepkovou dietu a jsou negativní protilátky proti endomyziu, gliadinu a tkáňové transglutamináze, naopak jsou pozitivní protilátky proti enterocytům.
IId. Celiakie
Definice – chronická enteropatie způsobená autoimunitní reakcí , která vzniká u predisponovaných jedinců při konzumaci potravy obsahující gluten (pšenice, ječmen, žito).
Epidemiologie – incidence je cca 1:200 (ale až 7x více případů je nediagnostikovaných), ženy jsou 2x častěji postižený.
Etiologie – nejasná, pravděpodobně kombinace imunologických, genetických a environmentálních faktorů:
- expozice gliadinu – jediný prokazatelný faktor vnějšího prostředí (přítomen v pšenici, ječmenu a žitu). Gliadin interaguje se specifickými T-buňkami, které zprostředkují tkáňové poškození a uvolňují různé cytokiny (např. interferon γ).
- imunologické faktory – v séru nemocných jsou autoprotilátky, , které pravděpodobně nejsou přímo zodpovědné za poškození sliznice. Lze je využít ke screeningu celiakie a při pozitivitě dále indikovat duodenální biopsii. Patří mezi ně:
- IgA proti gliadinu (AGA)
- proti endomysiu (AEA, 90 – 95 % senzitivita a specificita)
- proti tkáňové transglutamináze (anti-TTG)
- genetické faktory – všichni pacienti exprimují HLA-DQ2 nebo HLA-DQ8, přesto ale jen malá část jedinců exprimujících tyto alely trpí celiakií.
Patofyziologie – enzym tkáňová transglutamináza se vyskytuje v cytoplazmě všech buněk, katalyzuje přenos zbytků glutaminu a je poměrně substrátově specifický pro donátory glutaminu, kterým je gliadin. Pokud je pacient geneticky predisponován, je gliadin v nadbytečném množství absorbován do střevní sliznice, deaminován tkáňovou glutaminázou a následně navázán na HLA II. třídy (zejména DQ-2 a DQ-8), které jsou na povrchu APC. Zde se pak rozjíždí Th-1 zánětlivá reakce s postupnou likvidací sliznice duodena zánětem s její následnou atrofií.
Klinické projevy – závisí na věku nemocného. V dětství jde o bouřlivou manifestaci zejména s poškození jejuna, v dospělosti je jejunum postiženo spíše segmentálně. V dospělosti jsou symptomy spíše diskrétní, cca 20 % dospělých je diagnostikováno až po 60. roce života, přestože někteří udávají trávící obtíže již od adolescence.
- projevy v dětství – k prvním projevům dochází po několika týdnech od přechodu na plnou stravu s expozici obilovinám (6 – 18 měsíců). Dochází k průjmům, neprospívání, nárůstu bříška a úbytku svalstva a podkožního tuku. Stolice je světlá až šedá, mastná a páchnoucí z důvodu steatorey. Může dojít k dehydrataci, minerální dysbalanci, hypoproteinémii s periferními edémy až hypovolemickým šokem (celiakální krize – tak daleko to ale v dnešní době téměř nikdy nedojde).
- projevy v dospělosti – průběh bývá obvykle oligosymptomatický (CAVE 50 % pacientů nemusí mít střevní obtíže ani průjmy). Mezi časté příznaky patří:
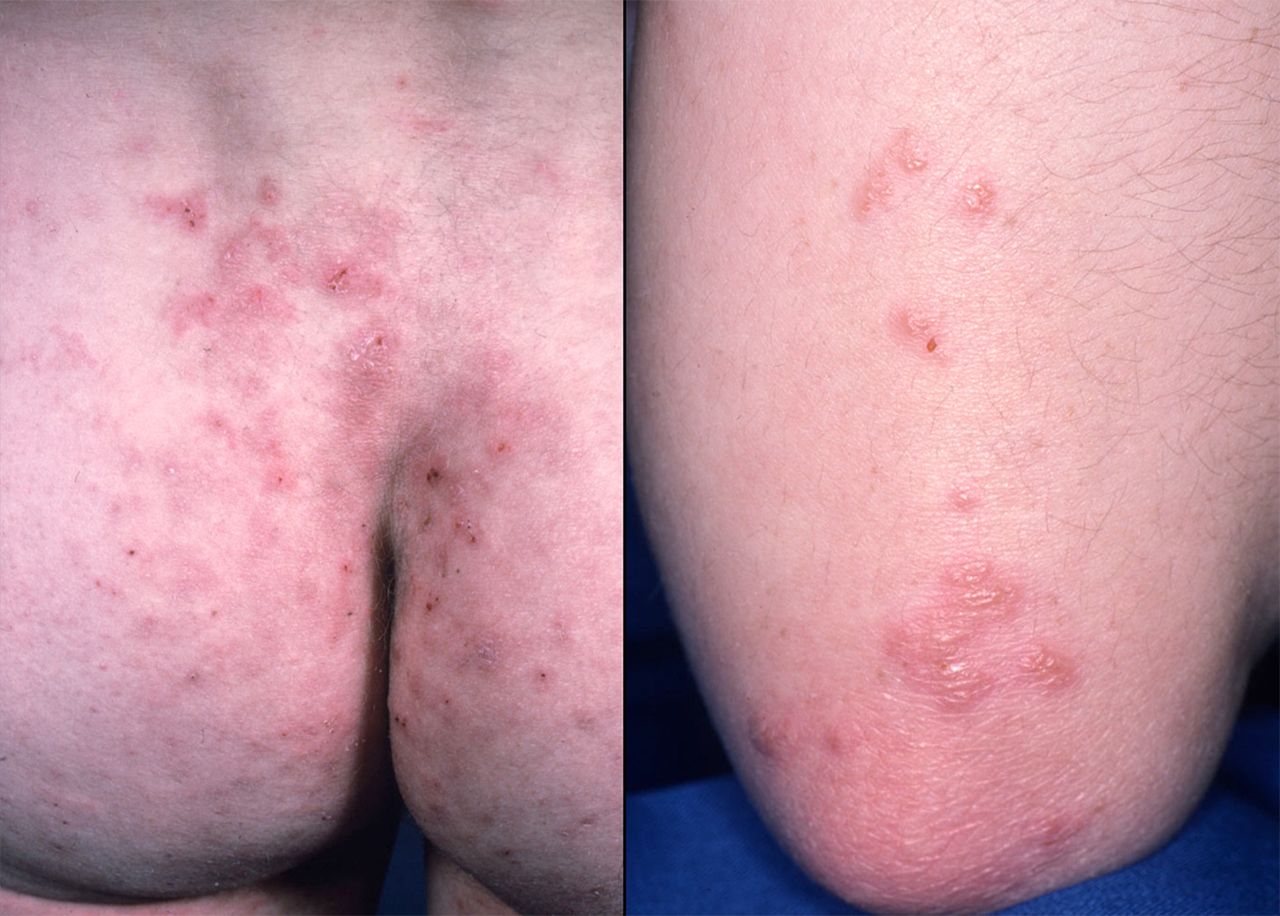
- dermatitis herpetiformis Duhring – kožní manifestace celiakie u nemocných s atrofií střevní sliznice a pozitivitou AEA a anti-TTG. Tvoří se svědící drobné puchýřky nad extenzory horních a dolních končetin (lokty, kolena, hýždě). Histologicky lze prokázat IgA depozita v kůži, základem terapie je bezlepková dieta, event. Dapson.
- anémie – častým a často jediným projevem pozdě stanovené celiakie. Většinou bývá mikrocytární při deficitu železa, makrocytární při deficitu folátů je vzácná.
- retardace růstu – při celiakii dochází ke snížení produkce růstového hormonu (předpokládá se, že u 10 % adolescentů s nízkým vzrůstem je příčinou nepoznaná celiakie).
- hepatopatie – často bývá zvýšené ALT, AST, GGT, které se normalizuje po zavedení bezlepkové diety.
- osteoporóza – u nově zjištěných pacientů s celiakií má cca 40 % osteopenii a 26 % již osteoporózu.
- asymptomatická celiakie – prokazatelné histologické změny v proximálním střevě a pozitivní autoprotilátky, ale není přítomna intestinální, ani extraintestinální symptomatologie. Při podrobnější anamnéze lze i u těchto jedinců zjistit menší fyzickou výkonnost, tendenci k depresím, někdy se sideropenií bez anémie.
CAVE 5 – 7 % jedinců s autoimunitní tyreoiditidou a 7 – 10 % jedinců s diabetes mellitus I. typu současně trpí celiakií.
Diagnostika – několik způsobů:
- 1. Autoprotilátky
- protilátky proti gliadinu (AGA)- IgA mají dobrou specificitu, IgG i senzitivitu, ale zase nízkou specificitu (bývá pozitivní např. u intolerance kravského mléka, jiných onemocnění tenkého střeva a u parazitárních infekcí).
- protilátky proti deamidovaným peptidům gliadinu – senzitivní i specifické.
- protilátky proti endomyziu (AEA) – vyšší senzitivita i specificita. Stanovují se pouze ve třídě IgA, proto jsou jedinci s IgA deficitem falešně negativní.
- protilátky proti tkáňové transglutamináze (ATTG) – levné, senzitivní i specifické.
- 2. Endoskopie – typickým endoskopickým nálezem je chybění Kerckringových řas, viditelné cévní pleteně a mouzaikový reliéf sliznice, při podezření na celiakii je vždy indikována biopsie.

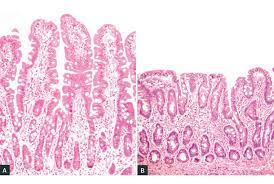
- 3. Histologie – biopsie vzorku sliznice z proximální části tenkého střeva (D2 nebo D3) je metodou volby k průkazu celiakie. Typickým nálezem je snížení výšky klků, prohloubení Lieberkühnových krypt, zvýšená lymfo-plazmocelulární infiltrace lamina propria mucosae (zejména CD8+). Průkaz monoklonálního charakteru lymfocytů a ztráta povrchových CD8+ znaků u jedinců s celiakií refrakterní na bezlepkovou dietu může ukazovat na vznik komplikujícího T-lymfomu.
- 4. Zobrazovací vyšetření – v prvotní diagnostice celiakie nejsou přínosné, mají úlohu při došetřování jejích komplikací (ulcerózní jejunitida, lymfom).
Terapie – zásadním opatřením je absolutní vynechání gliadinu v potravě (tedy pšenice, ječmen a žito, oves by neměl být toxický, ale měl by být eliminován u nově zjištěné celiakie a při dokonalé remisi může být opatrně zkoušen v dietě). V USA dle FDA nesmí být u bezlepkové potravy přítomna ani stopová množství gliadinu, v EU je dovolena koncentrace nižší než 0,02 % z celkové hmotnosti. V úvodu léčby je také vhodné vynechat mléčné a příliš tučné výrobky a vhodná je substituce železem, kyselinou listovou, kalciem a vitamínem D. K ústupu příznaků dochází po několika týdnech od zavedení bezlepkové diety.
Refrakterní celiakie – definována jako celiakie s nelepšícími se projevy po > 6 měsících bezlepkové diety. Patří sem 3 typy pacientů:
- vědomě nebo nevědomky dále konzumují gluten (nejčastěji).
- s refrakterní celiakií I. typu, která nereaguje na bezlepkovou dietu, ale dochází k remisi po glukokortikoidech nebo jiné imunosupresi.
- s refrakterní celiakií I. typu, která vede k T-lymfomu.
T-lymfom tenkého střeva – agresivní nádor, který s objevuje u pacientů, kteří mají dlouhý čas neodhalenou celiakii. Monoklonální proliferace vedoucí ke vzniku ulcerací a stenóz. Postihuje často muže > 60 let života a jeho první manifestací může být spontánní ruptura střeva. Vzniku lymfomu často předchází ulcerózní jejunitida, která je komplikací pokročilé celiakie.
IIe. Whippleova choroba
Vzácné onemocnění s incidencí 1: 1 – 2 miliónům, které nejčastěji postihuje bílé muže středního věku. Je způsobena aktinomycetou Tropheryma whipplei. Typicky se projevuje subfebriliemi se zvýšením CRP, generalizovanou lymfadenopatií, váhovým úbytkem, chronickými průjmy, bolestí břicha, malabsorpcí s hypalbuminémií a migrující artralgií velkých kloubů. Dalším typickým projevem je demence a dále infekční endokarditida a serozitida s výpotky.

Podezření by mělo vzniknout u pacientů se séronegativní revmatoidní artritidou (neodpovídající na imunosupresivní terapii), generalizovanou lymfadenopatií, horečkami neznámého původu, chronickou serozitidou a demencí s časným nástupem.
Při gastrofibroskopii lze prokázat atrofickou sliznici tenkého střeva s prominujícími bělavými ploškami s hemoragiemi. Histologické vyšetření pak prokáže nakupení PAS‑pozitivních makrofágů s definitivním potvrzením pomocí PCR. Indikován je i odběr mozkomíšního moku.

Léčbou volby je ceftriaxon 2 g i.v. 1x denně následovaný Biseptolem 960 mg p.o. 2x denně po dobu jednoho roku.
IIf. Abetalipoproteinémie
Geneticky podmíněný defekt syntézy beta-lipoproteinů s porušenou syntézou chylomikronů v enterocytech i uviolnění do lymfatik. Tím dochází ke kumulaci lipidů ve sliznici tenkého střeva s rozvojem malabsorpce, hubnutí a steatorey, děti bývají mentálně opožděné a na periferii je nápadná akantocytóza erytrocytů. Při elektroforéze lipoproteinů typicky chybí beta komponenta a histologicky lze prokázat kumulaci lipidů v enterocytech.


III. Porucha absorpce na úrovni za enterocyty
IIIa. Lymfangiektázie tenkého střeva
V praxi nejčastěji při obstrukci mezenteriálních uzlin zánětem (Crohnova choroba, TBC) nebo nádorem, vzácná je genetická příčina lymfangiektázií (často v kombinaci s Ménétrierovou chorobou. Projevují s hypoproteinémií s otoky při ztrátách velkého množství lymfy bohaté na bílkovin z dilatovaných lymfatik do lumen střeva. Diagnózu dá biospie sliznice tenkého střeva s nálezem extrémně dilatovaných lymfatických cest. Jediným opatřením je symptomatická terapie a striktní dieta s podáváním TAG s MCFA.

IIIb. Amyloidóza
Nejčastěji sekundárně při akumulaci amyloidu ve střevě. Základním vyšetřením je biopsie s průkazem amyloidů. Prognóza bývá velice špatná s přežitím v řádu měsíců.
IIIc. T-lymfom tenkého střeva
EATL (enteropathy associated T cells lymphoma) může napodobovat příznaky celiakie (…a bývá komplikací refrakterní celiakie typu II). Tumor nejčastěji postihuje muže okolo 60 let, je agresivní a mimo malabsorpci se může projevit spontánní rupturou tenkého střeva. Diagnostika je založena na biopsii tenkého střeva s průkazem infiltrace monoklonálními lymfocyty.
IIId. TBC střeva
V dnešní době vzácná, ale lze se s ní setkat, zejména u pacientů s imunosupresí. Postihuje typicky terminální ileum, kde může imitovat Crohnovu chorobu.
IV. Komplexní příčiny malabsorpce
IVa. Syndrom bakteriálního přerůstání
Stav, při kterém dochází k masivní kontaminaci obsahu tenkého střeva koliformními bakteriemi (cut off hodnota je > 100 tisíc / ml střevního obsahu). Vzniká nejčastěji při stenóze střeva, při vytvořené slepé kličky k bypassu neprůchodné části střeva, vzácněji při poruše motility (diabetická neuropatie) nebo CIVD. Dochází k poruše intraluminární fáze trávení a poškození enterocytů se vznikem steatorey, průjmu a střevní dyspepsie. Diagnóza je potvrzena aspirací střevního obsahu s kvantifikací bakterií v něm (signifikantní je > 100 tisíc/ml), neinvazivně lze diagnostikovat pomocí dechového testu (nevstřebatelný sacharid, např. xylóza, je označen radioaktivním uhlíkem 13C, který je degradován koliformní florou v tenkém střevě a při pozitivitě je zvýšeně vylučován ve formě 13CO2).
IVb. Syndrom krátkého střeva
Porucha se vyskytuje při ztrátě > 100 cm střeva (většinou z důvodu akutní mezenteriální ischémie). Délka střeva 90 – 100 cm je hraniční k zachování dostatečné nutrice, což závisí na řadě faktorů:
- ztráta ilea je závažnější než ztráta jejuna
- zda je zachováno tlusté střevo
- zda je zachována Bauhinská chlopeň (při jejím zachování může k dosatečné resorpci dostačovat i 50 cm tenkého střeva – brání kontaminaci tenkého střeva střevními bakteriemi).
Příčinami malabsorpce jsou:
- redukce resorpční plochy
- bakteriální kontaminace tenkého střeva
- zrychlená pasáž střevem
- nadprodukce kyselé žaludeční šťávy při adaptační hypergastrinémii
Syndrom krátkého střeva se projevuje hubnutím, steatoreou, obtížně ovlivnitelnými průjmy a jsou závislí na parenterální výživě.
IVc. Endokrinní a metabolické nemoci
K malabsorpci může vést hypertyreóza, hypokortikalismus, gastrinom a karcinoid.
V. Selektivní malabsorpce
Va. Laktózová intolerance
Vrozený nebo získaný (po střevních infekcích, zánětu nebo jiném poškození kartáčového lemu enterocytů) deficit disacharidázy laktázy (štěpí laktózu na glukózu + galaktózu). Při jejím nedostatku se nerozštěpená laktóza dostává do tlustého střeva, kde je střevními bakteriemi degradována na laktát, metan a oxid uhličitý. Dochází k nadýmání, plynatosti, bolesti břicha a osmotickým průjmům (lze od sekrečních odlišit stanovením osmolárního gap stolice), které jsou imperativní a kysele páchnoucí.
Osmolární gap stolice = 290 mOsm/kg − 2 × (Na ve stolici + K ve stolici), > 100 mOsm/l = osmotický průjem, protože ve stolici se nenachází žádné ionty, < 50 mOsm/l = sekreční průjem, protože ve stolici jsou ionty.
Diagnóza může být stanovena anamnézou, dechovými testy s 13C uhlíkem, stanovení glykemické křivky po glukóze a laktóze event. biopsie sliznice jejuna a histochemické stanovení aktivity laktázy. Dieta spočívá v eliminaci laktózy (čerstvé mléko) z diety, naopak kysané mléko obtíže nepůsobí. Intenzita obtíží závisí na hloubce deficitu laktózy (při úplném deficitu může i stopové množství laktózy způsobit velké obtíže).
Vb. Malabsorpce žlučových kyselin
Porucha většinou vzniká sekundárně při poškození nebo ztrátě distálního ilea (resekce střeva, Crohnova choroba), kde je v apikální membráně enterocytu transportér žlučových kyselin a sodíku. Při jejich resorpci se v enterocytech syntetizuje FGF19, který negativní zpětnou vazbou inhibuje novotvorbu žlučových kyselin v hepatocytech. Malabsorpce žlučových kyselin je obvykle dělena do třech skupin:
- 1. Idiopatická porucha transportního mechanismu.
- 2. Stavy po resekci nebo poškození distálního ilea při Crohnově chorobě.
- 3. Stavy po cholecystektomii, event. chronická pankreatitida nebo diabetes mellitus.
Patofyziologicky se nevstřebané žlučové kyseliny dostávají do distálního ilea, kde indukují mohutné peristaltické vlny se následnou sekrecí vody a hlenu. Projevuje se to vznikem mohutných průjmů v období časně po najezení. Stolice je řídká, zpěněná a většinou žluté barvy. K diagnostice pomůže informace o resekci distálního ilea popř. Crohnově chorobě ve spojení s postprandiálními průjmy. Léčbou je dieta a podávání cholestyraminu, při dlouhodobějším trvání vzniká pigmentová cholecystolitiáza a hyperoxalurie s oxalátovou urolitiázou.
Vc. Malabsorpce vitamínu B12
Vitamín B12 se aktivním transportem vstřebává z distálního ilea. Jeho nedostatek se projevuje vznikem megaloblastové anémie a neurologickými projevy. Nejčastější příčinou je ztráta distálního ilea po resekci pro Crohnovu chorobu nebo syndrom bakteriálního přerůstání (přemnožené bakterie spotřebovávají vitamín B12), raritně může být příčinou infekce tasemnicí nebo vrozená porucha transportních mechanismů, z extraintestinálních příčin je nejčastější příčinou atrofická gastritida s nedostatečnou sekrecí vnitřního faktoru. Léčbou je parenterální podání vitamínu B12.
Diferenciální diagnostika malabsorpcí
(…převzato učebnice Interna od prof. Čéšky). Použít lze několik běžných laboratorních odběrů. Jejich interpretace je ukázána na příkladu čtyřech nejběžnějších malabsorpcí (celiakie – porucha na úrovni enterocytu, pankreatická insuficience – porucha intraluminární fáze, syndrom bakteriálního přerůstání jako komplexní porucha, střevní lymfangiektázie s protein loosing enteropatií jako post enterocytární porucha).
- Steatorea – velmi těžká steatorea bývá u plně vyjádřené pankreatické insuficience (absolutní nedostatek pankreatické lipázy).
- Feritin – u celiakie je vždy snížený (poškození střevní sliznice v místě, kde dochází k největší resorpci železa).
- Vitamín B12 – výrazně snížen u syndromu bakteriálního přerůstání s předčasnou konzumpcí vitamínu B12 přemnoženou střevní flórou (dříve než se vitamín B12 dostane do místa své maximální resorpce v distálním ileu).
- Foláty – snížené u pacientů s celiakií.
- Albumin – je snížený u pacientů s plně vyjádřenou celiakií (hladina 25 – 30 g/l) a velmi výrazně snížená u pacientů s protein-loosing enteropatií (hladina 15 – 25 g/l).
- Anémie – viz předchozí, u celiakie je výhradně mikrocytární a hypochromní, u syndromu bakteriálního přerůstání je makrocytární.
- Protrombinový čas – nepřímý ukazatel resorpce vitamínu K. Mírně prodloužen u většiny uvedených případů.
Ostatní choroby tenkého střeva
- Meckelův divertikl – zbytek omfal-enterické dučeje, který se vyskytuje u 2 % zdravé populace. Při jeho ústí mohou být ektopická ložiska žaludeční nebo pankreatické tkáně. Manifestuje se komplikacemi, zejména krvácením nebo perforací s obrazem náhlé příhody břišní. Je prokazatelný pomocí CT/MR enterografie. U symptomatických divertiklů je indikována chirurgická léčba.
- Nádory tenkého střeva – velmi vzácné, spíše ve starším věku.
- Adenokarcinom (45 % nádorů tenkého střeva) – rizikovým faktorem je déletrvající celiakie, Crohnova choroba, vrozené polypózní syndromy nebo Lynchův syndrom. Klinicky se projevuje recidivujícím krvácením nebo subileózním stavem. Diagnóza je založená na histologickém vyšetření získaném z biopsie nebo laparotomie. Dlouhodobá prognóza není příznivá pro většinou pozdní diagnostiku (5 leté přežití 20 – 35 %).
- Karcinoid střeva (30 % nádorů tenkého střeva) – v této lokalizaci je téměř vždy maligní, často v oblasti ilea. Klinicky se nejčastěji projevuje nespecifickou bolestí břicha a hubnutím, dále obstrukčními symptomy a křečemi břicha. Při postižení jater metastázami je častý karcinoidový syndrom (viz. pneumologie), ale celkově je přítomen pouze u cca 10 % pacientů s karcinoidem. Ke stanovení diagnózy je vždy potřeba provést CT/MR enterografii, při suspektním nálezu by měla následovat biopsie endoskopicky nebo laparoskopicky. K stagingu choroby je vhodné PET CT nebo octreoscan (vazba radioaktivně značených protilátek na somatostatinové receptory, které karcinoidové buňky exprimují). Laboratorní stanovení chromograninu A a odpady 5-hydroxyindoloctové kyseliny mají význam spíše ke sledování choroby k detekci časné recidivy. Léčba je chirurgická, u generalizovaného onemocnění s karcinoidovým syndromem je vhodné podávání analog somatostatinu spolu s chemoterapií.
- Lymfom střeva (15 % nádorů tenkého střeva) – většina lymfomů patří mezi MALTomy, nejčastěji v distální části tenkého střeva, kde se nachází Peyerské plaky. Většinou jde o obrovskobuněčné B-lymfomy z marginálních vrstvy germinálních center lymfocytárních folikulů. T-buněčné lymfomy jsou spojené s dlouhotrvající celiakií (zejména refrakterní celiakie II. typu). Klinický nález je dán lokální expanzí nádoru (křeče, průjmy, krvácení) a celkovými příznaky (hubnutí, teploty). Diagnóza je založena na histologickém průkazu lymfomu. Terapie odpovídá typu lymfomu v jiné lokalizaci, při chirurgických komplikacích je indikována operace.
- Gastrointestinální stromální nádory (GIST, 10 % nádorů tenkého střeva).