Definice – jaterní cirhóza je histopatologicky definována jako stav, kdy fibrotizace jater (jsou za ni odpovědny hvězdicovité buňky) vede k architektonické dezorganizaci a redukci funkčního jaterního parenchymu s tvorbou cirhotických uzlů. Redukován je i krevní průtok přes játra. Jde o stav, který je částečně reverzibilní, pouze ale v případě, kdy pomine inzult vedoucí k jaterní cirhóze (nejlepší příklad je dosažení SVR u hepatitidy C). Ke gradingu a stagingu je ve většině případů indikována jaterní biopsie. Při vzniku ascitu, jaterní encefalopatie nebo krvácení z varixů je stav označován jako dekompenzace jaterní cirhózy a v případě neúspěšnosti kontroly by měla být zvážena transplantace jater.

Klasifikace dle závažnosti – lze použít:
1. Klasifikace Child – Pugh – používá se k hodnocení prognózy pacientů (on-line zde: https://www.mdcalc.com/calc/340/child-pugh-score-cirrhosis-mortality).

2. MELD skóre (Model for End-Stage Liver Disease) – skore užívané k odhadu mortality a indikaci k transplantaci jater (on-line zde: https://www.mdcalc.com/calc/78/meld-score-model-end-stage-liver-disease-12-older).
Etiologie – viz tabulka
| Alkoholismus | |
| Nealkoholická steatohepatitida | |
| Kardiální cirhóza | |
| Chronická virová hepatitidy | chronická hepatitida B |
| chronická hepatitida C | |
| Autoimunitní hepatitidy | |
| Biliární cirhózy | primární biliární cirhóza |
| primární sklerozující cholangitida | |
| autoimunitní cholangiopatie | |
| Metabolické hepatopatie | hemochromatóza |
| Wilsonova choroba | |
| deficit α1 antitrypsinu | |
| cystická fibróza | |
| Idiopatické cirhózy |
Alkoholická cirhóza
Samotná konzumace alkoholu působí sekvenci steatóza → steatohepatitida → cirhóza a navíc zhoršuje průběh jiných hepatopatií (chronická hepatitida C, hemochromatóza, nealkoholická steatóza).
Chronický etylismus vede k jaterní fibrogenezi i bez přítomnosti zánětu nebo nekrózy. Fibróza může být centrilobulární, pericelulární nebo periportální. Při dosažení určitého stupně fibrózy se již stává jaterní architektonika desorganizovaná a jaterní buňky jsou nahrazovány regeneračními uzly. V případě alkoholické cirhózy jde o mikronodulární typ (uzly ˂ 3 mm). Při úspěšné abstinenci se tvoří i větší uzly (˃ 3 mm) a cirhóza bývá smíšeně mikro- i makronodulární.
Epidemiologie – cca 90 % dospělých osob konzumuje každoročně alkohol, u 70 % všech obyvatel z konzumace alkoholu již plyne nějaké zdravotní riziko, 20 % mužů / 5 % žen pije každý týden, alkohol může za 6 % všech úmrtí.
Patogeneze – k absorpci etanolu dochází zejména v tenkém střevě, v menší míře i žaludku (zde žaludeční alkohol dehydrogenáza začíná jeho metabolismus). V játrech je alkohol metabolizován třemi enzymovými systémy:
- 1. Jaterní alkohol dehydrogenáza – v cytosolu, z etanolu vzniká acetaldehyd, který je aldehyd dehydrogenázou metabolizován na kyselinu octovou.
- 2. MEOS – microsomal ethanol oxidizing systém, který obsahuje inducibilní cytochrom CYP2E1. U chronických alkoholiků dochází k jeho indukci se vznikem více acetaldehydu.
- 3. Peroxisomální kataláza
Příjem etanolu působí intracelulární akumulaci triglyceridů (zvýšení absorpce a snížení oxidace mastných kyselin) a zároveň snížení syntézy a glykosylace proteinů. Vznik acetaldehydu vede ke zvýšení oxidačního stresu hepatocytů s tvorbou reaktivních kyslíkových radikálů, které aktivují Kupfferovy buňky, jejichž cytokiny aktivují hvězdicovité buňky s iniciací fibrogeneze. Tvorba pojivové tkáně působí vznik regeneračních uzlů a dále ke vzniku adduktů s proteiny, které interferují s četnými funkcemi hepatocytů. Postupně dochází k úbytku hepatocytů, tvorba kolagenu retrahuje játra s jejich zmenšením. Tento proces trvá ve výsledku roky až desetiletí.
Klinický obraz – na mnoho případů cirhózy se přijde náhodně (abnormální nález v krevních testech nebo zobrazovacích metod), časté pouze nespecifické obtíže, např. přechodná bolestivost pravého horního kvadrantu, nauzea, zvracení, průjem, nechutenství, únavnost, horečka. Někdy se projeví specifičtějšími symptomy jaterního poškození, jako jsou ascites, otoky, krvácení do horního gastrointestinálního traktu, ikterus nebo jaterní encefalopatie.
Při fyzikálním vyšetření je hepatomegalie s tvrdým a hrbolatým povrchem jater se splenomegalií, ikterem, palmárním erytémem (důsledek hyperkinetické cirkulace) a pavoučkovitými névy, zvětšené parotidy, nález nehtů tvaru hodinového sklíčka, ztráta aktivní svalové hmoty, edémy a ascites. U mužů gynekomastie, atrofie varlat (alkohol je přímo toxický k varlata), úbytek ochlupení (Chvostkův habitus). U žen s pokročilou alkoholickou cirhózou je nepravidelnost menstruačního cyklu až s amenoreou.
Při úspěšné abstinenci jsou tyto změny často reverzibilní.

Diagnostika – důležitá je podrobná anamnéza abusu alkoholu. Při zjištění cirhózy je nutné vyloučit ostatní příčiny! V časných stádiích bývají laboratorní testy zcela normální, bilirubin bývá v normě nebo zvýšený (i při normálním bilirubinu bývá často zvýšený přímý bilirubin). ALT a AST jsou typicky zvýšené, při pokračujícím etylismu se zvyšuje poměr AST:ALT ˃ 2. Na+ je v normě, při vzniku ascitu bývá hyponatrémie, protrombinový čas (INR) je prodloužený a bez reakce na podání vitamínu K.
Častá je anémie (ztráty krve do GIT + malnutrice + hypersplenismus při portální hypertenzi + suprese kostní dřeně alkoholem), může být i hemolytická anémie s akantocyty (Zieveho syndrom) a trombocytopenie (hypersplenismus při portální hypertenzi). U alkoholika je vhodné provedení jaterní biopsie pouze pokud je zvažována i alternativní příčina vzniku cirhózy.

Terapie – zásadní je okamžité zastavení příjmu alkoholu, ostatní viz alkoholické poškození jater.
Prognóza – pokud pacient s cirhózou nezanechá pití alkoholu je 5 leté přežití ˂ 50 %. Při abstinenci se prognóza dramaticky zlepšuje.
Cirhóza při chronické hepatitidě B a C
Hepatitida C – 80 % infekcí přejde do chronické ho stádia, u cca 25 % z nich dojde po cca 25 letech ke vzniku cirhózy. Předpokládá se, že v ČR je infikováno cca 0,5 – 1 % jedinců, v Egyptě je to ale cca 15 % populace. K poškození jater dochází vlivem aktivace imunitního systému, nejdříve dochází k periportální fibróze s přemostěním a poté vzniku uzlů a smíšené makro- a mikronodulární cirhózy. Játra jsou typicky malá a scvrklá.
Hepatitida B – cca 5 % přechází do chronického stádia a u cca 20 % z nich dochází ke vzniku cirhózy. V ČR je ročně hlášeno < 100 případů akutní hepatitidy B, v endemických oblastech (jihovýchodní Asie, subsaharská Afrika může být infikováno > 15 % lidí).
Cirhóza při autoimunitní hepatitidě a nealkoholickém ztučnění jater
Autoimunitní hepatitida – v tomto stádiu není žádný benefit z imunosupresivní terapie (prednison, azathioprin), protože autoimunitní zánět je již „vyhořelý“. Jaterní biopsie neukazuje žádnou zánětlivou reakci. Diagnóza je potvrzena průkazem autoprotilátek. Pokud jaterní biopsie ukáže ještě určitou zánětlivou reakci a je přítomna elevace aminotransferáz, lze ještě podání imunosupresivní terapie zvážit.
Nealkoholická steatohepatitida – spolu s epidemií obezity její prevalence stoupá. Často progreduje do cirhózy. Jelikož při progresi fibrotizace se snižuje i míra steatózy, je tato cirhóza často vyhodnocena jako idiopatická.
Biliární cirhóza
Podle lokalizace překážky odtoku žluči se dělí na intrahepatickou a extrahepatickou. Toto je důležité pro volbu terapie, protože při extrahepatických poruchách je výhodná chirurgická nebo endoskopická dekomprese, zatímco intrahepatické poruchy nejsou tímto způsobem ovlivnitelné. Od ostatních jednotek se odlišují přítomností určitých autoprotilátek, nálezem při cholangiografii i klinickým obrazem.
Histologicky jsou známky chronické cholestázy (xantomatózní transformace hepatocytů, depozita mědi), fibrózy, portálního a lobulárního chronického zánětu. Při progresi do cirhózy je přítomna i duktopenie.
Primární biliární cirhóza (PBC)
Epidemiologie – prevalence PBC je 1 : 5000 – 10000, výrazně převažuje postižení žen (> 90 %), věkově nejčastěji středního věku (průměrně 50 let).
Etiologie – neznámá.
Patofyziologie – přítomen portální zánět a nekróza cholangiocytů ve žlučovodech malého a středního kalibru. Klíčovou roli pravděpodobně hraje patologická autoimunitní reakce cytotoxických T-lymfocytů proto interlobulárních a septálních žlučovodů. Za jeden z patofyziologických mechanismů se považuje i narušení glykokalyxové ochranné vrstvy na epitelu žlučovodů („bikarbonátový deštník“), která jej normálně chrání proti toxickému účinku žlučových kyselin. Jeho součástí je AE2 (anion exchanger), Cl–/HCO3– antiport, jehož exprese je u pacientů s PBC snížena. Výsledkem je progresivní granulomatózní zánět, který vede k aktivaci hvězdicovitých buněk, fibroprodukci a cirhóze. PBC je jednou z příčin tzv. syndromu mizejících žlučovodů.
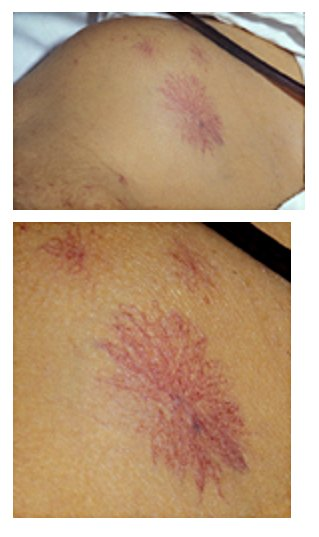
Klinický obraz – před end-stage fází je většina pacientů asymptomatických. Častá je nadměrná únava, která může až omezovat běžný život. V době stanovení diagnózy má 50 % pacientů pruritus, zpočátku intermitentní (nejčastěji večer). Pruritus ještě před objevením ikteru znamená těžký průběh choroby a zhoršenou prognózu. Občas bývají bolesti kostí pro přítomnou osteopenií a osteoporózu. Následují známky cholestázy s ikterem, progresivním jaterním selháním a vznikem cirhózy se všemi komplikacemi. Navíc jsou známky chronické cholestázy s typickými příznaky – hyperpigmentace (zejména na trupu a končetinách se škrábanci pro pruritus), xantomy, xantelesmata.
Typický pacient – žena středního věku s chronickou elevací ALP a GGT.
Protilátky AMA nejsou patogenetické, spíše je lze chápat jako marker onemocnění (pozitivita v cca 95 %). Zásadní je jaterní biopsie. Zároveň je nutné cholangiograficky vyloučit primární sklerozující cholangitidu.
Diagnostika
Diagnóza PBC = splnění dvou ze tří kritérií: 1. Cholestatický laboratorní obraz, 2. Pozitivita AMA nebo ANA subtypů anti-sp100 a anti-gp210, 3. Typický nález při biopsii jater.
- ↑↑ GGT, ALP
- ALT a AST mohou ale nemusí být zvýšené
- bilirubin se zvyšuje až při rozvoji cirhózy
- ↑ bIgM – typické
- AMA (antimitochondriální protilátky) jsou pozitivní u 95 % pacientů, tedy nejsou patognomonické. Nepřímou imunofluorescencí lze rozlišit 9 typu, pro PBC je typická pozitivita AMA M2. Na druhou stranu je AMA pozitivní u 0,1 % zdravých lidí (u některých indiánských kmenů v USA až u 15 % zdravých jedinců) a tito jedinci by se měli dále sledovat.
- 30 % pacientů s PBC má dále pozitivitu ANA, s vysokou specificitou zejména u podtypů anti-sp100 a anti-gp210 (lze využít k diagnostice AMA negativních pacientů s PBC).
Jsou cíleny proti membránovým proteinům mitochondrií – komplex pyruvát dehydrogenázy (nejvyšší afinita), komplex branched chain 2-oxoacid dehydrogenázy, komplex 2-oxogluterát dehydrogenázy,
- pancytopenie při rozvoji portální hypertenze s hypersplenismem.
- ze zobrazovacích metod je k vyloučení obstrukce indikován ultrazvuk, při nejasném nálezu MRCP/EUS. Jaterní elastografie je užitečná spíše ke stagingu choroby (přitomnost fibrózy nebo cirhózy).
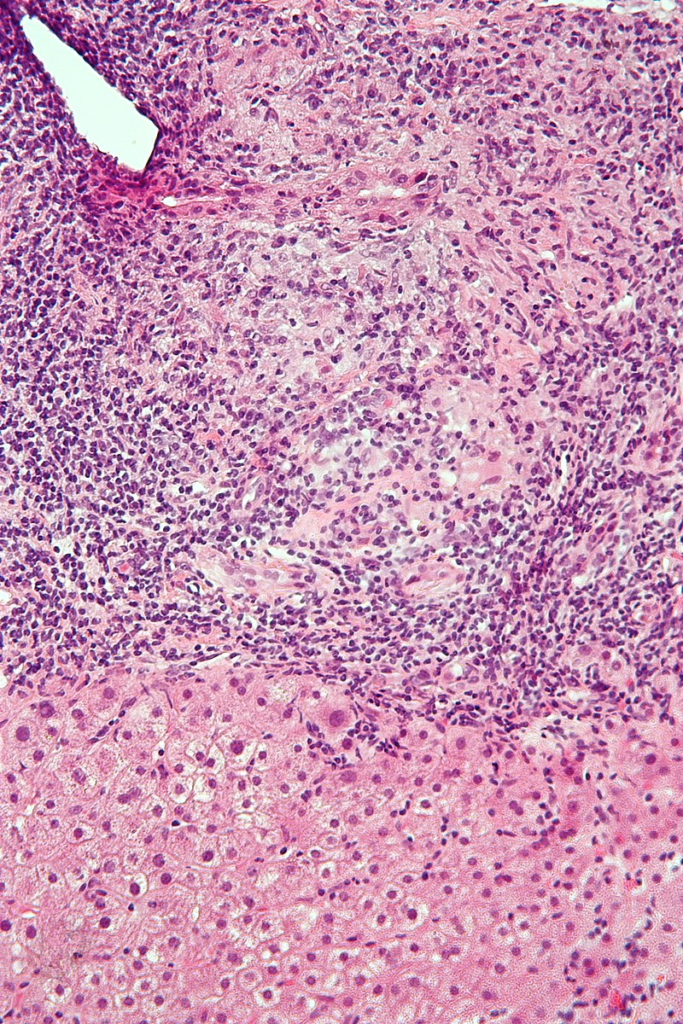
- Jaterní biopsie – 4 histologická stádia choroby:
- 1. stádium – chronická nesupurativní destruktivní cholangitida – zánět s nekrózami portálního traktu. Malé a střední žlučovody jsou infiltrovány lymfocyty. Může být mírná fibróza s cholestázou.
- 2. + 3. stádium – progrese choroby, kdy je zánět je mírnější a je redukováno množství větších žlučovodů s proliferací malých žlučovodů. Progreduje periportální a přemosťující fibróza.
- 4. stádium – jaterní cirhóza mikro- nebo makronodulární.
CAVE U 10 % pacientů s PBC může mít přítomny příznaky AIH-overlap syndrom.
Diagnostický algoritmus:
- Cholestatický laboratorní nález a negativita virových hepatitid.
- Vyloučení DILI (polékového poškození jater).
- Laboratorní odběr AMA a ANA (anti-sp100 a anti-gp210) – pozitivita…PBC, při negativitě
- MRCP/EUS k vyloučení obstrukce.
- Jaterní biopsie – pozitivita…PBC, při negativitě
- Genetické vyšetření, zopakování algoritmu nebo sledování.
Terapie
- 1. Léčbou první volby je kyselina ursodeoxycholová (UDCA) v dávce 15 mg/kg/den. Lék je obecně dobře snášen, u některých pacientů může dojít k nárůstu hmotnosti, dyspepsii nebo průjmu.
- 2. Léčbou druhé volby je kyselina obeticholová, která je agonistou FX receptoru a zpětnovazebně snižuje produkci žlučových kyselin játry. Působí i jako růstový faktor cholangiocytů a hepatocytů. Léčba se zahajuje dávkou 5 mg/kg/den se zhodnocením efektu po 6 měsících. Nežádoucím pčinkem může být zhoršení pruritu a dekompenzace jaterního onemocnění. Zahájení je indikováno při splnění alespoň jednoho kritéria: 1. ALP > 1,67 ULN a/nebo bilirubin < 2 ULN při terapii UDCA trvající nejméně 12 měsíců, 2. intoleranci UDCA.
- Budesonid – efektivní zejména u overlap syndromu AIH/PBC. Recentně publikovány výsledky, že UDCA v kombinaci s budesonidem je efektivnější než UDCA s placebem.
- Fibráty – běžné léky v terapii dyslipoproteinémie, které působí jako agonista PPAR-α a uplatňují se i na úrovni hepatocytu a cholangiocytu. U UDCA nonrespondérů vede dle studie BEZURSO přidání bezafibrátů k UDCA k významnému zlepšení biochemického nálezu i příznaků PBC (zejména únava pruritus). Budesonid a bezafibrát nicméně zatím nejsou schválené jako léky druhé volby při terapii PBC.
- Symptomatická terapie
- pruritus – chladivá emolencia, cholestyramin (CAVE je nutné oddělit jeho podání nejméně 3 hodiny od podání UDCA).
- únava – vyvarovat se spouštěcím faktorům, psychoterapie.
- metabolická kostní choroba – kalcium, vitamín D, denosumab, bisfosfonáty (po trnaplantaci jater preferenčně zolendronát).
Těhotenství – choroba není KI v těhotenství, může ale dojít ke zhoršení pruritu. UDCA je bezpečná během těhotenství i kojení.
Primární sklerozující cholangitida (PSC)
Etiologie – neznámá
Patofyziologie – chronický cholestatický syndrom, který je charakterizován difuzním zánětem a následnou fibrózou, který postihuje celý žlučový strom, což vede k jeho obliteraci a chronické cholestáze, biliární cirhóze, portální hypertenzi a jaternímu selhání.
Klinický obraz – podobný ostatním chronickým cholestázám (únava, pruritus, steatorea, deficit vitamínů rozpustných v tucích, osteoporóza).
CAVE ˃ 50 % pacientů má zároveň přítomnou ulcerózní kolitidu.
Obávanou komplikací je vznik cholangiokarcinomu.
Diagnostika
- ↑↑ GGT, ALP
- ↑↑ p-ANCA – u 65 % pacientů.
- ↑ ALT, AST (při zvýšení ˃ 5x ULC jde pravděpodobně o overlap syndrome s AIH, pro potvrzení je vhodné provést test na autoprotilátky při AIH).
- ↓ albumin při cirhóze.
- ↓ INR jednak při snížené syntetické schopnosti jater, jednak při malabsorpci vitamínu K (je částečně reverzibilní parenterálním podáním vitamínu K).
Pokud stanovíme diagnózu primární sklerozující cholangitidy, je nutné provést následně screeningovou kolonoskopii.
Jaterní biopsie – proliferace žlučovodů, fibrózní cholangitida a duktopenie. V end-stage fázi je přítomna biliární cirhóza. Výsledek biopsie není často zcela průkazný a musí být doplněn cholangiografií.
Cholangiografie – vyšetřením volby je MRCP, ERCP pouze při suboptimální vyšetřitelnosti. Typickým nálezem je přítomnost mnohočetných korálkovitých striktur na intra- i extrahepatických žlučovodech. Žlučník a ductus cysticus je postižen v 15 % případů.
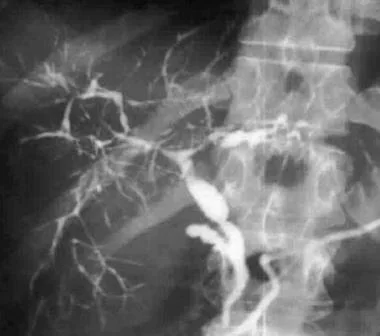
Terapie – specifická léčba neexistuje. Určitý benefit může poskytnout podání UDCA v dávkách odpovídajících PBC, při strikturách velkých žlučovodů může být pokus o endoskopickou dilataci největších striktur. Základní léčbou je transplantace jater. Ostatní symptomatická léčba viz PBC.
Kardiální cirhóza
Etiologie – je čím dál vzácnější. Vzniká při dlouhodobém městnání ve velkém oběhu z důvodu pravostranného srdečního selhání. Zvýšený centrální žilní tlak se přenáší cestou vena cava inferior a hepatickými žílami do jaterních sinusoidů, které jsou dilatované a přeplněné krví. Játra se následně zvětšují. Při dlouhodobé pasivní kongesci a relativní ischemii při špatné cirkulaci, dochází k nekróze centrilobulárních hepatocytů s následnou pericentrální fibrózou. Postupně dochází k rozšiřování těchto změn periferně až fibrotizuje celý lalůček.
Klinický obraz – dominují známky pravostranného městnání, je přítomna hepatomegalie. Vznik jaterní encefalopatie a krvácení z jícnových varixů je nepravděpodobný. Typický pacient dlouhodobě pravostranně selhává, má elevací ALP a hepatomegalii.
Diagnostika
- ↑ ALP
- ALT a AST bývají normální nebo lehce zvýšené (typicky ALT ˂ AST)
- Jaterní biopsie ukazuje typicky pericentrální fibrózu, velice podobný je obraz i u některých venookluzivních chorob (Budd-Chiarriho syndrom – na rozdíl od kardiální cirhózy ale dochází k extravazaci erytrocytů), po transplantaci kostní dřeně, po požití některých bylinných čajů (obsahují pyrolizidinové alkaloidy, časté v Karibiku, v USA vzácné).
Terapie – spočívá v léčbě kardiální choroby.
Ostatní typy cirhózy – u hemochromatózy, Wilsonovy choroby, deficitu α1-antitrypsinu, cystické fibróza.
Komplikace jaterní cirhózy a portální hypertenze
Portální hypertenze je definována jako přítomnost portokaválního gradientu (HVPG) ˃ 5 mm Hg (u klinicky manifestní portální hypertenze obvykle > 10 mm Hg). Je způsobena zvýšením nitrojaterní cévní rezistence při cirhóze a zvýšenýho průtoku díky hyperkinetické cirkulaci při vazodilataci splanchnické oblasti. Je přímo odpovědna za ascites a krvácení z jícnových varixů.
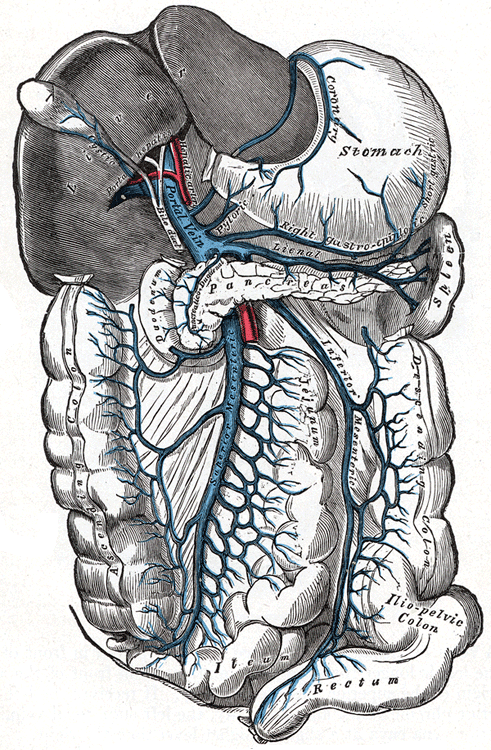
Portální systém normálně drénuje krev ze žaludku, střeva, sleziny, pankreatu a žlučníku. Portální žíla vzniká spojením:
- vena mesenterica superior (colon ascendens + část transversum, hlava pankreatu) +
- v. lienalis (slezina, kauda pankreatu) do které se vlévá
- v. mesenterica inferior (část colon transversum + descendens, rektum).
Etiologie – příčiny:
- prehepatické – postihují v. portae ještě před vstupem do jater, např. trombóza portální žíly a/nebo lienální žíly, Bantiho syndrom (splenomegalie při chronické městnání ve slezině nejasné příčiny).
- posthepatické – postihují jaterní žíly a v. cava inferior, např. trombóza jaterních žil (Budd-Chiarriho syndrom) nebo dolní duté žíly, kardiální příčiny (konstriktivní perikarditida, pravostranné srdeční selhání).
- intrahepatické (95% všech příčin portální hypertenze) – dělí se dále na:
- presinusoidní – kongenitální hepatální fibróza, schistostomiáza.
- sinusoidní – jaterní cirhóza z mnoha příčin, alkoholická hepatitida.
- postsinusoidní – trombózou jaterních sinusů (veno-okluzivní syndrom).
| Prehepatické | Trombóza v. portae | |
| Trombóza v. lienalis | ||
| Masivní splenomegalie (Bantiho syndrom) | ||
| Hepatické | presinusoidální | Schistostomióza |
| Kongenitální jaterní fibróza | ||
| sinusoidální | Cirhóza | |
| Alkoholická hepatitida | ||
| postsinusoidální | Jaterní obstrukce sinusoidů (venookluzivní syndrom) | |
| Posthepatální | Budd-Chiariho syndrom | |
| Trombóza vena cava inferior | ||
| Těžké pravostranné srdeční selhání |
V USA je nejčastější příčinou portální hypertenze jaterní cirhóza a naopak 60 % pacientů ve stádiu jaterní cirhózy má portální hypertenzi.
Trombóza portální žíly může vzniknout v souvislosti s primárním nebo sekundárním trombogenním stavem, cirhózou, pankreatitidou nebo traumatem břicha.
Klinický obraz a komplikace portální hypertenze – Známkou rozvoje portální hypertenze u cirhotiků je vznik trombocytopenie, splenomegalie, ascitu, encefalopatie a jícnových varixů. Při objevení jakéhokoliv příznaku u jinak zdravého člověka je nutné primárně vyloučit jaterní cirhózu.
I. Jícnové varixy
Příčinou vzniku jícnových varixů je dlouhotrvající portální hypertenze. Zvýšeným tlakem dochází k rozšíření portokaválních spojek, konkrétně mezi vena coronaria ventriculi (povodí v. portae) a venae oesophageae vena azygos (povodí v. cava superior). K jejich vzniku dochází u třetiny pacientů s histologicky potvrzenou cirhózou, z nichž cca třetina krvácí. Roční riziko vzniku jícnových varixů u cirhotiků je 5 – 15 %. Mezi rizikové faktory krvácení jícnových varixů patří závažnost jaterní cirhózy, vysoký HVPG (> 16 mmHg), tenzní ascites, velké varixy a endoskopická stigmata (červené ohraničení, varixu, modré skvrny, difuzní erytém).
Diagnostika – metodou volby k diagnostice jícnových varixů je endoskopie (lze je klasifikovat podle NIEC na stadia F1 – F3 dle závažnosti a dále přítomnosti rizikových faktorů krvácení).
K zobrazení kolaterální cirkulace u portální hypertenze je vhodné CT nebo MRI, při nejasnostech je možné intervenčně změřit tlak v zaklínění jaterních žil (norma je do 5 mm Hg při gradientu ˃ 12 mm Hg je vysoké riziko vzniku jícnových varixů, při > 16 mm Hg je vysoké riziko akutního krvácení).
Terapie
1. Primární profylaxe – k prevenci krvácení z varixů a optimálně jejich vzniku.
- u cirhotiků je vhodná pravidelná screeningová endoskopie u pacientů s pokračujícím jaterním onemocněním (nedosažení SVR u virových hepatitid, abusus alkoholu u alkoholické cirhózy) vstupně při nenalezení varixů za 2 roky, při nálezu varixů za 1 rok, u stabilizovaných cirhotiků vstupně při nenalezení varixů za 3 roky, při nálezu varixů za 2 roky.
- pokud jsou jícnové varixy se zvýšeným rizikem krvácení zjištěny, toto riziko krvácení snižuje:
- medikace neselektivních betablokátorů (karvedilol, propranolol, nadolol a timolol). U nás nejvíce karvedilol, který se začíná titrovat v dávce 3,125 mg 2x denně na cílovou dávku 6,25 mg 2x denně. Preventivní podáváním beta blokátorů u cirhotiků bez varixů se v současné době nedoporučuje, indikovány od stádia F1. Optimálním způsobem (obvykle nedostupným) k ověření efektu terapie by bylo opakované stanovení tlaku v zaklínění jaterních žil.
- endoskopická ligace varixů – indikována u stádia F2 a F3.
- u pacientů s rizikovými varixy je vhodné obě metody kombinovat.
2. Prevence recidivy krvácení – po prvním krvácení je riziko recidivy 60 – 63 %.
- časná TIPS – měl by být zvážen u všech rizikových pacientů (u všech pacientů Child – Pugh C, ve skupině B u perzistenci krvácení při endoskopii přes vazoaktivní terapii). Intervenčně se provede komunikace a portosystémový zkrat mezi hepatickými žílami a v. portae, dojde tak ke snížení HVPG a tak i rizika krvácení z varixů. Lze někdy užít jako most k transplantaci. U pacientů se ve 20 % objevuje encefalopatie (zejména u starších a s latentní encefalopatií).
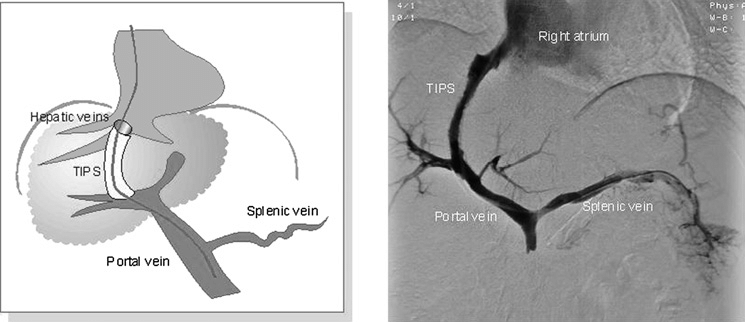
Pokud není po atace krvácení kontraindikována terapie beta blokátory je vhodné zahájit jejich podávání spolu s endoskopickou terapií. Pokud je přítomna kontraindikace terapie beta blokátory, není indikována ani endoskopická léčba a je vhodné provedení časného TIPS event časné transplantace jater.
3. Terapie akutního krvácení – zásadní je pacienta henmodynamicky stabilizovat a zabránit dalšímu krvácení. Nutností je příjem na JIP.
- zásadní je dostatečný žilní přístup (optimálně centrální žíla) a volumová resuscitace krystaloidy k hemodynamické stabilizaci. U hemosubstituce se snažíme udržet hemoglobin v rozmezí 70 – 80 g/l (u pacientů s pokročilejším kardiovaskulárním onemocněním je cílová hodnota okolo 100 g/l). Podání čerstvé mražené plazmy i rekombinantního faktoru VII není v současnosti doporučováno (existují ale výsledky dvou studií, kdy podání rekombinantního faktoru VII vedlo u rizikových pacientů k benefitu).
- antibiotická profylaxe, jelikož při portální hypertenzi je velmi četná bakteriální systémová infekce, zejména u pacientů s pokročilejším stádiem cirhózy (Child-Pugh B a C).Nejvíce důkazů je u cefalosporinů III. generace (ceftriaxon) a chinolonů. Podání by mělo být zahájeno ještě endoskopickým vyšetřením.
- terapie jaterní encefalopatie s podáním 15 – 30 ml laktulózy 3x denně (cílem dosažení 2 – 3 stolice denně) event. v kombinaci s rifaximinem.
- vazoaktivní léčba je základem terapie (terlipresin, somatostatin a oktreotid), kterou je vhodné zahájit ještě před endoskopickým vyšetřením a má být podávána 5 dní. Nejdéle používaným je agonista V1 receptoru terlipresin. Působí výraznou vazokonstrikci splanchnického řečiště spolu s poklesem portálního tlaku i průtoku kolaterálami. Má poločas 3,5 hodiny, lze jej tedy podávat bolusově á 4 hodiny 2 mg. Kontraindikací je závažná ischemická choroba srdeční a dekorigovaná hypertenze.
- endoskopická terapie je zásadní k ověření zdroje krvácení a lokálnímu ošetření krvácejících varixů. Vzhledem k vysoké účinnosti vazoaktivní léčby není endoskopická léčba emergentní a lze ji provést po stabilizaci pacienta, nejpozději však 12 hodin (optimálně 6 hodin) po přijetí do nemocnice. Zásadní je přehlednost terénu, proto je 30 – 120 minut před vlastní endoskopickým vyšetřením vhodné podání erytromycinu (v této indikaci se využívá nikoliv jeho antibiotický účinek, ale erytromycin výrazně snižuje motilitu žaludku), i.v. erytromycin ovšem není u nás registrován). Endoskopickým výkonem volby je ligace varixů (v akutní fázi je vhodné ligovat i ostatní varixy v sekundární profylaxi), pouze při nemožnosti ligace je vhodná jejich sklerotizace 1 – 3 % polidokanolem.
U určité části pacientů se nepodaří akutní krvácení výše popsaným způsobem zastavit. V tomto případě je indikován následující postup:
- zavedení balónkové Sengstaken-Blakemorovy sondy při selhání terapie nebo při odeslání krvácejícího pacienta do endoskopického centra. Zavedení je poměrně obtížné a je 10 – 15 % riziko komplikací (aspirace, proto je nutná často orotracheální intubace a lacerace jícnu). Sondu je možné ponechat insuflovanou maximálně 12 – 24 hodin, jinak hrozí nekróza jícnu.
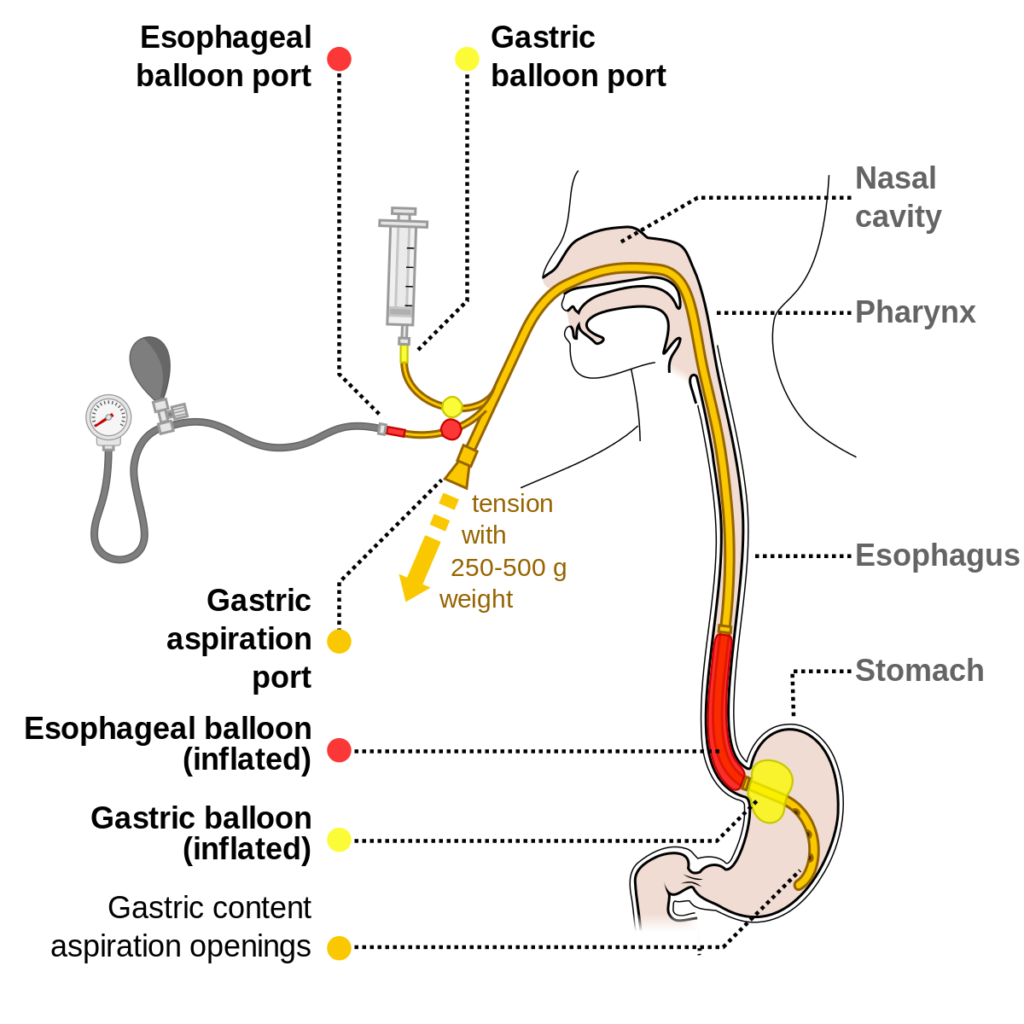
- zavedení jícnového stentu – zavedení metalického samoexpandabilního stentu během endoskopie vede k zastavení krvácení v 90 – 100 % případů. Má nižší riziko komplikací a může vést k mostem překlenutí období k časné TIPS.
- záchranný TIPS – při selhání léčby první linie je indikováno provedení porto-systémového zkratu, preferenčně TIPS se zavedením stentu z expandovaného polytetraflouroetylenu což vede k zastavení krvácení v 90 – 100 % případů. Hlavní komplikací je akutní okluze stentu. Hlavní význam je u žaludečních varixů, které hůře reagují na endoskopickou terapii. TIPS je kontraindikován při významném jaterním poškození s Child-Pugh skóre >13, kdy je indikováno zavedení samoexpandabilního stentu spolu s léčbou první linie, ovšem při vědomí velice nepříznivé další prognózy pacienta.
Žaludeční varixy – u cca 5 – 33 % pacientů s portální hypertenzí se současně vyskytují i žaludeční varixy. Základní terapie je stejná jako u krvácení z jícnových varixů, ovšem při vědomí nižší úspěšnosti endoskopické léčby a preferenčním použití tkáňového lepidla (např. Histoacryl) oproti ligaci. Jako záchrannou léčbu není možné použít samoexpandabilní stent ani balónkovou sondu a jako jediná možnost zbývá záchranný TIPS.
Klasifikace dle Sarina
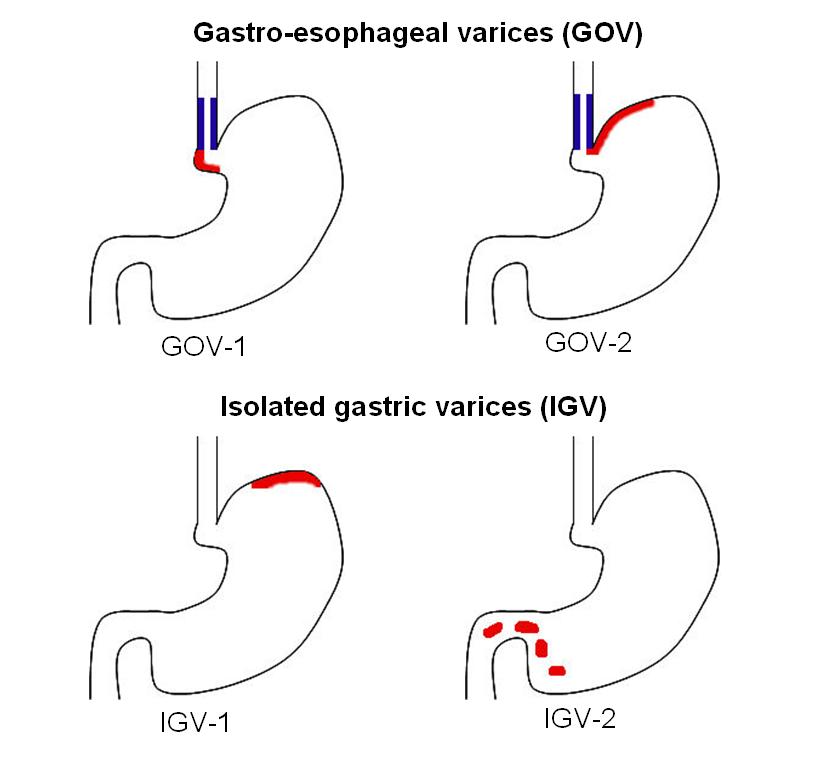
Dělí se na gastroezofageální varixy (GOV-1 blíže malé křivině, GOV-2 blíže velké křivině) a izolované žaludeční varixy (IGV-1 na fundu, IGV-2 roztroušené ve sliznici žaludku).
CAVE Nejnebezpečnější je forma IGV-2, která zahrnuje pouze 3 % všech žaludečních varixů, ale je odpovědna za 78 % všech krvácení).
K prevenci krvácení je vhodné podávání neselektivních beta blokátorů a u GOV1 je možné použít endoskopickou ligaci, u ostatních je pak vhodná sklerotizace popřípadě zvážit TIPS.
Problematika je vyčerpávajícím způsobem zpracována na webu České hepatologické společnosti: https://www.ces-hep.cz/file/485/varikozni-krvaceni-doporuceni-chs-2017.pdf
II. Splenomegalie a hypersplenismus
Kongestivní splenomegalie je u pacientů s portální hypertenzí častá. Projevuje se splenomegalií s rozvojem trombocytopenie a leukopenie u pacientů s cirhózou. Někteří pacienti mají neurčitou bolest v levém horním kvadrantu. Trombocytopenie z důvodu hyperspenismu je často prvním projevem portální hypertenze. Léčba sama o sobě není potřeba.
III. Ascites
Nejčastější příčinou ascitu (patologické nahromadění tekutiny v břišní dutině) je jaterní cirhóza, nutné je ale vždy vyloučit maligní a infekční příčinu.
Patogeneze – při rozvoji cirhózy s portální hypertenzí se zvyšuje nitrojaterní rezistence s nárůstem portálního tlaku. Dochází ale také ke splanchnické vazodilataci (např. efekt NO) se zvýšením portálního toku. Oba tyto faktory vedou ke zvýšení produkce lymfy, aktivaci renin-angiotenzin-aldosteronového systému se vznikem sekundárního hyperaldosteronismu a retencí sodíku a vody a únikem tekutiny extracelulárně a následným vznikem periferních otoků a ascitu, k čemuž přispívá hypoalbuminémie (z důvodu snížené syntetické schopnosti jater) a následný snížený onkotický tlak plazmy.
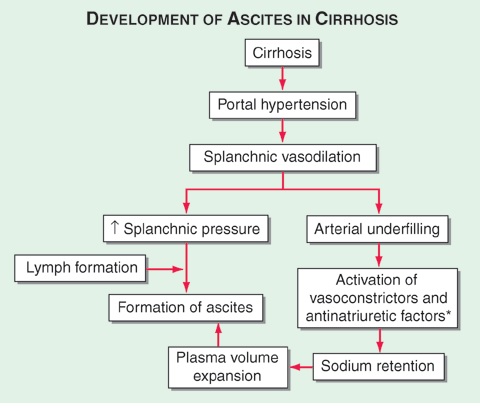
Klinický obraz – dochází k pozvolnému zvětšení obvodu pasu, zároveň vznikají periferní otoky. Pacienti ascites často přehlíží a k lékaři přicházejí až při objemu ascitické tekutiny 1 – 2 litry. Při masivním ascitu může dojít k mechanickému omezení dýchání s dušnosti. V této fázi jsou pacienti často malnutričtí s úbytkem svalové tkáně a slabostí.
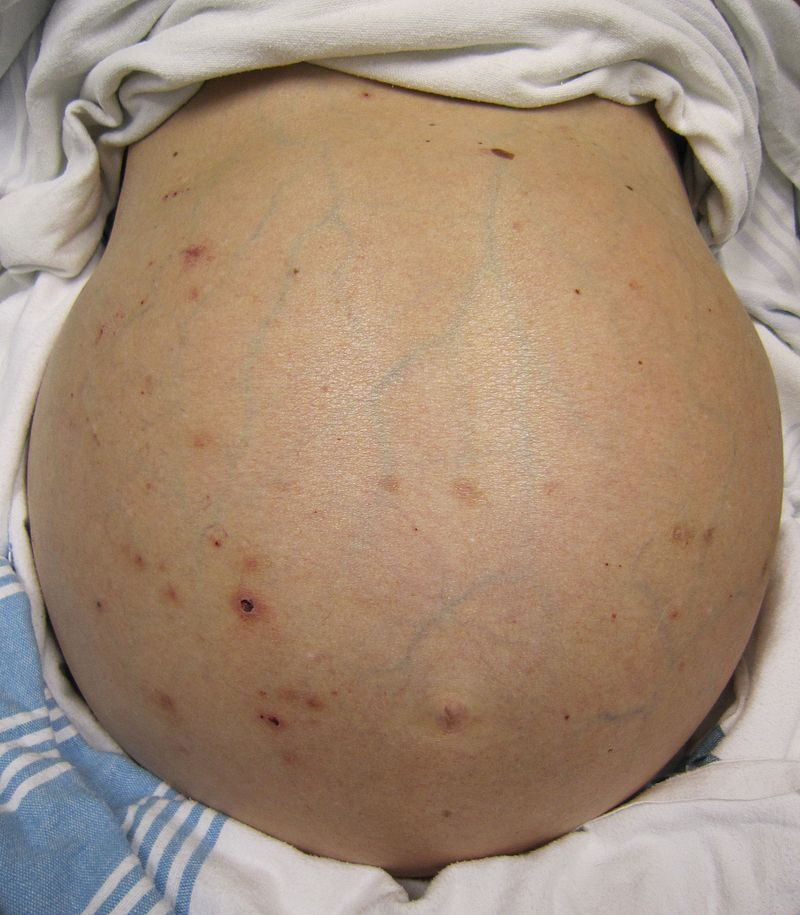
Diagnostika
- fyzikální vyšetření – pacienti mají vystouplé boky, undulační vlnky jsou pozitivní a je přítomné poklepové ztemnění v závislosti na poloze pacienta. Ultrazvuk, CT – k potvrzení diagnózy.
- Při nové diagnóze ascitu je nutné provést diagnostickou paracentézu s analýzou ascitické tekutiny a stanovením:
- bílkoviny – u cirhózy je obvykle velmi nízká hladina (< 25 g/l).
- albumin – při transsudátu (cirhóza) je gradient mezi sérovým a ascitickým albuminem (SAAG) ˃ 11 g/l, naopak při exsudátu (maligní nebo infekční ascites) je ˂ 11 g/l.
- množství leukocytů – při množství neutrofilů ˃ 250 · 106/ml je pravděpodobná infekce ascitické tekutiny se vznikem SBP (spontánní bakteriální peritonitida).
- množství erytrocytů – zvýšené při traumatickém ascitu, maligním ascitu nebo ruptuře omentálního varixu.
- amyláza – zvýšené při akutní pankreatitidě.
- mikrobiologická kultivace – pozitivní při infekci ascitické tekutiny.
- cytologické vyšetření – pozitivní při maligním ascitu.
U pacientů s cirhotickým ascitem je v ascitu nízká koncentrace proteinů (většinou ˂ 10 g/l) a tekutina má charakter transsudátu.
Terapie – je nutné dodržovat některé principy:
- 1. Vyloučení nefrotoxických léků (především nesteroidních antirevmatik, aminoglykosidových antibiotik).
- 2. Omezení příjmu NaCl na 5-7.5 g/den.
- 3. Diuretická léčba u malého a středního ascitu. Lékem volby je spironolacton při respektování kontraindikací (běžná dávka je 200 mg/den, maximálně až 400 mg/den). Na efekt je potřeba počkat několik dní. Při nedostatečném účinkuje je indikován furosemid, pokud lze, vždy v kombinaci se spironolactonem, v maximální dávce až 160 mg/den. Intravenózní podání albuminu spolu s diuretickou léčbou zlepší odpověď na léčbu diuretiky.
- 4. Paracentéza u velkého nebo refrakterního ascitu. Optimální je vypustit větší množství ascitu, případně všechen. V případě jednorázového odstranění více než 5 litrů ascitu je třeba podat i.v. albumin (v dávce 6-8 g/l vypuštěného ascitu). Smyslem tohoto opatření není náhrada odstraněného albuminu, ale prevence hypovolémie po paracentéze. Alternativou je podání terlipresinu.
- 5. TIPS v případě nutnosti opakovaných paracentéz.
- 6. K léčbě diluční hyponatremie je vhodné vysadit diuretika či snížit jejich dávku a pokusit se o expanzi objemu i.v. podáním koloidních roztoků. Restrikce tekutin může dále zhoršit renální funkce. Podávání sodíku není vhodné.
- 7. Pro léčbu ascitu u pacientů s renálním selháním, těžkou encefalopatií či dalšími komplikacemi jaterní cirhózy nelze stanovit jednoznačné doporučení a je třeba postupovat individuálně. Stejně je tomu u nespolupracujících nemocných, zejména pokračujících v abusu alkoholu.
- 8. Zvážení transplantace jater.
Prognóza – špatná. Po objevení ascitu u pacientů s jaterní cirhózou je 2 leté přežití ˂ 2 roky. Proto by měl být cirhotický ascites signálem k provedení transplantace jater. Pacienti s ascitem jsou ve vysokém riziko vzniku renálního selhání.
Doporučený postup k terapii cirhotického ascitu viz zde: https://www.ces-hep.cz/file/322/doporuceny-postup-chs-ascites-pri-jaterni-cirhoze.pdf
IV. Spontánní bakteriální peritonitida
Definice – spontánní bakteriální peritonitida (SBP) je definována jako bakteriální infekce ascitu bez chirurgicky léčitelného zdroje infekce (u cca 20 % pacientů přijatých do nemocnice s ascitem).
Etiologie – nejčastější agens je Escherichia coli (75 – 80 %), běžné jsou ale i Streptococcus viridans (20 %) a Enterococcus sp (5 %), pokud je nález dvou a více mikrobiologických agens, je nutné vyloučit perforaci střeva.
Patogeneze – mechanismem je bakteriální translokace střevní flóry přes střevní stěnu do mezenteriálních uzlin se vznikem bakteriémie a infekcí ascitické tekutiny. Situaci zhoršuje zhoršená obranyschopnost organismu při jaterní cirhóze.
Klinický obraz – příznaky jsou často nevýrazné, může se projevit pouze zhoršením renálních jaterních funkcí nebo refrakteritou ascitu se zhoršením reakce na diuretika. Může být přítomna horečka, alterace duševního stavu, dyskomfort a bolesti břišní krajiny. Vzniká často i po krvácení z jícnových varixů. Pokud není léčena, má mortalitu 30 %.
Diagnostika – jedinou metodou ke stanovení diagnózy je diagnostická paracentéza se stanovením:
- koncentrace neutrofilů v ascitické tekutině (při SBP je ˃ 250 · 106/ml).
- pozitivní mikrobiologické kultivace ascitické tekutiny.
- dále stanovení krevního obrazu se ↑ leukocytů s neutrofilií.
Terapie – základem léčby je zahájení antibiotické terapie empiricky ihned po stanovení diagnózy SBP s event. úpravou dle výsledků kultivace. Lékem volby je cefotaxim (cefalosporin III. generace). Dále bylo prokázáno, že podávání albuminu snižuje riziko hepatorenálního syndromu.
CAVE Po přeléčení první ataky SBP by všichni pacienti měli brát dlouhodobě antibiotika (celoživotně nebo do vymizení ascitu nebo provedení tranplantace jater). Optimální je norfloxacin.
Prognóza – při cirhóze s ascitem, která vyžaduje hospitalizaci je incidence spontánní bakteriální peritonitidy 30 % s mortalitou 25 %.
Prevence – riziko SBP výrazně vzrůstá při objevení se jícnových varixů.
V. Hepatorenální syndrom (HRS)
Forma funkčního selhání ledvin, které se objevuje u 10 % pacientů s pokročilou jaterní cirhózou nebo akutním jaterním selháním. Dochází k vzestupu arteriální renální rezistence (vazokonstrikce) v renálním řečišti spolu s poklesem systémové cévní rezistence (SVR), což vede ke snížení průtoku krve ledvinami. Pokles SVR je jedna z příčin ascitu, proto k HRS dochází často u pacientů s masivním ascitem.
Klasifikace
- 1. typ – progresivní pokles renálních funkcí, který je definován jako dosažení sérové hladiny kreatininu (Skreatinin) > 221 μmol/l během 2 týdnů.
- 2. typ – menší pokles renálních funkcí, které jsou poté již stabilní (má lepší prognózu než 1. typ).
Diagnostika – mezi diagnostická kritéria patří, která musí být všechna splněna:
- absence jiné vyvolávající příčiny renálního poškození (šok, sepse, hypovolémie, nefrotoxická medikace).
- proteinurie je <0,5g/l a nejsou ultrazvukové známky obstrukce vývodných močových cest ani choroby ledvin.
- pokles glomerulární filtrace (GF) < 0,66 ml/s nebo Skreatinin > 133 μmol/l.
- není zlepšení GF po vysazení diuretik a podání 1,5 litru fyziologického roztoku.
…mezi pomocná kritéria patří:
- oligurie < 500 ml/den.
- močová koncentrace sodíku (UNa+) < 10 mmol/l, sérová koncentrace sodíku (SNa+) < 130 mmol/l.
- osmolalita moči > osmolalita plazmy.
- množství erytrocytů v moči méně než 50 při vysokm zvětšení.
Terapie
- HRS I typu – nutná je hospitalizace, monitorace vitálních funkcí, úprava vnitřního prostředí a vysazení léků, které mohou zhoršovat renální funkce.
- nutná je vazokonstrikce splanchnického řečiště s expanzi plazmatického objemu. Základem je tedy podávání terlipresinu spolu s i.v. albuminem s efektem u 2/3 pacientů, většinou po dobu 15 dní, ale až na neurčito. Medián přežití se tak může prodloužit ze 2 týdnů na 6-12 týdnů.
- u pacientů, kteří nezareagují na vazokonstrikční léčbu je možno zvážit provedení TIPS.
- použití hemodialýzy je kontroverzní, většinou nevede ke zlepšení prognózy pacienta, použity by měly být pouze v případě těžkého stavu (těžká hyperkalémie, metabolická acidóza, hyperhydratace s plicním edémem), které nereagují na medikamentózní léčbu.
- vždy je nutné zvážit transplantaci jater (léčba vazokonstriktory před transplantací nevede ke zlepšení přežití).
- HRS II typu – terapie léčba je zaměřena na léčbu refrakterního ascitu:
- opakované velkoobjemové paracentézy s podáním albuminu i.v. (v dávce 6-8 g na litr vypuštěného ascitu).
- diuretickou terapii je nutné podávat uváženě (riziko hypovolémie a dalšího zhoršení renálních funkcí), většinou jsou indikována, jen pokud dojde ke zvýšení se diuretika podávají jen v případě, že zvýší (UNa+) > 30 mmol/den.
- v případě neúspěchu popsaných metod je možné zvážit provedení TIPS (není však jednoznačně prokázáno, TIPS povede k prodloužení přežití pacientů).
- podobně je možné se pokusit o léčbu terilpresinem
- vždy je nutné zvážit transplantaci jater (TIPS i léčba vazokonstriktory před transplantací může zlepšit přežití). Medián přežití bez transplantace jater je 6-9 měsíců.
Prognóza – pokud nedojde k transplantaci jater je prognóza špatná. Konzervativní postup u HRS I. resp. II. typu vede k přežití pouze Špatná, pokud se neprovede transplantace jater je medián přežití 1,5 – 3 měsíce resp. 6 – 9 měsíců.
Doporučený postup k terapii HRS viz zde: https://www.ces-hep.cz/file/323/doporuceny-postup-chs-hepatorenalni-syndrom.pdf
VI. Jaterní encefalopatie (JE)
Definice – JE je soubor reverzibilních neurologických a psychiatrických příznaků, které vznikají v souvislosti s pokročilým jaterním onemocněním a portosystémovými zkraty nebo s akutním jaterním selháním.
Patogeneze – při akutním jaterním selhání se objevuje při fulminantním průběhu, je ale mnohem častější u chronického jaterního selhání. Portální krev obsahující střevní neurotoxiny, je jednak zkratována portosystémovými kolaterálami, jednak je méně očišťována při poškození jater a tak tyto neurotoxiny přechází do systémového oběhu, kde ovlivňují mozkové funkce.
Úroveň amoniaku je většinou zvýšená, ale toto vyšetření je pouze pomocné a rozhodující je klinické vyšetření pacienta. Neexistuje ale korelace mezi hladinou amoniaku a závažností encefalopatie. Proto většina autorů nedoporučuje užívat hladinu amoniaku jako kritérium ke stanovení diagnózy. Dále jsou přítomny i jiné metabolity např. jisté falešné neurotransmitery nebo merkaptany.
Klinický obraz
- u akutního jaterního selhání nastávají změny v duševním chování během týdnů až měsíců. Může se vyskytnout i mozkový edém s mozkovou herniací, která je obávanou komplikací. Léčbou je restrikce tekutin a antiedematózní léčba manitolem.
- u chronického jaterního selhání se často jaterní encefalopatie precipituje při infekci, zvýšeném příjmu proteinů v dietě, hypokalémii nebo jiné elektrolytové dysbalanci. Začíná latentně jako tzv. konstrukční apraxie. Pacienti mohou být zmatení nebo vykazovat změnu osobnosti (agresivitu nebo naopak utlumení). Často se objevuje asterixis. Vyšetřuje se tak, že pacienti natáhnou horní končetiny a ohýbají zápěstí. Pacienti s encefalopatií mají tzv. flaping tremor, což se projevuje náhlým pohybem zápěstí. Nejtěžší formou jaterní encefalopatie je hepatální kóma.
Klasifikace – JE se dle závažnosti rozděluje do čtyř stupňů:
- 1. stupeň – euforie nebo deprese, bradypsychismus, mírná zmatenost.
- 2. stupeň – somnolence a celkově vystupňované příznaky 1. stupně.
- 3. stupeň – sopor, nespolupráce.
- 4. stupeň – kóma.
Diagnostika – stanovení diagnózy je klinické, pouze pomocnou hodnotu má hladina amoniaku. Důležité je zhodnocení celkového chování nemocného, dále přítomnost flapping tremoru, schopnosti podepsat se a vyšetření testu spojování čísel.
- test spojování čísel (NCT, Number Connection Test) je objektivním vyšetřením, při jehož hodnocení je třeba vzít v úvahu věk nemocného.
- kreslení hodin – test na konstrukční apraxii.
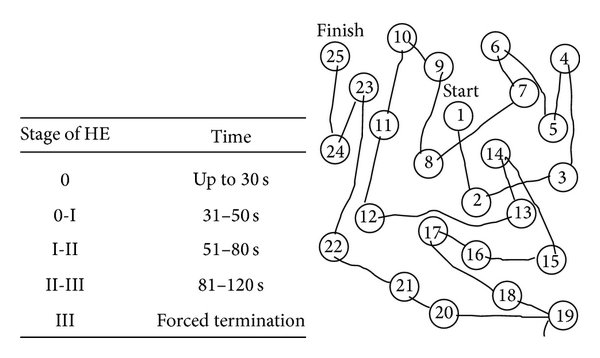
Neurofyziologické vyšetření a zobrazovací metody se většinou používají jen při zvláštních indikacích.
Vyšetření amoniaku v krvi není nutnou podmínkou diagnózy JE, pokud jej stanovujeme, pak má význam pouze jeho stanovení v arteriální krvi.
Terapie
- 1. Odstranění precipitujících faktorů – zvýšený příjem živočišných proteinů, léky (sedativa, analgetika, diuretika), alkohol, krvácení do trávicího traktu, hypokalémie, infekce, zácpa apod.
- 2. Optimalizace příjmu bílkovin – snížení celkového příjmu bílkovin u cirhotiků není vhodné, minimální denní dávka je 1 g/kg tělesné hmotnosti. Podle potřeby je možno zvýšit příjem rostlinných bílkovin či přidávat směsi aminokyselin (VLI). doplňující může být podávání ornitin-aspartátu.
- 3. Laktulóza – nevstřebatelný disacharid, který acidifikuje tlusté střevo, což zrychluje eliminaci dusíkatých metabolitů, které jsou odpovědny za vývoj encefalopatie. Cílem je dosažení 3 řídkých stolic denně.
- 4. Nevstřebatelná antibiotika – ovlivnění střevní mikroflóry podáním nevstřebatelných antibiotik (rifaximin, neomycin), či metronidazolu p.o.
- 5. Vznik JE by měl vést ke zvážení indikace transplantace jater.
Prognóza – z krátkodobého hlediska je JE dobře léčitelná, ale je znamením pokročilosti základní jaterní choroby.
Doporučený postup k terapii JE viz zde: https://www.ces-hep.cz/file/324/doporuceny-postup-chs-jaterni-encefalopatie.pdf
VII. Koagulopatie
Koagulopatie je u pacientů s cirhózou téměř vždy přítomna. Příčiny:
- snížená syntéza hemokoagulačních faktorů játry při redukci množství hepatocytů, která je bez reakce na parenterální podání vitamínu K.
- snížená resorpce vitamínu K při chronické cholestáze (k absorpci jsou potřeba žlučové kyseliny), proto je zpomalena i syntéza vitamin K dependentních koagulačních faktorů (II, VII, IX, X). Toto rychle koriguje parenterální (ne perorální) podání vitamínu K.
- trombocytopenie při hypersplenismu, často s přidruženou trombocytopatií
VIII. Hematologické abnormality
Anémie vzniká z mnoha příčin (hypersplenismus, hemolýza, deficit železa a folátů při malnutrici), často je přítomna makrocytóza. Při hypersplenismu vzniká i trombocytopenie a neutropenie.
IX. Malnutrice
Játra ovlivňují proteosyntézu a regulují metabolismus proteinů, proto často při jaterní cirhóze vzniká malnutrice. Pacienti upadají do katabolismu, dochází ke ztrátě svalové hmoty. Stav zhoršují i jiné přidružené faktory jako nedostatečná strava a střevní malabsorpce. Důležitá je normalizace proteinů ve stravě.
X. Jaterní kostní choroba
U pacientů s chronickou cholestázou je častá osteoporóza díky hypovitaminóze D (k absorpci vitamínu D jsou nutné žlučové kyseliny), sníženému přívodu kalcia a převaze osteoresorpce nad osteoprodukcí u pacientů s cirhózou. K diagnóze je nutná DEXA, při léčbě je nutná suplementace kalcia a vitamínu D a bisfosfonáty.