Maligní nádory jater
Úvod – celosvětově šestým nejčastějším nádorem a nejčastější příčinou smrti u cirhotiků. Patří sem nejčastěji hepatocelulární karcinom (HCC, 90 %), dále intrahepatický cholangiokarcinom (iCCA,10 %) a ostatní malignity (< 1 %). V ČR jde o nádor vzácnější (cca 500 nových případů ročně).
I. Hepatocelulární karcinom
Epidemiologie – celosvětově 7 % všech nádorů, nejvyšší incidence je v Asii a sub-Saharské Africe (nejvíce chronické infekce HBV = častá cirhóza = častý HCC). V ČR jde o vzácnější typ nádoru.
Etiologie a rizikové faktory
- jaterní cirhóza – jednoznačně nejvýznamnější rizikový faktor, celosvětově působí cca 80 % všech případů HCC. Cirhotici zaujímají cca 1 % celosvětové populace a u 1/3 z nich vznikne v průběhu života HCC (toto riziko je nejvyšší u cirhózy z hepatitidy B a C – roční riziko 3 – 8 % ~ 5 %, z ostatních příčin je lehce nižší – roční riziko 1 – 3 % ~ 2 %). Čím je cirhóza pokročilejší, tím je riziko HCC vyšší.
- kouření cigaret
- aflatoxin B1 – karcinogen přítomný v plísni (Aspergilus flavus, A. parasiticus) vyskytující se ve skladovaných potravinách (např. kukuřice, buráky) působí vznik mutace TP53.
- infekce adeno-asociovaným virem 2 na myším modelu prokázala zvýšené riziko vzniku HCC.
Patogeneze – proces malignizace začíná v prekancerotických cirhotických uzlech, tzv. low-grade dysplastic nodules, (LGDNs), které progredují do high-grade dysplastic nodules, (HGDNs) a ty se transformují do časných stádií HCC. Během této tranformace dochází ke vzniku cca 40 – 60 somatickým mutacím (TERT promoter (56 % případů), TP53 (27 %), CTNNB1 (26 %), ARID2 (7 %), ARID1A (6 %), AXIN1 (5 %) a další). Některé rizikové faktory mají vztah ke specifickým genovým mutacím. Jsou postiženy i některé signální dráhy, jejichž popis nebude předmětem tohoto sdělení.
Klinický obraz – HCC bývá obvykle diagnostikován v časnějších stádiích (většinou v terénu cirhózy, u které je screening HCC běžný). V tomto asymptomatickém stádiu se zachytí 70 – 80 % tumorů. Pokud jsou již příznaky přítomny (únava, nechutenství, váhový úbytek, břišní dyskomfort nebo pokročilá jaterní dysfunkce) je prognóza velice špatná s průměrným přežitím < 1 rok.
Diagnostika – od roku 2010 je doporučeno z diagnostických kritérií vyřadit hladinu AFP. Jeho úlohou zůstává sledování efektu prováděné léčby.
1. Screening – jeho smyslem je včasné odhalení HCC. Jedinou doporučenou metodou je ultrazvukové vyšetření jater á 6 měsíců (stanovení AFP se nedoporučuje). Ke screeningu jsou indikování pacienti:
- s cirhózou jakékoliv etiologie.
- HBsAg pozitivní.
- s chronickou HCV + významným stupněm fibrózy (stadium 3).
Při nálezu uzlu < 1 cm indikováno kontrolní sono za 3 měsíce, při nálezu většího uzlu CT/MR.
2. Histologická klasifikace – vzhledem k výraznému zlepšení radiologické diagnostiky jsou k biopsii indikována pouze nejasná ložiska < 2 cm. Problematické je, že hepatocyty nemají bazální membránu, proto se obtížně určuje invazivita růstu. V roce 2009 byla formulována nová doporučení a určité znaky, které HCC má:
- stromální invaze = uzel je maligní.
- nepárové arterie (tedy bezprizorní, jdoucí mimo portální pole) = neovaskularizace = uzel je maligní.
- imunohistochemická pozitivita glypicanu 3, glutamin syntetázy a heat-shock proteinu 70.
3. Radiologické metody – dle určitých radiologických kritérií lze usuzovat na povahu nádoru i bez biopsie. Použitelné je CT i MRI. CT je nutné nutné provádět ve čtyřech fázích (nativní, arteriální, venózní, pozdní), MRI jako dynamické s použitím kontrastu. Za jasný průkaz HCC se považuje nález hypervaskulárního uzlu v cirhotických játrech >1 cm s typickým vymýváním ve venózní či pozdní fázi.
CAVE Tato kritéria platí pouze u cirhotických jater.
Staging – stratifikace pacientů a dle toho volba léčebných postupů. Součástí by mělo být zhodnocení závažnosti jaterní cirhózy (Child-Pugh skóre, MELD skóre). V praxi se používá nejen TNM klasifikace, ale i tzv. Barcelonská klasifikace.

Terapie – měla by se řídit Barcelonskou klasifikací.
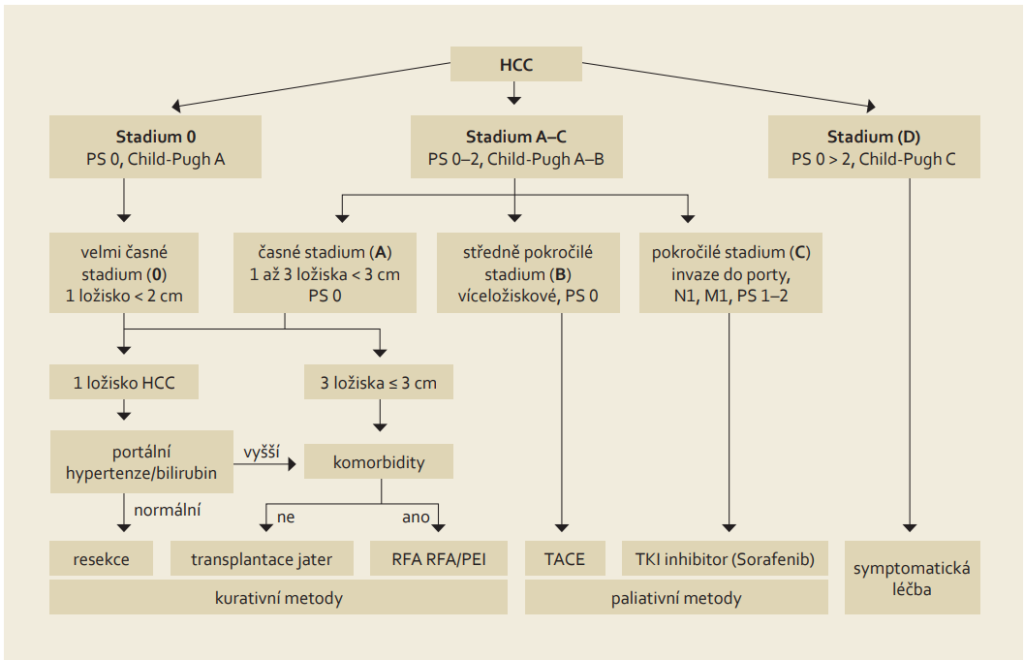
1. Chirurgická terapie – jediná známá potenciální kurativní léčebná metoda (u malých ložisek ještě i radiofrekvenční ablace) u pacientů s nádory ve stádiu A (tedy max. 3 nádory s maximálním průměrem 3 cm). Jedinými dvěma metodami je chirurgická resekce tumoru nebo transplantace jater:
- resekce je indikována u pacienta u kterých není indikována transplantace (současné selhávání cirhotických jater, bez portální hypertenze a s normálním bilirubinem), vždy je nutné dosažení čisté resekční linie.
- transplantace jater – indikována u HCC v terénu zároveň selhávajících jater (Child-Pugh > A, MELD > 15). existují určitá indikační kritéria:
- Milánská kritéria – transplantabilní jsou játra s izolovaným tumorem < 5 cm nebo max. 3 tumory z nichž největší je < 3 cm. Samozřejmostí je vyloučení lokální invaze nebo vzdálených metastáz, nicméně přístup musí být vždy vysoce individuální.
- UCSF kritéria (University of California San Francisco) – transplantabilní jsou pacienti s jedním uzlem < 6,5 cm nebo s maximálně třemi uzly z nichž největší do velikosti 4,5 cm a zároveň součet velikostí je < 8 cm, pochopitelně bez vaskulární invaze.
- „up to seven“ kritéria – velikost největšího uzlu + počet ložisek < 7 = pravděpodobnost pětiletého přežívání 70 %.
2. Radiologická terapie – radiofrekvenční ablace (RFA) je považována za nejlepší způsob léčby pacientů s HCC v časném stadiu, kdy pacienti nejsou kandidáty resekce nebo transplantace jater (např. pro významné komorbidity):
- jeden menší nádor, nebo až tři noduly, každý menší než 3 cm (…podobné Milánským kritériím).
- žádný průkaz invaze cév nebo extrahepatálního šíření.
- cirhózu jater stupně Child-Pugh A nebo B.
RFA lézí přilehlých k:
- jakékoli části gastrointestinálního traktu je kontraindikovaná vzhledem k riziku popálení stěny žaludku nebo střev (popálení stěny těchto orgánů, nebezpečí hrozí zejména u tlustého střeva).
- jaternímu hilu zvyšuje riziko tepelného poranění žlučovodů a žlučníku (relativní kontraindikace RFA).
- hepatálním cévám je možná, protože protékající krev obvykle chrání cévní stěnu před tepelným poraněním (chladí ji).
4–6 týdnů po RFA by mělo být provedeno kontrolní CT nebo MRI (poměrně obtížné může být rozlišení benigního sycení jako reakce na termální poškození od lokální recidivy nádoru), poté opakovat 3, 6, 9 a 12 měsíců po léčbě a následně á 6 měsíců po dobu následujících tří let.
3. Chemoembolizace – protože je HCC závislý na cévním zásobení z artérie, lze terapeuticky užít její uzávěr. Identifikace přívodné tepny se provádí angiograficky, lze rozlišit TAE (transarteriální embolizace), kdy se provádí pouze embolizace a TACE (transarteriální chemoembolizace), která je preferována a kdy kombinuje embolizace s podáním cytostatika (cisplatina nebo adriamycin) přímo do této tepny těsně před její embolizací (cytostatikum se rozpouští v Lipiodolu, který se vychytává přednostně v nádorové tkáni). TACE je indikována u HCC, který je neřešitelný chirurgicky nebo intervenčně, ale ještě se nešíří mimo játra (stádium B). Hlavními kontraindikacemi TACE je nedostatečný průtok portální žilou (trombóza v. portae nebo významné kolaterály) a pokročilá jaterní insuficience (Child-Pugh B a C). TACE působí nekrózu nádoru u > 50 % pacientů, kompletní remise je ale dosažena pouze u 2 % pacientů. Při recidivě nádoru lze TACE opakovat.
4. Systémová léčba – pro pacienty v pokročilejších stádiích (C nebo D) inoperabilního HCC a v dobrém celkovém stavu s cirhózou max Child-Pugh B.
- 1. linie léčby – možnosti:
- sorafenib – kinázový inhibitor, který prodlužuje přežití ve srovnání s placebem (medián přežití 10,6 vs 7,8 měsíce).
- lenvatinib – noninferiorní vůči sorafenibu.
- atezolizumab (anti-PD-L1 inhibitor) + bevacizumab (anti-VEGF) – superiorní ve srovnání se sorafenibem (medián přežití 19,2 vs 13,4 měsíce). Před podáním bevacizumabu by měla být provedena gastroskopie k vyloučení jícnových varixů (zvýšení rizika krvácení).
- 2. Linie léčby – při progresi onemocnění i přes terapii sorafenibem. Všechny následující látky prokazují prodloužení přežívání oproti ponechání na terapii sorafenibem.
- regorafenib – multikinázový inhibitor.
- cabozantib – multikinázový VEGF inhibitor.
- ramucirumab – monoklonální protilátka anti- VEGF 2.
5. Paliativní a symptomatická terapie – v podstatě se neliší od péče o pacienta s pokročilou
jaterní cirhózou bez HCC. Zásadní je péče o nutrici, koagulační parametry, pravidelná paracentéza ascitu, důsledné tlumení bolesti apod. Naprosto zásadní je individuální přístup dle prognózy i přání pacienta.
Prognóza – u symptomatického HCC je špatná (5 leté přežití 0 – 10 %), u asymptomatického HCC objeveného v rámci screeningu je výrazně lepší (5 leté přežití 50 %).
II. Cholangiokarcinom
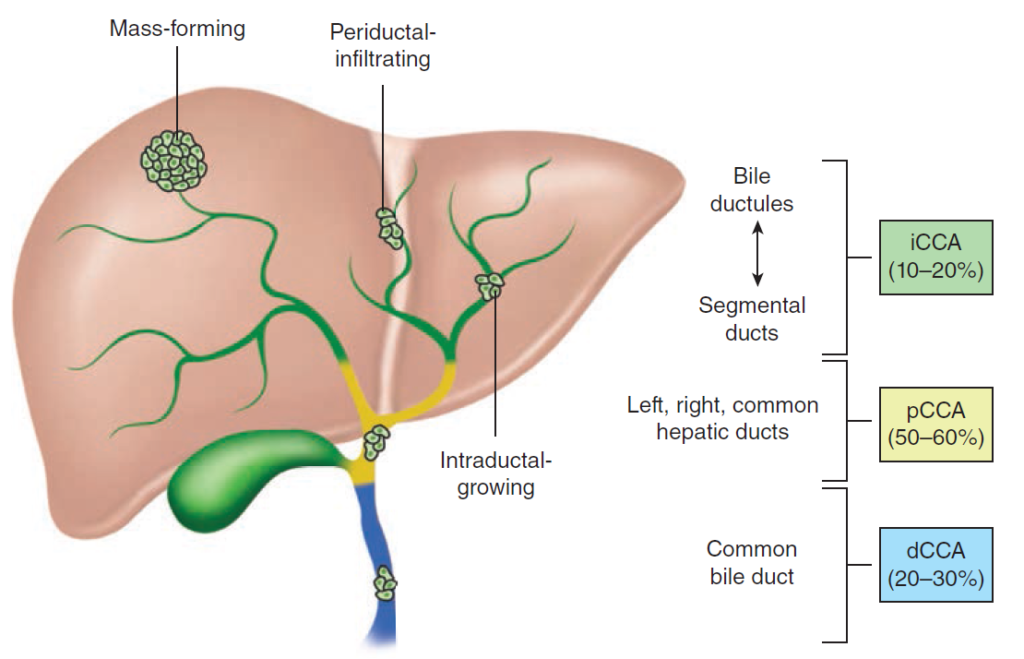
Klasifikace – cholangiokarcinomy (CCA) lze dle jejich anatomické lokalizace dělit na tři podtypy, které se liší i epidemiologií, rizikovými faktory a terapií:
- intrahepatický (iCCA, cca 25 % případů).
- extrahepatický (eCCA, 75 % případů), který se dále dělí na:
- perihilární (pCCA, 55 % případů).
- distální (dCCA, 20 % případů).
Epidemiologie – druhý nejčastější maligní nádor jater.
- incidence – ve vyspělých zemích (Evropa, Severní Amerika) poměrně vzácný – 1 : 50 – 100 tisíc ročně ovšem s rostoucí incidencí, v Jihovýchodní Asii (zejména Thajsku) až 1:1250 ročně (vzhledem k četnějšímu výskytu rizikových faktorů).
- mezi pohlavím je četnost téměř vyrovnaná – poměr muži/ženy = 1,2.
- věkově jde o chorobu starších lidí (u mužů 7. decenium, u žen 8. decenium).
Rizikové faktory – mezi klasické rizikové faktory patří:
- choroby žlučového stromu
- primární sklerozující cholangitida (PSC) – zde je celoživotní riziko vzniku CCA 5 – 10 %, proto je vhodný každoroční screening radiologickými metodami + CA 19-9.
- ostatní – cysty žlučovodů, hepatolitiáza, Caroliho choroba.
- infekce žlučového stromu motolicemi (nejčastěji Opisthorchis viverrini a Clonorchis sinensis) je nejčastější v Asii (lze tomu předcházet léčbou praziquantelem).
- rizikové faktory vzniku HCC (např. cirhóza) vedou ke zvýšení četnosti iCCA.
- konzumace slazených nápojů vede ke zvýšení četnosti eCCA.
I v případě CCA byla popsána řada genetických polymorfismů a mutací zvyšujících riziko jeho vzniku. Jejich popis ovšem přesahuje rozsah tohoto sdělení.
Prognóza – horší než u HCC, 5-leté přežití je pouze 10 %.
a) Intrahepatický cholangiokarcinom
Diagnostika – diagnóza iCCA vyžaduje histologické potvrzení. Diagnostika časných stádií CCA je velice obtížná, pokud není po iCCA cíleně pátráno (pacienti s PSC, pravidelné sono jater u cirhotiků), bývá objeven až na základě příznaků (únava, nechutenství, váhový úbytek, břišní dyskomfort nebo ikterus), kdy už bývá v pokročilých stádiích:
- CT nebo MRI nebývá dostatečné pro svoji nízkou specificitu (na CT je přítomna masa s progresivním vychytáváním kontrastu během přechodu z arteriální do venózní fáze, na MRI je periferní enhancement a také progresivní kontrastu po arteriální fázi). Výhodu má MRCP má výhodu ve zobrazení žlučovodů a vztahu nádoru k cévám. Před chirurgickým vyšetřením lze vyloučit metastatické postižení pomocí PET CT.
- Tumorový marker CA19-9 nemá v časných stádiích dostačenou senzitivitu a specifitu (cca 60 %), u 60 % bývá pozitivita i CA-125.
Staging iCCA
- T – primární nádor
- Tis karcinom in situ (intraduktální nádor)
- T1a solitární nádor do 5 cm včetně v největším rozměru bez cévní invaze
- T1b solitární nádor větší než 5 cm včetně v největším rozměru bez cévní invaze
- T2 solitární nádor s intrahepatální invazí do cév nebo vícečetné nádory, s nebo bez cévní invaze
- T3 nádor prorůstá na viscerální peritoneum
- T4 nádor postihující okolní extrahepatální struktury přímou invazí z jater
- N – regionální lymfatické uzliny
- N0 regionální mízní uzliny bez metastáz
- N1 metastázy v regionálních mízních uzlinách
- M – vzdálené metastázy
- M0 nejsou vzdálené metastázy
- M1 vzdálené metastázy
Stádia
- stádium IA – T1a, N0, M0 (nádor < 5 cm)
- stádium IB – T1b, N0 M0 (nádor > 5 cm)
- stadium II – T2, N0, M0 (nádor prorůstá do cév)
- stadium IIIA – T3,N0, M0 (nádor prorůstá na viscerální peritoneum)
- stadium IIIB – T4 N0 M0 (nádor prorůstá do okolních struktur)
- stadium IVA – jakékoliv T, N1, M0 (jakékoliv metastázy do lymfatických uzlin)
- stadium IVB – jakékoliv T, jakékoliv N, M1 (jakékoliv vzdálené metastázy)
Terapie
Stádium I a II – jedinou kurativní metodou je chirurgická resekce, která je proveditelná u cca třetiny pacientů (medián přežití je 51 měsíců). K chirurgické resekci jsou optimální pacienti s vyloučením vaskulární invaze a metastáz do lymfatických uzlin i vzdálených metastáz. Součástí resekce by mělo být odstranění spádových lymfatických uzlin. U všech pacientů by měla následovat 6 měsíční adjuvantní chemoterapie capecitabinem. Jaterní transplantace zůstává kontroverzní a některé malé studie prokázaly dobré výsledky u malých iCCA (< 2 cm).
Stádium III – pacienti, kteří jsou chirurgicky neřešitelní mají velice špatnou prognózu. Lze zvážit chemoembolizaci nebo radioembolizaci tumoru. Metaanalýza 14 studií zabývajících se výsledky této lokální terapie popsala průměrné přežití 15 měsíců. Externí ozáření není doporučeno.
Stádium IV – při dobrém celkovém stavu pacienta je doporučena systémová chemoterapie cisplatiny s gemcitabinem, při selhání FOLFOX – leukovorin (kyselina FOLinová), Fluorouracil, OXaliplatina. V USA byli ještě schváleny ivosidenib (IDH1 inhibitor) a pemigatinib (FGFR2 inhibitor).
Prognóza – i přes zachycen í CCA v chirurgicky řešitelných stádiích bývá 5 leté přežití 20 – 40 %, u chirurgicky neřešitelných nádorů je prognóza velice špatná.
b) Extrahepatický cholangiokarcinom
CAVE Každá primární biliární cholangitida s CA 19-9 > 129 kU/l budí podezření na přítomnost CCA.
1. krok – CT i MRI mají dobrou výpovědní hodnotu při diagnostice závažnosti postižení žlučovodu a invaze do portální žíly nebo jaterních žil. K došetření závažnosti postižení žlučovodu slouží MRCP.
Důležité je vyloučení IgG4 asociované cholangiopatie pomocí hladiny IgG4.
2. krok – ERCP s brushing cytologií.
Dle místa vzniku lze eCCA rozdělit na:
- perihilární (pCCA) – vzniká z epitelu žlučových cest všude mezi žlučovody II. řádu a místem napojení ductus cysticus. Projevuje se bezbolestným ikterem (90 % případů) nebo akutní cholangitidou (10 % případů).
- distální (dCCA) – vzniká všude mezi místem napojení ductus cysticus a Vaterskou papilou (často je velice obtížné odlišit dCCA od časného stádia karcinomu pankreatu).
I. pCCA
- T – primární nádor
- Tis karcinom in situ
- T1 nádor je omezen na žlučovod, se šířením až do svalové vrstvy nebo vaziva
- T2a nádor přestupuje stěnu žlučovodu do okolní tukové tkáně
- T2b nádor postihuje přilehlý jaterní parenchym
- T3 nádor postihuje jednostranné větve v. portae nebo a. hepatica
- T4 nádor postihuje kmen v. portae nebo její větve oboustranně; nebo a. hepatica communis; nebo žlučovody druhého řádu (segmentální) oboustranně; nebo žlučovody druhého řádu (segmentální) jednostranně s druhostranným postižením v. portae či a. hepatica.
- N – regionální mízní uzliny (mízní uzliny hilové a okolo choledochu v ligamentum hepatoduodenale)
- N0 regionální mízní uzliny bez metastáz
- N1 metastázy v 1-3 regionálních mízních uzlinách
- N2 metastázy ve více jak 4 regionálních mízních uzlinách
- M – vzdálené metastázy
- M0 nejsou vzdálené metastázy
- M1 jsou přítomny vzdálené metastázy
Stádia
- Stadium 0 – Tis,N0, M0
- Stadium I – T1, N0, M0
- Stadium II – T2a + b, N0, M0
- Stadium IIIA – T3, N0, M0
- Stadium IIIB – T4, N0, M0
- Stadium IIIC – jakékoliv T, N1, M0
- Stadium IVA – jakékoliv T, N2, M0
- Stadium IVB – jakékoliv T, jakékoliv N, M1
II. dCCA
Staging
- T – primární nádor
- Tis karcinom in situ (intraduktální nádor)
- T1 nádor postihuje stěnu žlučovodu do hloubky < 5 mm
- T2 nádor postihuje stěnu žlučovodu do hloubky 5 až 12 mm
- T3 nádor postihuje stěnu žlučovodu do hloubky >12 mm
- T4 nádor postihuje truncus coeliacus, a. mesenterica superior a/nebo arteria hepatica communis
- N – regionální mízní uzliny (podél ductus choledochus, a. hepatica communis dorsálně směrem k truncus coeliacus, uzliny zadní a přední pankreatikoduodenální a uzliny podél v. mesenterica superior – musí být analyzováno 12 a více uzlin)
- N0 regionální mízní uzliny bez metastáz
- N1 metastázy v 1-3 regionálních mízních uzlinách
- N2 metastázy ve více jak 4 regionálních mízních uzlinách
- M – vzdálené metastázy
- M0 nejsou vzdálené metastázy
- M1 vzdálené metastázy
Stádia
- Stadium 0 – Tis, N0, M0 (karcinom in situ)
- Stadium I – T1, N0, M0 (malý nádor do 5 mm)
- Stadium IIA – T1, N1, M0 nebo T2, N0, M0 (malý nádor s postižením 1 – 3 regionálních uzlin nebo středně velký nádor)
- Stadium IIB – T2, N1, M0 nebo T3, N0/N1, M0
- Stadium IIIA – T1/T2/T3, N2, M0 (jakýkoliv nádor s postižením > 4 regionálních uzlin)
- Stadium IIIB – T4, jakékoliv N, M0 (nádor infiltrující cévní svazky)
- Stadium IV – jakékoliv T, jakékoliv N, M1 (nádor se vzdálenými metastázami)
Terapie pCCA + dCCA
- Lokalizované onemocnění – kompletní chirurgické odstranění tumoru dle lokalizace a rozsahu tumoru (tumory v oblasti hilu s en-bloc resekcí jater, tumory distálního choledochu včetně duodenopankreatektomie, doporučena je lymfadenektomie v oblasti porta hepatis) +
- u T1+T2 observace.
- u T3 + T4 a N1 adjuvantní chemoradioterapie – FUFA (5-fluorouracyl + leukovorin) nebo cisplatina + gemcitabin nebo monoterapie gemcitabin nebo capecitabin.
- v některých centrech při izolovaném tumoru < 3 cm transplantace jater + adjuvantní chemoradioterapie.
- Neresekabilní onemocnění (extenzivní prorůstání do okolí, postižením uzlin za porta hepatis, vzdálené metastázy). Cílem je prodloužení přežití a zejména ulevení od obtíží:
- při obstrukci žlučových cest zajištění derivace žluči (ERCP zavedení stentu do
žlučových cest, PTD drén, chirurgický bypass). - paliativní chemoterapie – gemcitabin nebo FUFA, při selhání FOLFOX.
- paliativní chemoradioterapie (gemcitabin nebo FUFA + event. brachyterapie).
- symptomatická léčba.
- vždy zvážit možnost zařazení pacienta do klinické studie.
- při obstrukci žlučových cest zajištění derivace žluči (ERCP zavedení stentu do
IIa. Nádor Vaterské papily
Podtyp dCCA.
Staging
- T – primární nádor
- Tis karcinom in situ
- T1a nádor omezen na Vaterskou papilu nebo Oddiho svěrač
- T1b nádor postihuje oblast za Oddiho svěračem (perisphinkterická invaze) a/nebo oblast duodenální submukózy
- T2 nádor postihuje muscularis propria duodena
- T3 nádor postihuje pankreas
- T3a nádor zasahuje 0,5 cm nebo méně do pankreatu
- T3b nádor zasahuje více než 0,5 cm do pankreatu nebo se rozšiřuje do peripankreatické tkáně nebo duodenální serózy, bez postižení truncus coeliacus nebo a. mesenterica superior
- T4 nádor s vaskulárním postižením a mesenterica superior, truncus coeliacus nebo společné jaterní tepny
- N – regionální mízní uzliny (regionální mízní uzliny stejné jako pro karcinomy hlavy pankreatu , tedy mízní uzliny podél společného žlučovodu, společné jaterní tepny, portální žíly, pylorické , infrapylorické ,subpylorické, proximální mesenterické, celiakální, zadních a předníchpankreatikoduodenálních cév, horní mesenterické žíly a pravé boční stěny mesenterické tepny.
- N0 regionální mízní uzliny bez metastáz
- N1 metastázy v 1-3 regionálních mízních uzlinách
- N2 metastázy ve více jak 4 regionálních mízních uzlinách
- M – vzdálené metastázy
- M0 nejsou vzdálené metastázy
- M1 vzdálené metastázy
Stádia
- Stadium 0 – Tis, N0, M0
- Stadium IA – T1a, N0, M0
- Stadium IB – T1b/T2, N0, M0
- Stadium IIA – T3a, N0, M0
- Stadium IIB – T3b, N0, M0
- Stadium IIIA – T1a/T1b/T2/T3, N1, M0
- Stadium IIIB – jakékoliv T, N2, M0 nebo T4, jakékoliv N, M0
- Stadium IV – jakékoliv T, jakékoliv N, M1
Terapie nádoru Vaterské papily
- Lokalizované onemocnění – kompletní chirurgické odstranění tumoru dle lokalizace a rozsahu tumoru (tumory v oblasti hilu s en-bloc resekcí jater, tumory distálního choledochu včetně duodenopankreatektomie, doporučena je lymfadenektomie v oblasti porta hepatis) +
- u T1+T2 observace.
- u T3 + T4 a N1 adjuvantní chemoradioterapie – FUFA (5-fluorouracyl + leukovorin) nebo gemcitabin.
- v některých centrech při izolovaném tumoru < 3 cm transplantace jater + adjuvantní chemoradioterapie.
- Neresekabilní onemocnění (extenzivní prorůstání do okolí, postižením uzlin za porta hepatis, vzdálené metastázy). Cílem je prodloužení přežití a zejména ulevení od obtíží:
- při obstrukci žlučových cest zajištění derivace žluči (ERCP zavedení stentu do
žlučových cest, PTD drén, chirurgický bypass). - paliativní chemoterapie (gemcitabin nebo FUFA).
- paliativní chemoradioterapie (gemcitabin nebo FUFA + event. brachyterapie).
- symptomatická léčba.
- vždy zvážit možnost zařazení pacienta do klinické studie.
- při obstrukci žlučových cest zajištění derivace žluči (ERCP zavedení stentu do
IIb. Nádor žlučníku
Epidemiologie – nejčastější nádor žlučových cest (2020 odhaleno téměř 12 tisíc případů). Ženy jsou postiženy 3x častěji než muži.
Rizikové faktory
- zejména cholelitiáza (ale nádor žlučníku postihuje < 1 % pacientů s cholelitiázou).
- polypy žlučníku > 1 cm.
Klinický obraz – časná stádia jsou asymptomatická a bývají odhalena náhodně při cholecystektomii. Pokud se již vyskytují příznaky (bolest, ikterus, váhový úbytek), jde již o pokročilou formu choroby.
Diagnostika – nejpřesnější metodou je MRCP, při došetření diseminace lze využít i CT nebo PET CT.
Staging
- T – primární nádor
- Tis karcinom in situ
- T1a nádor postihuje lamina propria mucosae
- T1b nádor postihuje tunica muscularis
- T2a nádor postihuje perimuskulární pojivovou tkáň, není šíření na serózu nebo do jater
- T2b nádor postihuje perimuskulární pojivovou tkáň bez šíření na serózu
- T3 nádor prorůstá na serózu (viscerální peritoneum) a/nebo přímo postihuje játra a/nebo kterýkoliv jiný orgán či strukturu, např. žaludek, duodenum, tlusté střevo, pankreas, omentum, mimojaterní žlučové cesty
- T4 nádor postihuje kmen v.portae či a.hepatica nebo postihuje dva nebo více mimojaterních orgánů či struktur
- N – regionální mízní uzliny (uzliny v hilu jater (včetně uzlin podél ductus choledochus, a.hepatica communis, v. portae a ductus cysticus), uzliny podél truncus coeliacus a uzliny podél a. mesenterica superior).
- N0 regionální mízní uzliny bez metastáz
- N1 metastázy v 1-3 regionálních mízních uzlinách
- N2 metastázy ve 4 a více regionálních mízních uzlinách
- M – vzdálené metastázy
- M0 nejsou vzdálené metastázy
- M1 vzdálené metastázy
Stádia
- Stadium 0 – Tis, N0 M0
- Stadium IA – T1a, N0, M0
- Stadium IB – T1b, N0, M0
- Stadium IIA – T2a, N0, M0
- Stadium IIB – T2b, N0, M0
- Stadium IIIA – T3, N0, M0
- Stadium IIIB – T1/T2/T3, N1, M0
- Stadium IVA – T4, N0/N1, M0
- Stadium IVB – jakékoliv T, N2, M0 nebo jakékoliv T, jakékoliv N, M1
Terapie – při náhodném nálezu karcinomu ve stádiu 0 nebo IA je cholecystektomie považována za léčebnou metodu, u lokálně/regionálně pokročilejších a operabilních nádorů (T1-T3, NX, M0) je radikální chirurgická resekce s negativními resekčními liniemi jedinou možnou kurativní léčbou. Od stádia T2 je indikována adjuvantní onkologická léčba (5-FU následovaná FUFA + radioterapie) o délce 6 měsíců.
U neoperovatelných nádorů je indikována paliativní chemoterapie:
- preferována je cisplatina + gemcitabin, variantou je
- FUFA nebo
- gemcitabin v monoterapii nebo
- paliativní chemoradioterapie s konkomitantním podáním 5-FU.
- samozřejmostí je symptomatická léčba a vždy zvážit možnost zařazení pacienta do klinické studie.
Prognóza – 5 leté přežití u stádia I je 80 – 90 %, u stádia II 60 – 90 %, u stádia IV je průměrné přežití 10 – 12 měsíců.
III. Hepatoblastom
Nejčastější primární nádor jater u dětí (incidence 1:650 tisíc/rok). Etiologie není zcela jasná, hlavní roli hraje WNT signální dráha (nejčastěji mutace CTNNB1). Léčbou je radikální resekce s adjuvantní chemoterapií doxorubicinem.
CAVE Na rozdíl od HCC čím vyšší hladina AFP, tím lepší prognóza!!!
Prognóza – 5 leté přežití 90 % u pacientů < 3 roky s malým tumorem (stádium I – II) a AFP > 100 ng/ml. Naopak, u pacientů se vzdálenými metastázami a AFP < 100 ng/ml je pouze 20 – 30 %.
Pěkná prezentace zde: https://www.fnbrno.cz/data/files/1203.pdf
Benigní nádory jater
Většina benigních nádorů jater je identifikováno náhodně při ultrazvuku jater. Nejčastější:
Hemangiom – vyskytují se u cca 5 % běžné populace a většinou bývají odhalené náhodně. Ve většině případů je indikován konzervativní postup a sledování nebývá nutné, resekce je indikována pouze u symptomatických a rostoucích nádorů, které by mohly komprimovat okolní orgány.
Fokální nodulární hyperplázie – vyskytují se u < 2 % běžné populace, nejčastěji u žen ve věku 40 – 50 let. Je důsledkem polyklonální proliferace hepatocytů díky arteriální malformaci. Nejcitlivější diagnostickou metodou je MRI s nálezem nádoru s homogenním sycením v arteriální fází spolu s centrální jizvou, při atypickém MRI obraze je indikována biopsie. Ve většině případů postačuje konzervativní postup a sledování nebývá nutné, resekce je zcela výjimečně indikována pouze u symptomatických a rostoucích nádorů, které by mohly komprimovat okolní orgány.
Jaterní adenom – benigní klonální proliferace hepatocytů s prevalencí 1:100 tisíc, 10x častěji u žen a nejvíce ve věku 35 – 40 let. U žen je nejvýraznějším rizikový faktorem hormonální antikoncepce, u mužů užívání anabolických steroidů. Jaterní adenomy mají určité riziko maligního zvratu, zejména pokud mají velikost > 5 cm. Nejcitlivější diagnostickou metodou je MRI. Při průkazu jaterního adenomu je nutné přestat užívat antikoncepci nebo anabolika a zredukovat hmotnost. Resekce je indikována u všech adenomů > 5 cm a při průkazu CTNNB-1 mutace. Častá je přítomnost více adenomů a dle doporučených postupů o způsobu léčby rozhoduje velikost největšího z nich.