Úvod
Pankreas denně produkuje 1500 ml izoosmotické a alkalické (pH ˃ 8) tekutiny obsahující cca dvacet enzymů a bikarbonát, který je zásadní k poskytnutí alkalického prostředí, optimálního pro jejich funkci. Exokrinní funkce pankreatu je regulována několika faktory:
- sekretin – jeho uvolnění stimuluje příchod kyselého žaludečního obsahu do duodena, kde je produkován S buňkam, váže se na na bazolaterální povrch a zvyšuje hladinu cAMP s následným otevřením CFTR (cystic fibrosis transmembrane conductance regulator) na apikální straně membrány, efluxem Cl–, který následuje bikarbonát cestou Na+/HCO3– kotransportéru a zvyšuje i sekreci iontů a vody.
- cholecystokinin – výrazně stimuluje produkci sekretinu. Jeho uvolnění (ze sliznice duodena a proximální části jejuna) stimuluje žaludeční kyselina, LCFA (mastné kyseliny s dlouhým řetězce) a některé aminokyseliny (tryptofan, fenylalanin, valin, metionin).
- parasympatikus (nervus vagus) stimulují sekreci sekretinu, cholecystokininu a VIP (vazoaktivní intestinální polypeptid, který také stimuluje žaludeční sekreci).
- pankreatickou sekreci inhibují somatostatin, pankreatický polypeptid, peptid YY, neuropetid Y, enkefalin, pankreastatin, calacitonin gene-related peptide, glukagon a galanin.
Sekrece vody a elektrolytů
Hlavní funkcí bikarbonátu je alkalizace žaludeční tekutiny a neutralizace žaludeční kyseliny. Bikarbonát uvolněný do pankreatické tekutiny pochází z 93 % z plazmy a ze 7 % z vlastní sekrece buněk pankreatu. Vstupuje do lumen pankreatických vývodů pomocí Na+/HCO3– kotransportéru s depolarizací způsobenou efluxem Cl– pomocí CFTR (cystic fibrosis transmembrane conductance regulator).
Sekrece enzymů
Enzymy jsou nejdříve syntetizovány v acinárních buňkách (hrubé endoplazmatické retikulum, Golgiho aparát) a poté směřovány do svého cílového místa pomocí zymogenních granul (putují apikálně a zde očekávají příslušný stimulus), lyzozomů resp. jiných organel.
Všechny pankreatické enzymy mají své pH optimum v alkalické oblasti. Sekrece je iniciována parasympatikem pomocí nervus vagus. Neurotransmitery jsou acetylcholin a GRP (gastrin-releasing peptides), které aktivují Ca2+ dependentní systém druhých poslů s následným uvolněním zymogenů do pankreatických vývodů (aktivitu parasympatiku stimuluje cholecystokinini a VIP). Pankreas produkuje následující typy enzymů:
- 1. Amylolytické enzymy
- amyláza – štěpí škroby na oligosacharidy a maltózu
- 2. Lipolytické enzymy
- lipáza – žlučové kyseliny ji deaktivují (tomu brání kolipáza, která se váže na lipázu a brání žlučovým kyselinám v její inhibici).
- fosfolipáza A2, cholesterol esteráza – žlučové kyseliny je aktivují.
- 3. Proteolytické enzymy – uvolňovány jako neaktivní zymogen. Patří sem endopeptidázy (trypsin, chymotrypsin) štěpící interní peptidové vazby, exopeptidázy (karboxypeptidázy, aminopeptidázy) štěpící peptidy od C- nebo N-konce a elastáza. Dále jsou produkovány ribonukleázy a deoxyribonukleázy.
- trypsin – endopeptidáza, která je uvolňována jako zymogen trypsinogen. Enterokináza (enzym produkovaný sliznicí duodena) štěpí vazbu lyzin-izoleucin a trypsinogenu a aktivuje jej tak na trypsin, který pak kaskádově aktivuje ostatní pankreatické zymogeny a fosfolipázu A2.
Enteropankreatická osa
Enzymová sekrece je regulována i zpětnou vazbou přítomností serinových proteáz v duodenu:
- přítomnost fenylalaninu v lumen duodena (stimulace časného trávení) vede ke zvýšení hladiny chymotrypsinu a ostatních pankreatických enzymů.
- přítomnost trypsinu v lumen duodena (stimulace pozdního trávení) toto vše tlumí.
- přítomnost proteázových inhibitorů v duodenu vede k hypersekreci pankreatických enzymů.
- v duodenu se vyskytuje peptid CCK-RF (cholecystokinin-releasing factor), který stimuluje uvolnění cholecystokininu a pankreatickou sekreci. Serinové proteázy CCK-RF štěpí a tak tuto sekreci tlumí, tyto proteázy jsou naopak vyvazovány dietními proteiny, které tím nepřímo zvyšují pankreatickou sekreci.
- acidifikace duodena vede k uvolnění sekretinu, který stimuluje parasympatikus s uvolněním bikarbonátu, který poté kyselý obsah neutralizuje.
Autoprotekce pankreatu
Pankreas je před autodigescí chráněn následujícími mechanismy:
- Tvorbou zymogenu s jejich aktivací až intrapankreaticky.
- Intracelulární homeostáza Ca2+ (nízká koncentrace v cytoplasmě acinárních buněk může způsobit spontánní aktivaci trypsinogenu s destrukcí parenchymu).
- Acidobazická rovnováha
- Syntéza proteázových inhibitorů PSTI (pancreatic secretory trypsin inhibitor) a SPINK1 (oba mohou inaktivovat až 20 % intracelulárně aktivovaného trypsinu) a chymotrypsin C. Jejich aktivitu lze prokázat v acinárních buňkách, pankreatické tekutině a α1- a α2- globulinové frakci plazmy a její ztráta vede k autodigesci a akutní pankreatitidě.
Akutní pankreatitida
Epidemiologie – incidence 1: 4-20 tisíc/rok (mezi lety 2000 a 2009 narostla o 30 %), mortalita 1 %, průměrná délka hospitalizace 4 dny.
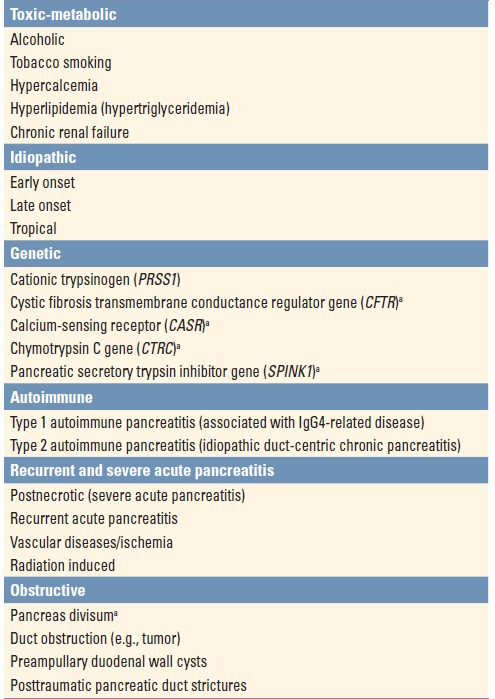
Etiologie
- žlučové kameny (příčina 30 – 60 % případů akutní pankreatitidy) – u pacientů s nejméně jedním žlučovým kamenem ˂ 5 mm je 4x vyšší riziko než u pacientů s většími konkrementy.
- alkohol (15 – 30 % případů) – incidence pankreatitidy u alkoholiků je v USA překvapivě nízký (1:25000), jsou tedy pravděpodobně potřeba ještě další vyvolávající faktory.
- po ERCP – akutní pankreatitida vzniká u 5 – 10 % pacientů po ERCP. Riziko snižuje profylaktická implantace stentu do ductus pancreaticus a premedikace indomethacinem, rizikovými faktory jsou nedostatečná papilární sfinkterotomie, dysfunkce Oddiho svěrače, anamnéza předchozí post-ERCP pankreatitidy, věk ˂ 60 let, ˃ 2 injekce kontrastu do do pankreatického duktu a nedostatečná erudice personálu.
- hypertriglyceridémie (1,3 – 3,8 % případů) – sérová koncentrace triacylglycerolů je většinou ˃ 11 mmol/l, která bývá způsobena poruchou lipidového metabolismu. U těchto pacientů akutní pankreatitida často recidivuje. Jakýkoliv inzult nebo choroba, které mají za následek vzestup triglyceridů mohou způsobit i akutní pankreatitidu (léky, orální antikoncepce, alkohol, diabetes mellitus s ketoacidózou). Výrazným predisponujícím faktorem je deficit apo-CII , který aktivuje lipoproteinovou lipázu, důležitou při odstranění chylomikronů z krve.
- léky (0,1 – 1,2 % případů).
Patogeneze – od samého začátku lze rozlišit dvě formy akutní pankreatitidy:
- intersticiální se zachovalou perfúzí a většinou spontánní úpravou.
- nekrotizující s porušenou perfúzí, u které rozsah nekróz koreluje se závažností stavu.
Obecně platnou patogenetickou teorií je autodigesce, při které je pankreatitida spuštěna intrapankreatickou aktivací zymogenů (např. trypsinogen, chymotrypsinogen, proelastáza, fosfolipáza A2) z řady možných důvodů (např. endotoxiny, exotoxiny, virové infekce, ischemie, oxidační stres, lyzozomální kalcium, přímé trauma). Tyto aktivované enzymy (zejména trypsin) nejenom tráví pankreas, ale zároveň aktivují i ostatní enzymy, např. elastázu a fosfolipázu A2 a může dojít i ke spontánní aktivaci trypsinu.
Pankreatitida probíhá ve třech fázích:
I. fáze – intrapankreatická aktivace trávicích enzymů s poškozením acinárních buněk. Lysozomální hydrolázy (např. katepsin B), které se také nachází uvnitř acinárních buněk aktivují trypsin.
II. fáze – aktivace, chemoatrakce a sekvestrace leukocytů a makrofágů v pankreatu s následnou zánětlivou reakcí uvnitř pankreatu, navíc neutrofily mohou dále aktivovat trypsin (aktivace trypsinu tak může být dvoufázová, časná, nezávislá na neutrofilech a pozdní, na neutrofilech závislá).
III. fáze – poškození buněčné membrány aktivovanými proteolytickými enzymy a cytokiny s následnou proteolýzou, edémem, intersticiálním krvácením, poškozením cév, koagulační nekrózou a nekrózou tuku a parenchymu. Buněčná smrt vede k uvolnění bradykininu, vazoaktivních substancí a histaminu s následnou vazodilatací a otokem řady orgánů. Následkem této kaskády může být SIRS, ARDS a MODS.
Náchylnost k pankreatitidě i její průběh může ovlivnit řada genetických faktorů (většinou ovlivňující aktivaci trypsinu) – PRSS1 (cationic trypsinogen gene), SPINK1 (pancreatic secretory trypsin inhibitor), CFTR (cystic fibrosis transmembrane conductance regulator gene), CTRC (chymotrypsin C gene), CASR (calcium-sensing receptor)
Diagnostika
Diagnóza akutní pankreatitidy je dána přítomností dvou ze tří následujících kritérií:
- Typické bolesti v epigastriu, které mohou vyzařovat do zad.
- Zvýšení hladiny amyláz nebo lipáz ˃ 3 x ULN (nad horní limit normy).
- Potvrzení morfologických změn radiologickými metodami (nejčastěji CT).
1. Anamnéza – hlavním příznakem je bolest břicha, která může být vnímána od mírného dyskomfortu po zničující bolest. Nejčastěji je stálá a vzniká v oblasti epigastria a periumbilikálně a může vyzařovat do zad, boku, hrudníku a spodní části břicha. Častým příznakem je i nauzea, zvracení a distenze břicha při hypomotilitě žaludku a střeva.
2. Fyzikální vyšetření – pacient bývá úzkostný a rozrušený, častá je tachykardie, hypotenze a mírná horečka. Poměrně častým nálezem může být i šok při:
- hypovolemii při transudaci plazmy a krve do retoperitonea
- zvýšené produkci kininů s následnou vazodilatací
- systémovém účinku proteáz a lipáz
Dalším nálezem může být:
- vzácně ikterus díky otoku hlavy pankreatu s obstrukcí ductus choledochus.
- raritně erytematózní kožní uzly při nekróze podkožního tuku.
- u 10 – 20 % pacientů lze prokázat i změny na plicích charakteru bazálních chrůpek, atelaktáz a pleurálních výpotků (nejčastěji na levé straně).
- tuhost břišní stěny může být různé intenzity, ale bývá většinou méně vyjádřena než bolest.
- peristaltika je oslabená nebo zcela vymizelá. Pankreas, který je zvětšený kvůli pseudocystě může být v pozdějším období (např. 4 – 6 týdnů) hmatný v oblasti epigastria.
Specifickými nálezy jsou:
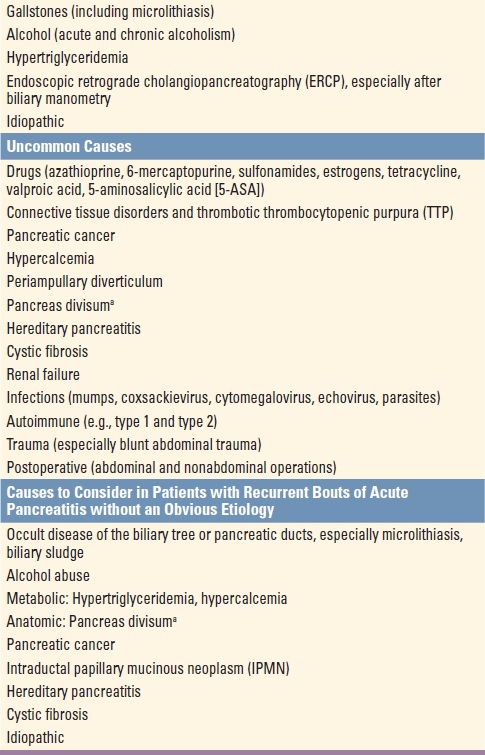
- Cullenovo znamení – modré zbarvení v okolí pupku (hemoperitoneum).
- Turnerovo znamení – modro-červeno-fialové nebo zeleno-hnědé zabarvení boku při těžké nekrotizující pankreatitidě s krvácením.
3. Laboratorní testy
Amylázy a lipázy – zvýšení sérové hladiny amyláz a lipáz ˃ 3x ULN je velmi sugestivní pro akutní pankreatitidu (při současném vyloučení perforace ischemie a infarktu střeva). Preferovaným testem je hladina lipázy v séru, která je specifičtější. Po 3 – 7 dnech začínají hodnoty amyláz i přes pokračující pankreatitidu klesat, zatímco pankreatický izoenzym amylázy a lipáza mohou zůstat zvýšené i po 7 – 14 dnech.
CAVE Mezi hladinou sérové amylázy a lipázy a závažností pankreratitidy není korelace.
CAVE Zvýšení amyláz v séru a moči mohou být zvýšené z řady příčin (např. acidóza, viz kap. 347).
Leukocytóza – častým nálezem je leukocytóza, která vzniká díky zánětu, a hemokoncentraci. Hemokoncentrace při sekvestraci plazmy do peritonea a retroperitonea bývá známkou závažné formy choroby (současné zvýšení urey a hematokritu). Zvýšená urea je nezávislý rizikový faktor mortality.
Hyperglykémie – běžný nález, který má multifaktoriální příčinu (snížené uvolnění inzulínu, zvýšená sekrece glukagonu z pankreatu a glukokortikoidů a katecholaminů z nadledvin).
Hypokalcémie – vyskytuje se u cca 25 % pacientů s neúplně pochopenou patogenezí. Dříve se předpokládalo zapojení příštítných tělísek, nyní se předpokládá saponifikace velkého množství kalcia (˃ 6 gramů) mastnými kyselinami intraperitoneálně nebo v nekrotickém tuku.
Hypoxie – pokles pO2 ˂ 8 kPa vzniká u 5 – 10 % pacientů se závažnou formou choroby a může znamenat vznik ARDS.
Ostatní
- přechodná hyperbilirubinémie (˃ 68 mmol/l) a zvýšení AST a ALP se vyskytují u ≈ 10 % pacientů a většinou se vrací do normálu během 4 – 7 dnů.
- hypertriglyceridémie se vyskytuje u 5 – 10 % pacientů (u těchto jedinců bývá častým nálezem falešně negativní hladina amyláz v séru).
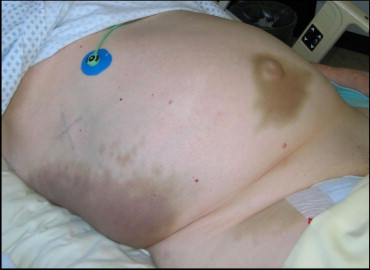
2. EKG – běžné jsou abnormality ST segmentu a T vln, které imitují ischémii myokardu.
3. CT pankreatu – morfologický akutní pankreatitidu definují revidovaná Atlantská kritéria (viz níže).
CAVE CT vyšetření pankreatu během prvních 48 hodin trvání akutní pankreatitidy není indikováno většinou.
Revidovaná Atlantská kritéria definují fáze, závažnost a CT morfologii akutní pankreatitidy:
1. Fáze akutní pankreatitidy – byly definovány dvě fáze akutní pankreatitidy:
- a) časná fáze (˂ 2 týdny), kdy je spíše důležitější klinický stav pacienta, než morfologické změny pankreatu. U většiny pacientů lze prokázat SIRS a je predispozice k orgánovému selhání (zejména respirační, kardiovaskulární a renální), selhání dvou a více systémů se označuje jako multiorgánové selhání. Perzistentní orgánové selhání delší než 2 dny odpovídá závažné formě pankreatitidy.
- b) pozdní fáze (˃ 2 týdny), která je charakteristická protrahovaným průběhem s nutností opakovaných CT kontrol k vyloučení lokálních komplikací (zejména vznik nekróz). Důležitým faktorem je přetrvávání orgánového selhání (často nutná umělá plicní ventilace, hemodialýza a umělá výživa).
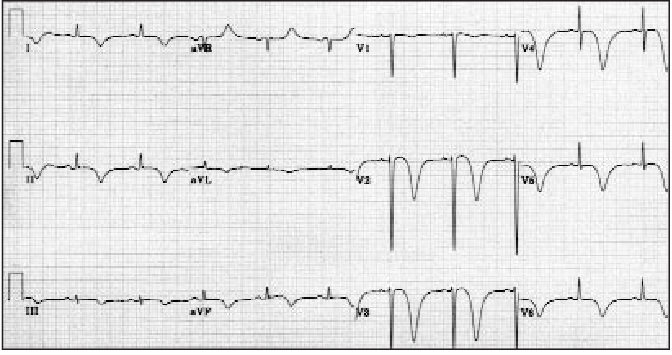
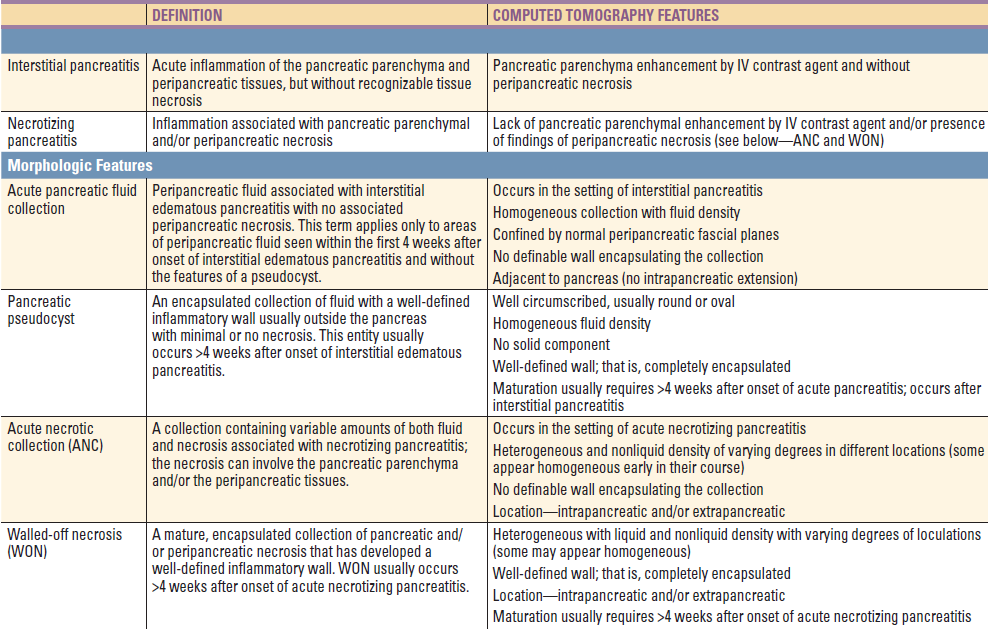
Vývoj akutní pankreatitidy. Vlevo (po přijetí) – abnormální enhancement žlázy (šipka) naznačující intersticiální pankreatitidu. Uprostřed (po 6 dnech) – okrsky nekrózy (šipky), které se nesytí. Vpravo (po 2 měsících) – tekutinová kolekce při walled-off nekróze).
2. Závažnost akutní pankreatitidy – lze rozlišit následující tři stupně závažnosti akutní pankreatitidy:
a) Lehká akutní pankreatitida, kdy nedochází k lokálním komplikacím ani orgánovému selhání (většina pacientů s akutní intersticiální pankreatitidou). Choroba většinou ustupuje po 3 – 7 dnech léčby. V úvodu je vhodné zastavit per os příjem, který lze následně obnovit, pokud je pacient hladový, je přítomna peristaltika a ustoupila nauzea a zvracení. V úvodu rekonvalescence je vhodná netučná dieta.
b) Středně závažná pankreatitida, při které může dojít k orgánovému selhání (netrvá ale déle než 2 dny) nebo lokálním nebo systémovým komplikacím bez orgánového selhání (nekróza nebo tekutinová kolekce). Hospitalizace většinou trvá déle než 1 týden.
c) Těžká akutní pankreatitida, je charakterizovaná perzistencí selhání jednoho nebo více orgánů (˃ 2 dny). CT nebo MRI by mělo být provedeno k posouzení přítomnosti nekrózy a/nebo jiných komplikací. Další postup je dán celkovým stavem, přítomností komplikací, infekce a stabilitou pacienta.
CAVE Profylaktické podání antibiotik není doporučeno.
3. Zobrazovací metody u akutní pankreatitidy – na základě přítomnosti perfúze pankreatu lze rozeznat intersticiální a nekrotickou formu akutní pankreatitidy. Pokud se stav pacienta ani po 3 – 5 dnech podpůrné léčby nelepší, je vhodné provedení CT pankreatu k vyloučení lokálních komplikací. Na druhou stranu, recentní studie u akutní pankreatitidy potvrdily nadužívání CT vyšetření. Kritéria rozlišují následující typy:
1. Intersticiální pankreatitida – přítomna u 90 – 95 % pacientů přijatých pro akutní pankreatitidu. Na CT lze nalézt difúzně zvětšenou žlázu s homogenním enhancement a mírnými peripankreatickými zánětlivými změnami. Symptomy většinou odezní do týdne od vzniku choroby.

Akutní intersticiální pankreatitida (šipky označují edém).
2. Nekrotizující pankreatitida – přítomna u 5 – 10 % pacientů. Typickým nálezem je chybění kontrastu v určitých okrscích pankreatu a a/nebo nález peripankreatické nekrózy. Průběh nekrózy je velmi variabilní, může zůstat solidní nebo kolikvuje, infikuje se nebo spontánně vymizí. Její identifikace je zásadní u pacientů, kteří neodpovídají na terapii, protože přítomnost nekrózy (sterilní i infikované) zhoršuje prognózu pacienta. Prevalence orgánového selhání u nekrotizující pankreatitidy je 54 % (mírně vyšší při infekci nekrózy).
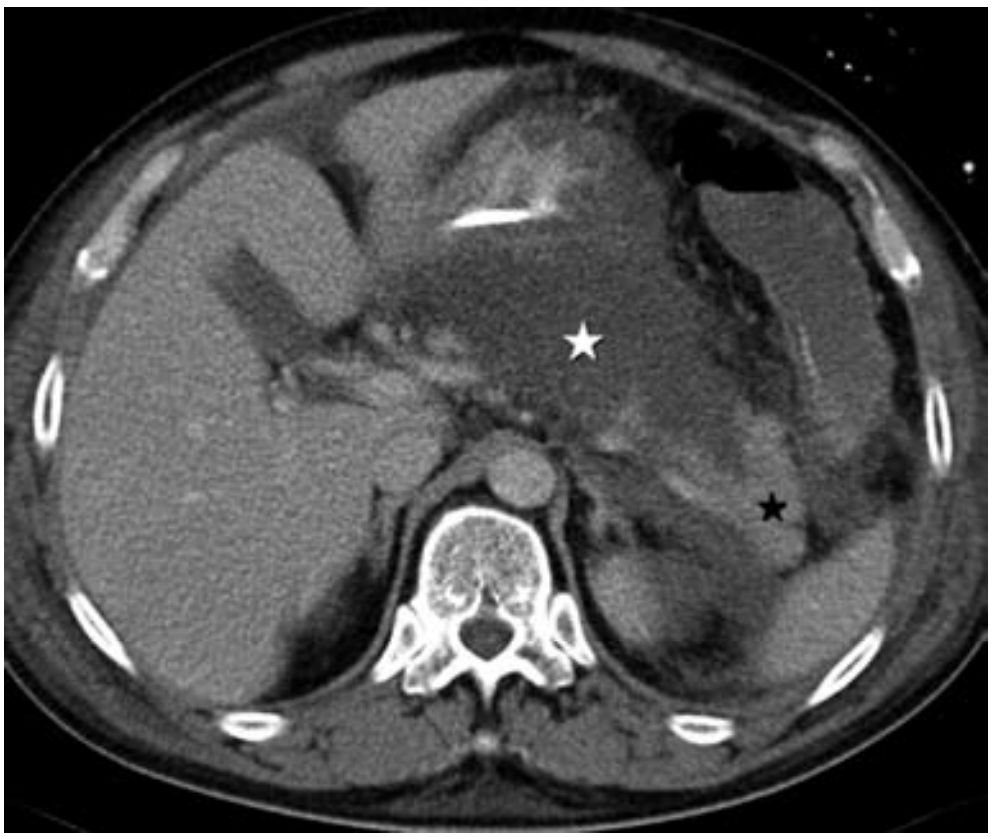
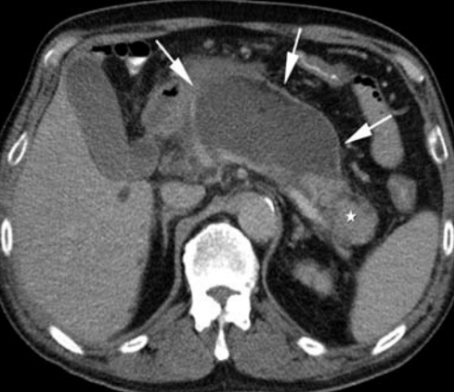
Akutní nekrotizující pankreatitida (bílá hvězdička označuje nekrózu, černá hvězdička normální parenchym).
3. Akutní pankreatická tekutinová kolekce – vzniká v terénu intersticiální pankreatidy.
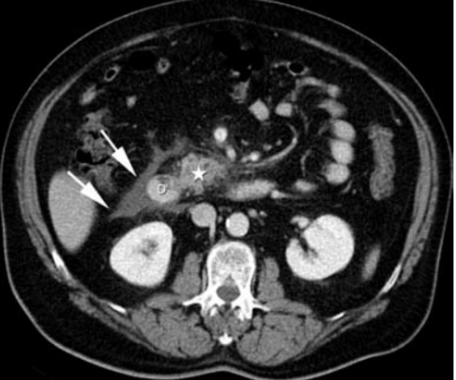
4. Pankreatická pseudocysta
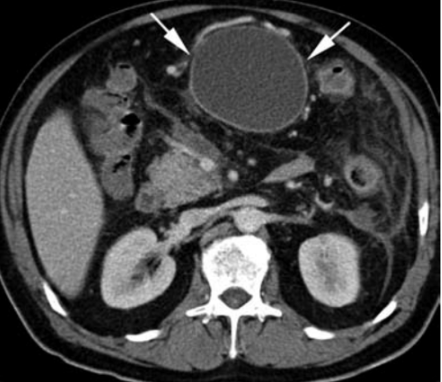
5. Akutní nekrotická kolekce – nemá jasně definovanou stěnu.
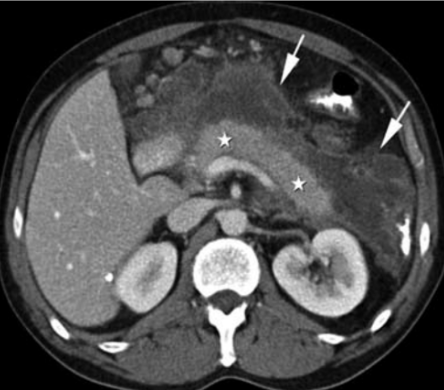
6. Walled-off pankreatická nekróza – má jasně definovanou stěnu.
Diferenciální diagnostika – podobný klinický průběh může mít:
- Perforace GIT (zejména peptický vřed)
- Akutní cholecystitida s biliární kolikou s obtížným odlišením od akutní pankreatitidy, protože v obou případech mohou být zvýšeny obstrukční enzymy (ALP, GGT). Rozdílem je, že biliární bolest se nachází více vpravo nebo epigastricky a je silnější. Většinou chybí ileus. Velmi nápomocný může být ultrazvukové vyšetření břicha.
- Akutní střevní obstrukce bývá více crescendo-decrescendo, k odlišení pomůže CT břicha.
- Akutní mezenterická obstrukce bývá častější u starších jedinců s rychle vzniklou leukocytózou, distenzí střevních kliček a krvavým průjmem. K odlišení je ideální CT nebo MR angiografie.
- Vaskulitida mezenteriálních tepen (nejčastěji u systémového lupus erythematosus a polyarteritis nodosa) je snadno zaměnitelná s akutní pankreatitidou, už proto, že akutní pankreatitida vzniká často jako následek těchto vaskulitid.
- Disekce aorty (event. jiný akutní aortální syndrom)
- Renální kolika
- Infarkt dolní stěny myokardu
- Pneumonie
- Diabetická ketoacidóza velmi připomíná akutní pankreatitidu, protože je často spojena s bolestmi břicha a zvýšenou hladinou amyláz v séru. K odlišení lze užít lipázu, která bývá při diabetické ketoacidóze v normě.
Terapie – léčba začíná již na emergency. Vždy je nutný odběr podrobné anamnézy (včetně úplné farmakologické anamnézy), laboratorní testy (včetně jaterního souboru, triacylglycerolů a kalcia) a provedení vstupního ultrazvuku břicha (posouzení stavu žlučových cest, žlučníku a pokud je vidět i hlavy pankreatu). Je potřeba zahájit agresivní tekutinovou resuscitaci, analgetickou léčbu a začít hledat vyvolávající příčinu. Je nutné provést triage pacienta a posoudit závažnost stavu. Pomoci může BISAP skóre na základě zhodnocení pěti faktorů během prvních 24 hodin od příjmu: hladiny urey (BUN) ˃9 mmol/l, GCS ˂ 15 (Impaired mental status), přítomnost SIRS, věk (Age) ˃ 60 let, radiologicky prokázaný Pleurální výpotek. Skóre ≥ 3 je spojeno se zvýšeným rizikem nemocniční mortality, dalším rizikovým faktorem je hematokrit ˃ 44 %. Pokud je BISAP skóre nízké a během 24 hodin se nevyvine SIRS, je riziko nekrózy nebo vzniku orgánového selhání malé. Takového pacienta je možné léčit na standardní oddělení. Při závažných komorbiditách (např. srdeční selhání, CHOPN), vysokém BISAP skóre nebo rezistenci k úvodní rehydrataci je indikováno přijetí na ICU.
BISAP skóre online zde: https://www.mdcalc.com/calc/1735/bisap-score-pancreatitis-mortality
1. Základní opatření – je nutné zastavit per os příjem a zavést nazogastrickou sondu k odsávání žaludečních sekretů, podat analgetika. Další složkou léčby je pravidelná rehabilitace.
2. Tekutinová resuscitace – Nejdůležitější součást léčby. Podávají se krystaloidy (Ringer laktát se ukazuje lepší při snížení SIRS než fyziologický roztok)
- v úvodním bolusu 15 – 20 ml/kg (cca 1000 – 1500 ml) následované kontinuálním podáním 3 ml/kg/hod (cca 200 – 250 ml/h). Cílem je zachování diurézy ˃ 0,5 ml/kg/hod, dalším vodítkem k posouzení adekvátnosti rehydratace je doporučena kontrola hematokritu a urey každých 8 – 12 hodin (hladina urey by měla začít klesat během prvních 12 – 24 hodin),
- pokud se urea zvyšuje, je to známkou neadekvátní rehydratace, ale i zvýšené mortality. V tom je indikováno podání dalšího bolusu 2000 ml krystaloidů s pokračováním kontinuální infúze 1,5 ml/kg/hod (100 – 150 ml/h),
- pokud ani po této intervenci nedojde k poklesu hodnot, je indikován překlad na ICU k hemodynamické monitoraci a event léčbě nekróz a orgánového selhání.
CAVE U pacientů se současným onemocněním srdce, plic a ledvin je třeba pečlivá titrace infuzní léčby pro riziko kardiálního selhání. Zde je lepší terapie na ICU již od začátku hospitalizace.
3. Speciální opatření v závislosti na etiologii
Biliární pankreatitida – druhá nejčastější příčina akutní pankreatitidy je obstrukce žlučovodů. Při známkách ascendentní cholangititdy (leukocytóza, zvýšení obstrukčních enzym) je indikována co nejčasnější ERCP. Vzhledem k riziku recidivy je po období rekonvalescence (cca 4 – 6 týdnů po poruštění) indikována cholecystektomie. Pokud je chirurgický výkon kontraindikován je alternativou endoskopická biliární sfinkterotomie.
Hypertriglyceridémie – třetí nejčastější příčina akutní pankreatitidy (zejména při hladině triacylglycerolů (TAG) ˃ 11 mmol/l. Úvodní terapií je podání inzulínu, který sám o sobě může snížit hladinu TAG, podpůrně pak heparin a plazmaferéza (pro tento postup ale neexistují výsledky větších studií). Po je propuštění ideální kontrola glykémií (u diabetiků), hypolipidemická léčba (+ vyvarování se léků, které zvyšují hladinu triglyceridů) a redukce tělesné hmotnosti.
Další příčinou akutní pankreatitidy může být:
- hyperkalcémie (hyperparatyreoidismus, malignita).
- autoimunitní pankreatitida, která většinou reaguje na léčbu glukokortikoidy.
- post-ERCP pankreatitida, jejíž riziko lze snížit zavedením stentu do ductus pancreaticus a současným podáním indometacinu per rectum.
- poléková pankreatitida (cca 30 léků má klasifikaci 1A, např. azathioprin, 6-merkaptopurin, sulfonamidy, estrogeny, tetracykliny, valproát, anti-HIV medikace, 5-ASA).
4. Dietní opatření – vstupně je nutné zastavit per os příjem a odsávat žaludeční obsah NGS. U lehké formy je možné zahájení postupné realimentace nízkotučnou dietou po odeznění bolestí břicha. U těžších forem pak enterální výživu po 2 – 3 dnech od přijetí. Enterální výživa je lepší než totální parenterální nutrice, protože umožňuje udržení integrity střevní sliznice s omezením rizika bakteriální translokace, je levnější a mé méně komplikací. Zda zvolit nazogastrickou nebo nazojejunální aplikaci je nyní předmětem zkoumání.
5. Léčba lokálních komplikací – pokud nedochází ke zlepšení klinického stavu i přes agresivní tekutinovou resuscitaci za hemodynamické monitorace je nutné aktivně pátrat po lokálních komplikacích (nekróza, pseudocysta, ruptura ductus pancreaticus, peripankreatické vaskulární komplikace, infekce).
Nekróza – léčba nekrózy vyžaduje multidisciplinární přístup. Při podezření na infekci nekrózy (leukocytóza, horečka, orgánové selhání) je indikována perkutánní aspirace s kultivací aspirátu. U septického pacienta je akceptovatelné podávání širokospektrých antibiotik do výsledku kultivace s následnou úpravou. Při negativním výsledku se antibiotická léčba přeruší k zabránění rozvoje oportunní infekce nebo mykotické superinfekce.
CAVE Profylaktické podávání antibiotik není u nekrotizující pankreatitidy indikováno.
Při přetrvávání horeček je vhodné opakování FNAB (fine-needle aspiration biopsy) s kultivací aspirátu každých 5 – 7 dnů a při jakékoliv změně klinického stavu i CT nebo MR břicha k časnému zachycení event. nových komplikací (např. trombóza, krvácení, abdominal compartment syndrom apod.). Obecně lze říct, že sterilní nekrózy jsou nejčastěji léčeny konzervativně, dokud nedojde ke vzniku komplikací. Po jejich infekci je nutná co nejdřívější identifikace vyvolávajícího agens a zaléčení antibiotiky dle citlivosti. Při neúspěchu je indikována perkutánní nebo endoskopická transgastrická drenáž, která je k pacientovi mnohem šetrnější než chirurgický výkon (jedna třetina pacientů léčená drenáží se mu tak vyhne). Při neúspěchu je metodou definitivní léčby nekrózy chirurgický debridement pankreatu (nekrosektomie). Klinická indikace je ovlivněna odpovědí pacienta na antibiotickou léčbu a jeho celkovým stavem a je ji třeba velmi důkladně zvážit.
Výsledky studií potvrzují vhodnost provedení endoskopické drenáže u některých pacientů s walled-out nekrózou (ve srovnání s otevřenou laparotomií v první linii léčby).
Pseudocysta – pseudocysta je definována jako perzistence tekutinové kolekce po více než 6 týdnech od vzniku choroby. Incidence je nízká (˂ 10 % pacientů) a většina z nich se spontánně resorbuje. Chirurgická, endoskopická nebo perkutánní drenáž je indikována při symptomech.
Ruptura ductus pancreaticus – může se projevit nárůstem bolesti břicha, dušností a zvětšením tekutinové kolekce. Diagnózu lze potvrdit pomocí MRCP nebo ERCP. Ve ˃ 90 % případů je úspěšnou léčbou přemostění leaku stentem po dobu nejméně 6 měsíců.
Perivaskulární komplikace – zahrnují trombózu lienální žíly s gastrosplenickými varixy (krvácí v ˂ 5 % případů) a pseudoaneuryzmaty, jejichž krvácení lze identifikovat a embolizovat angiograficky.
Extrapankreatická infekce – nozokomiální infekce se vyskytují u ˂ 20 % pacientů s akutní pankreatitidou (pneumonie, uroinfekt, katétrové infekce). Je třeba na ně myslet a provádět pravidelně lokální péči o vstupy, RTG srdce a plic a kultivace moče.
6. Folow-up – u všech pacientů je třeba screening endokrinní (diabetes mellitus) a exokrinní insuficience pankreatu, recidivy cholangitidy nebo infekce pseudocysty. Za 4 – 6 týdny od propuštění pacienta s biliární pankreatitidou je indikována cholecystektomie.
Prognóza – 85 – 90 % akutních pankreatitid má benigní průběh a spontánně vymizí do 3 – 7 dnů od zahájení léčby. Mortalita akutní pankreatitidy při selhání jednoho orgánu je 3 – 10 %, při multiorgánovém selhání 47 %.
Recidivující pankreatitida
U cca 25 % pacientů s akutní pankreatitidou dochází k její recidivě. Dva základní vyvolávající faktory jsou alkohol a cholelitiáza, při jejich vyloučení je třeba pátrat po méně častých příčinách (mikrolitiáza, litiáza/ striktura ductus pancreaticus, hypertriglyceridémie, léky, hypertriglyceridémie, karcinom pankreatu, tumor ampuly, pancreas divisum, choledochokéla, cystická fibróza, hereditární pankreatitida).
V jedné studii se souborem 31 pacientů s recidivující akutní pankreatitidou byla ve 23 případech příčinou okultní cholelitiáza. Cca 2 – 4 % karcinomů pankreatu se projevuje akutní pankreatitidou.
Akutní pankreatitida pacientů s AIDS
Pi AIDS je incidence akutní pankreatitidy zvýšena ze dvou důvodů (pokroky v léčbě ji významně snížily):
- 1. Při AIDS je vysoká incidence infekcí, které postihují pankreas (Cryptosporidium, Mycobacterium avium complex).
- 2. Pacienti s AIDS jsou často léčeni látkami, které mohou akutní pankreatitidu vyvolat (pentamidin, trimetoprim-sulfametoxazol a inhibitory proteáz).
Chronická pankreatitida
Definice
Chronická pankreatitida vzniká ireverzibilním poškozením pankreatu (na rozdíl od akutní pankreatitidy, která je reverzibilní). Jeto histologická diagnóza, která se vyznačuje chronickým zánětem, fibrózou a destrukcí exokrinní i endokrinní složky pankreatu.
Patofyziologie
Bez ohledu na vyvolávající příčinu chronické pankreatitidy dochází ke zvýšení exprese pankreatických hvězdicovitých buněk (stelattae cells) se zvýšením exprese zánětlivých cytokinů a vzniku zánětu s nastartováním fibroprodukce.
Etiologie
Nejčastější příčinou chronické pankreatitidy v USA je konzumace alkoholu u dospělých a cystická fibróza u dětí. Přesto, u 25 % pacientů se etiologický faktor nepodaří najít (idiopatická forma chronické pankreatitidy), dle recentních studií je u 15 % pacientů s idiopatickou pankreatitidou v pozadí genetický defekt.
1. Alkohol – konzumace alkoholu je hlavním faktorem vzniku chronické pankreatitidy, ale určitě ne jediným (u některých těžkých alkoholiků se pankreatitida nikdy nevyvine).
2. Kouření – mezi kouřením a chronickou pankreatitidou existuje silný vztah závislý na dávce. Kouření zvyšuje náchylnost pankreatu k autodigesci a poškozuje funkci CFTR duktálních buněk. Podobně zvyšuje i riziko recidivy akutní pankreatitidy.
3. Geneticky podmíněná forma chronické pankreatitidy
- Mutací genu pro trypsinogen (PRSS1) nedochází k k intracelulární inaktivaci aktivovabého trypsinu, jehož trvalá intrapankreatická aktivace vede k akutnímu poškození pankreatu, zánětu a nakonec k chronické pankreatitidě.
- Mutace genu pro CFTR (dosud bylo identifikováno ˃ 1000 mutací) vede k tvorbě defektního cAMP regulovaného chloridového kanálu, který uvězňuje Cl– uvnitř buňky. U pacientů s cystickou fibrózou tak vzniká velmi viskózní pankreatický sekret s následnou blokádou ductus pancreaticus a vznikem zánětu.
Dvě studie prokázaly vztah mezi mutacemi CFTR a monosymptomatickou formou cystické fibrózy, která se projevila chronickou pankreatitidou, ale nebylo přítomnou plicní postižení a podobně i chloridový potní test byl negativní. Odhaduje se, že prevalence mutací CFTR u pacientů s „idiopatickou pankreatitidou“ je 11 x vyšší v případě monoalelické mutace a 80 x vyšší v případě bialelické mutace ve srovnání s běžnou populací. Jiná studie s 39 pacienty prokázala, že u pacientů s dvěma CFTR mutacemi (smíšení heterozygoti) je úroveň funkce CFTR někde mezi asymptomatickými nosiči a pacienty s typickou cystickou fibrózou a riziko pankreatitidy je u nich 40 x zvýšené. K definitivní validaci je třeba dalších studií a delší follow-up.
Mutace N34S genu pro inhibitor trypsinu (N34S SPINK1) je spojena s 20 x vyšším rizikem chronické pankreatitidy. Kombinace dvou mutací CFTR a N34S SPINK1 zvyšuje toto riziko 900 x. Znalost genetického defektu vedla u postižených dětí k vývoji nové genetické terapie s následným zlepšením kvality jejich života, funkce plic i váhovým příbytkem.
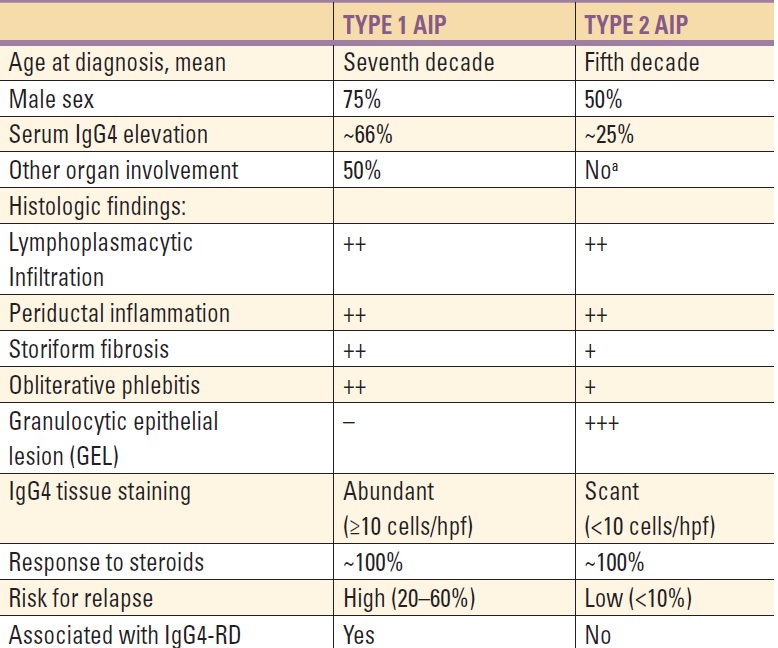
4. Autoimunitní chronická pankreatitida – autoimunitní pankreatitida (AIP) je vzácnou chorobu s charakteristickým laboratorním, histologickým i morfologickým nálezem. Typy:
AIP typ 1 – fibrotický pankreas je infiltrován lymfocyty, dále je přítomen nadbytek IgG4 buněk jako součást projevu systémové choroby IgG4 (dále IgG4 cholangitida, revmatoidní artritida, Sjögrenův syndrom, chronická sklerozující sialitida ulcerózní kolitida, mediastinální fibróza s adenopatií, retroperitoneální fibróza, autoimunitní tyreoiditida, tubulointersticiální nefritida, chronická periaortitida a Mikuliczova choroba). Dobrým markerem je IgG4, jehož hladina je výrazně zvýšená.
IgG4 cholanditida – CT vyšetření prokáže difuzní nebo fokální zvětšení pankreatu, při ERCP nebo MRCP striktury žlučovodů (proximálních intrahepatálních, hepaticus communis, choledochus včetně jeho pankreatické části) u více než jedné třetiny pacientů, tzv. IgG4 cholangitida. Charakteristickým nálezem je výrazný lymfoplazmatický infiltrát s denzní fibrózou v okolí pankreatických duktů a obliterativní flebitida.
AIP typ 2 – stěna pankreatických vývodů je infiltrována granulocyty, ale bez přítomnosti IgG4+ buněk a bez systémového postižení.
Dle Mayo Clinic HISORt kritérií je ke stanovení AIP třeba splnit ≥ 2 následující kritéria:
- Histologický nález
- Zobrazovací metody (Imaging)
- Serologický nález
- Postižení Ostatních orgánů
- Odpověď na léčbu glukokortikoidy (Response on glucocorticoid therapy)
Základem léčby je podání glukokortikoidů, často s účinkem již po 2 – 4 týdnech terapie. Úvodní dávka je cca 40 mg/den po dobu prvních 4 týdnů s následným postupným snižováním o 5 mg/den týdně. Při nedostatečné odpovědi po 4 týdenní léčbě glukokortikoidy je nutné vyloučit jinou formu chronické pankreatitidy nebo karcinom pankreatu. Relaps po vysazení glukokortikoidů je běžný zejména u AIP typu I, zvláště při současné IgG4 cholangitidě. Při rezistenci je nutná další imunosupresní terapie (azathioprin, mykofenolát mofetil, rituximab). Pozdní výskyt karcinomu pankreatu je vzácný.
Recentní studie analyzovala 1064 pacientů s AIP. Po glukokortikoidech bylo dosaženo klinické remise u 99 % pacientů s AIP typ 1 a 92 % (s relapsem po vysazení glukokortikoidů v 31 %) s AIP typ 2 (s relapsem po vysazení glukokortikoidů v 9 %). Při léčbě relapsu AIP typu 1 byly úspěšné opět glukokortikoidy v 68 % případů a azathioprin v 85 % případů. malé množství pacientů si vyžádalo léčbu 6-merkaptopurinem, rituximabem, cyklofosfamidem a cyklosporinem.
5. Hereditární pankreatitida – vzácná choroba, která se podobá chronické pankreatitidě, od které se liší časnou manifestací a pozitivní rodinnou anamnézou. Gen pro hereditární pankreatitidu (HP) se nachází na chromozómu 7.
Autozomálně dominantně dědičná forma je způsobena mutací genu pro kationický trypsinogen v oblasti kodonu 29 (exon 2) a kodonu 122 (exon 3). Mutace kodonu 122 vede k záměně argininu za histidin, čímž je eliminována „sebedestrukční místo“ trypsinu, který tak nemůže po předčasné aktivaci v acinárních buňkách inaktivován.
Etiologii chronické pankreatitidy lze charakterizovat zkratkou TIGAR-O (viz níže).
Klinický obraz
Základními projevy jsou bolest břicha, steatorea, váhový úbytek a diabetes mellitus.
Bolest břicha – bolest je měnlivá v lokalizaci, závažnosti i frekvenci. Může být trvalá nebo být střídána bezbolestnými intervaly. Často je vyvolána jídlem, proto mají někteří pacienti strach z jídla s následným váhovým úbytkem. Může být jenom mírná, nebo tak těžká, že vyžaduje podávání opiátů.
Maldigesce – projevuje se chronickým průjmem, steatoreou, ztrátou hmotnosti a únavou, dále deficit vitamínů rozpustných v tucích a osteoporóza nebo osteopenie.
Diagnostika
1. Laboratorní vyšetření – stanovení správné diagnózy je obtížné, protože neexistuje žádný běžný biochemický marker chronické pankreatitidy (amylázy a lipázy v séru bývají většinou v normě):
- elevace sérového bilirubin a ALP mohou znamenat cholestázu při striktuře žlučovodů následkem chronického zánětu.
- porušená glukózová tolerance vzniká nedostatkem sekrece inzulínu poškozeným pankreatem.
- elastáza ve stolici je výrazně snížená (˂ 100 μg/gram stolice) s normálním histologickým obrazem při biopsii sliznice tenkého střeva.
2. Zobrazovací metody – postup od metod méně invazivních k invazivnějším (RTG, CT, MRI, EUS, funkční test):
CT pankreatu – může prokázat pankreatické pseudocysty, karcinomu, kalcifikace, dilataci pankreatických duktů nebo atrofii pankreatu.
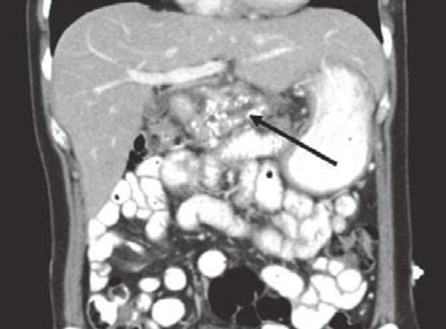
Na kontrastním CT skenu je nález atrofického pankreatu s mnohočetnou kalcifikací parenchymu a
litiázou v dilatovaných pankreatických duktech (šipka).
EUS – úloha endoskopického ultrazvuku (EUS) v diagnóze časné chronické pankreatitidy není jasná. Sám o sobě není dostatečně senzitivním vyšetřením, nicméně bylo popsáno celkem devět EUS znaků chronické pankreatitidy (pozitivita ≥ 5 je známkou pravděpodobné diagnózy). Recentní data naznačují, že EUS lze v jedné době kombinovat s endoskopickým pankreatickým funkčním testem (ePFT)
Sekretinový test – stimulační test se sekretinem má v diagnostice chronické pankreatitidy nejvyšší senzitivitu i specificitu. Výsledek začíná být pozitivní po ztrátě ≥ 60 % exokrinní funkce pankreatu, což zhruba koreluje se vznikem pankreatické bolesti.
MRCP – metoda vhodná k průkazu postižení žlučovodů a pankreatického duktu.
Rentgen břicha – kalcifikace patrné na prostém snímku břicha jsou patognomonické a jsou známkou vážného poškození pankreatu. Nejčastější příčinou je alkoholismus, vyskytovat se mohou i při hereditární, posttraumatické, hyperkalcemické, idiopatické a tropické pankreatitidě.
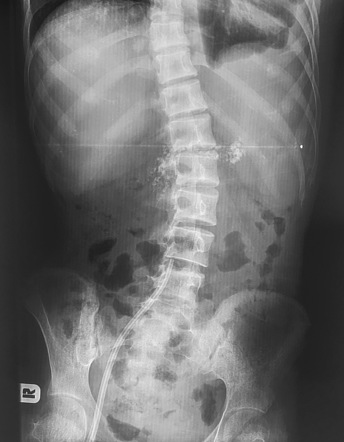
Komplikace chronické pankreatitidy
Diabetes mellitus – většina pacientů s chronickou pankreatitidou má porušenou glukózou toleranci, na druhou stranu, diabetická ketoacidóza s kómatem a end-stage orgánové postižení při diabetu (retinopatie, neuropatie, nefropatie) jsou vzácné. Nediabetická retinopatie může vzniknout při nedostatku vitamínu A a/nebo zinku.
Gastrointestinální krvácení – může vzniknout následkem peptického vředu, gastritidy, pseudocysty erodující duodenum, arteriálního krvácení do ductus pancreaticus (hemosuccus pancreaticus) nebo rupturou varixů při trombóze lienální žíly při chronickém zánětu kaudy pankreatu.
Ikterus, cholestáza, biliární cirhóza – může vzniknout obstrukcí pankreatické části choledochu díky chronickému zánětu pankreatu.
Karcinom pankreatu – kumulativní riziko karcinomu pankreatu po 20 letech trvání chronické pankreatitidy je 4 % (ještě vyšší u tropické formy pankreatitidy nebo při hereditární pankreatitidě s mutací PRSS1).
Terapie
1. Dietní opatření – základem je absolutní zákaz alkoholu, není vhodná káva a perlivé nápoje. Strava by měla být rozdělena do více porcí a jako zdroj energie by měly být preferovány bílkoviny (1,5 g/kg tělesné hmotnosti) a naopak omezeny tuky (60 – 80 g/den) s preferencí rostlinných tuků s s obsahem mastných kyselin se středním řetězcem (MCT, např. kokosový olej a palmojádrový olej). Není-li přítomen diabetes, není nutno omezovat množství cukrů.
2. Substituce enzymů – základní metoda léčby, obvykle léky s obsahem pankreatinu (získáván z vepřového pankreatu). Navzájem se liší galenickou úpravou a obsahem jednotlivých enzymů (tzn. lipáz, amyláz a proteáz). Pro optimální funkci je nutná synchronizace se vstupem žaludečního obsahu do horních etáží duodena, čehož lze dosáhnout podáním během jídla. Lékovou formou je mikrokapsle s obsahem mikropelet o velikosti optimálně 1 – 2 mm, ve kterých jsou enzymy chráněny acidorezistentním obalem. Enzymy z mikropelet jsou následně uvolňovány současně se vstupem žaludečního obsahu do duodena. Efekt enzymů lze zvýšit současným podáním blokátorů HCl, protože kyselé pH může enzymy uvolněné z kapsle deaktivovat. Při enzymové substituci jen vzácně steatorea zcela vymizí, dochází ale většinou ke korekci průjmu, zlepší se absorpce tuku na akceptovatelnou úroveň a zvýší se tělesná hmotnost. Denní dávka enzymů (nejzásadnější je lipáza) je do 100 000 IU lipázy u lehčích forem a 150 000 IU lipázy u těžkých forem chronické pankretitidy. Přípravek: KREON 10000 cps (150 mg pankreatinu, 10 000 IU lipázy) nebo 25000 cps (300 mg pankreatinu, 25 000 IU lipázy, až 2-2-2).
3. Léčba bolesti – léčba bolesti při chronické pankreatitidě je problematická. Recentní metaanalýza neprokázala zlepšení pankreatické bolesti po zahájení substituce enzymů. U některých pacientů mohou přípravky s vysokým obsahem serin proteáz zlepšit abdominální dyskomfort, což ale může být i v souvislosti se zlepšením dyspepsie při maldigesci. Recentní studie prokázala, že bolest při chronické pankreatitidě může zmírnit pregabalin.
4. Endoskopická terapie – mezi endoskopické terapeutické výkony patří:
- sfinkterotomie
- implantace stentu v přítomnosti striktur (při jejich nepřítomnosti není prokázán žádný benefit, a naopak významně rostou rizika implantace stentu, např. krvácení, cholangitida, migrace stentu, pankreatitida a obliterace stentu).
- extrakce litiázy
- drenáž pankreatické pseudocysty
5. Chirurgická léčba – u pacientů s „large-duct disease“ je metodou volby chirurgická duktální dekomprese. Výkon je bezprostředně po operaci účinný u 80 % pacientů, nicméně po třech letech bolest u poloviny pacientů recidivuje.
Dvě randomizované prospektivní studie, které srovnávaly chirurgický a endoskopický postup prokázaly, že u pacientů s dilatovanými dukty a bolestmi břicha je chirurgický postup účinnější. event. role předoperační implantace stentu musí být ještě prokázána.
U vybraných pacientů s refrakterní formou choroby byla provedena Whippleova operace, totální pankreatektomie a autologní transplantace Langerhanových ostrůvků. Úlohu takto radikálního postupu je ještě třeba definovat, ale zdá se, že může mít místo v léčbě rezistentní formy „small-duct disease“. Blokáda plexus celiacus nemá dlouhodobější efekt.
Ostatní choroby pankreatu
Pancreas annulare
Etiologie a patogeneze – anulární pankreas vzniká při poruše migrace ventrálního základu pankreatu a kontaktu s dorzálním základem. Výsledkem je prstenec pankreatické tkáně obklopující duodenum, který může vést k jeho obstrukci.
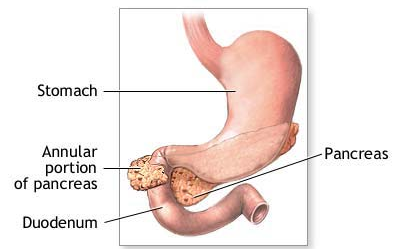
Klinický obraz – roky před stanovením diagnózy se může projevovat postprandiální plností, bolestí v epigastriu, nauzeou a zvracením. Je zvýšené riziko chronické pankreatitidy a peptického vředu.
Diagnostika – radiologicky lze prokázat symetrickou dilatací proximálního duodena s recesy vycházejícími po obou stranách anulárního pruhu pankreatu a dále setření, ale nikoliv destrukce duodenální sliznice s akcentací změn v pravé přední šikmé pozici. Při opakování vyšetření jsou tyto nálezy stacionární.
Diferenciální diagnostika – je nutné vyloučit duodenální síťku, tumor duodena nebo pankreatu, postbulbární peptický vřed, segmentální enteritidu a adheze.
Terapie – vzhledem k riziku komplikací je indikována chirurgická terapie i při asymptomatickém průběhu. Metodou volby je retrokolická duodenojejunostomie, někteří chirurgové preferují gastrektomii Billroth II, gastroenterostomii a vagotomii.
Pancreas divisum
Epidemiologie – nejčastější vrozená anatomická varianta pankreatu (7 – 10 % populace).
Etiologie a patogeneze – vzniká poruchou fůze ventrálního a dorzálního základu pankreatu. Mimo normální ductus pancreaticus (ductus Wirsungi), který drénuje dorzální základ a ústí na Vaterské papile, je pankreas drénován (často až 70 % pankreatu) i akcesorním ductus pancreaticus (ductus Santorini), který ústí do duodena vlastním ústím (ductus pancreaticus minor).
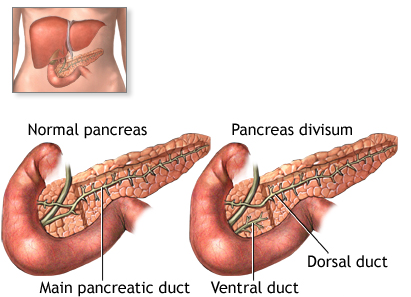
Klinický obraz – zdá se, že u většiny pacientů tato anomálie nezvyšuje riziko pankreatitidy, přesto, kombinace pancreas divisum a malého ústí akcesorní papily může vést k obstrukci a zvyšovat riziko akutní pankreatitidy. Nyní je snaha o identifikaci této rizikové podskupiny pacientů (kanylace dorzálního segmentu při ERCP je poměrně obtížná a vede ke zvýšení rizika post ERCP pankreatitidy).
Diagnostika
Diagnostika – základem je ERCP nebo MRCP.
CAVE ERCP/MRCP vzhled pancreas divisum (ventrální duktus malého kalibru a stromovité struktury) může imitovat vnější obstrukci hlavního pankreatického duktu tumorem.
Terapie – pankreatitida u pacientů s pancreas divisum by měla být léčena standardně (často nebývá mezi těmito jednotkami ani souvislost). Endoskopická nebo chirurgická intervence je indikována pouze při recidivách pankreatitidy a chybění jiného vysvětlení. Při nálezu významné dilatace dorzálního duktu je indikována chirurgická dekomprese.
Makroamylázemie
Epidemiologie – vyskytuje se u cca 1,5 % nealkoholické hospitalizované dospělé populace.
Patogeneze – vznikají amylázové polymery, které jsou příliš veliké, aby byly vyloučeny močí. Důsledkem je jejich vysoká hladina v séru a nízká v moči. Obvykle je náhodným nálezem, který nemá vztah k chorobám pankreatu ani jiných orgánů.
Diagnostika – přítomnost polymerů lze prokázat chromatografií séra
Makrolipázémie
Makrolipázémie byla prokázána u pacientů s cirhózou nebo non-Hodgkinským lymfomem (v tomto případě vázaná s imunoglobulinem A). I u nich byl ultrazvukový i CT nález pankreatu normální.