121. Pneumonie
Definice – pneumonie je akutní zánět respiračních bronchiolů, alveolárních struktur a plicního intersticia. Často splňuje kritéria:
- sepse (3. definice 2016) – život ohrožující orgánová dysfunkce vznikající dysregulací odpovědi organismu na infekci. Orgánová dysfunkce = SOFA skóre 2 body a více.
- SOFA skóre (Systemic and Organ Failure Assessment Score). On-line kalkulátor zde: https://www.mdcalc.com/sequential-organ-failure-assessment-sofa-score
- qSOFA („HAT“) = Hypotenze (sTK < 100 mmHg), Alterované vědomí (GCS < 15), Tachypnoe (RR > 22)
- septický šok – sepse s přetrváním následujících příznaků i po tekutinové resuscitaci: perzistující hypotenze (dosažení MAP > 65 mmHg jen za použití vazopresorů), laktát > 2 mmol/l.
Dřívější kritéria sepse: (teplota > 38 °C / < 36 °C, TF > 90/min, RR > 20/min a/nebo paCO2 < 4,3 kPa, leu > 12. 109/mm3 nebo < 4. 109/mm3 nebo > 10 % nezralých forem granulocytů), těžké sepse (sepse + nejméně jedno z následujících: 1) hypotenze < 90/60 mmHg a/nebo pokles systolického tlaku o > 40 mmHg reagující na resuscitaci tekutinami 2) kvalitativní nebo kvantitativní porucha vědomí 3) oligurie < 0,5 ml/kg/h 4) hypoxemický index (paO2/FiO2) < 200 5) trombocytopenie < 100. 109/mm3 6) laktátová acidóza > 2,0–4,0 mmol/l), septického šoku (chybí vzestup tlaku po podání tekutin)
Patofyziologie – organismus má řadu obranných mechanismů (fyziologická flóra, mukociliární transport, kašlací reflex, alveolární makrofágy), jejichž porucha přispívá k přežití mikroorganismů v dolních částech respiračního traktu. Dostávají se sem nejčastěji mikroaspirací ve spánku/bezvědomí, inhalačně nebo per continuitatem z pleury nebo mediastina.
Makrofágy zahajují zánětlivou reakci, uvolnění IL-1 a TNF-α působí horečku, IL-8 a GCF přitahují leukocyty se vznikem neutrofilní infiltrace plic i periferní leukocytózy. Zánětlivé mediátory vedou ke vzniku exsudace z alveolárních kapilár a ARDS. Porušenou membránou mohou procházet i erytrocyty se vznikem hemoptýzy. Toto se v konečném důsledku projevuje RTG infiltráty, poslechovým nálezem chrůpků a hypoxémií, kterou některé mikroorganismy zhoršují přímou indukcí vazokonstrikce, hyperventilace s následnou alkalózou a nakonec respiračním selháním.
Patologie – při typickém průběhu mají patologické změny fáze:
- Zpočátku je edém s přítomností tekutin a baktérií v alveolech. Rychle přechází do:
- Fáze červené hepatizace s přítomností erytrocytů a neutrofilů v alveolech.
- Fáze šedé hepatizace bez přítomných erytrocytů, které již hemolyzovaly a nové nepřibývají a bez bakterií s dominujícím nálezem neutrofilů a fibrinu.
- Fáze rezoluce, kdy dominují makrofágy, které „uklízejí nepořádek“ z předchozích fází.
CAVE Tento průběh neplatí pro všechny pneumonie (např. pneumocystovou nebo virovou).
Klasifikace
- CAP (community-aquired pneumonia) vzniká v běžném prostředí mimo zdravotnické zařízení nebo do 48 hodin po přijetí do nemocnice.
- HAP (hospital aquired pneumonie) vzniká po 48 a více hodinách po přijetí nebo až do 14 dnů od propuštění z nemocnice (v době přijetí nejsou přítomny žádné klinické známky onemocnění).
- VAP (ventilator-associated pneumonia) vzniká > 48 hodin po OTI.
- HCAP (health care-associated pneumonia) vzniká u lidí s anamnézou minimálně dvoudenní hospitalizace v posledních 90 dnech, rezidentů sociálního zařízení nebo domácí sesterské péče, hemodialyzovaných pacientů, nemocných s domácí infuzní léčbou (ATB) a chemoterapií, dále u těch, kteří byli zraněni v posledních 30 dnech, chodí na časté ambulantní kontroly do nemocnice nebo mají kontakt s členem rodiny, který má infekci MDR patogenem.
I. CAP
Etiologie – existuje obrovské množství různých původců, ale v drtivé většině se jich opakuje několik. Dle dřívějšího dělení na typické a atypické:
- Typické
- G+ (Streptococcus pneumoniae, Staphylococcus aureus)
- G- (Haemophillus influenzae, Klebsiella pneumoniae, Pseudomonas aeruginosa)
- Atypické
- Mycoplasma pneumoniae, Chlamydia pneumoniae, legionela
- influenzaviry, adenoviry, RS virus
- anaeroby hrají roli pouze u pacientů s vysokým rizikem aspirace (alkoholici, intoxikovaní, pacienti s křečemi)
Rizikové faktory – alkoholismus, imunosuprese, asthma bronchiale, časté hospitalizace, věk > 70 let.
Epidemiologie – incidence 1 % (ČR), věk – více děti < 5 let a dospělí > 50 let (s věkem dále stoupá).
Klinický obraz – má různou závažnost. Často febrilie, tachykardie, anamnéza zimnice s třesavkou, při postižení pleury parietální bolesti na hrudníku. Kašel může být neproduktivní i produktivní (sputum hlenovité, purulentní i krvavé, rezavé u pneumokoka). U > 20 % pacientů přítomny GIT příznaky (průjem, nauzea a zvracení). U MRSA může být hemoptýza. V závažnějších případech dušnost. I objektivní nález závisí na závažnosti procesu. Může být tachypnoe, použití akcesorních dýchacích svalů. Typicky snížené respirační pohyby na postižené straně, ztemnělý poklep, často trubicové dýchání, přízvučné vlhké chropy, někdy bronchitické fenomény, v počáteční a a hojící fázi onemocnění krepitus (krepitus indux, krepitus redux). Fremitus pectoralis i bronchofonie jsou zesílené.
Ke klasifikaci závažnosti lze použít CURB-65 skóre (https://www.mdcalc.com/curb-65-score-pneumonia-severity). Za každý pozitivní příznak jeden bod (pozn. nutno brát s rezervou): porucha vědomí, urea > 7 mmol/l, RR > 30, sTK < 90 mm Hg, věk > 65 let. Výsledek: 0-1: 30 denní mortalita 1,5 %, ambulantní péče, 2: 30 denní mortalita 9,2 %, hospitalizace, 3 a více: 22 % denní mortalita, hospitalizace, zvážení JIP
Diagnostika
- Na RTG srdce a plic bývá homogenní zastření, někdy airbronchogram / oploštělý kostofrenický úhel (výpotek).

- CT – nejpřesnější zobrazovací metoda

- Gramovo barvení a kultivace sputa pomůže někdy identifikovat původce dle typického vzhledu (stafylokoky, streptokoky, G- baktérie). Aby bylo vhodné ke kultivaci, musí sputum obsahovat > 25 neutrofilů a < 10 dlaždicových epiteliálních buněk. Pokud je pacient intubován, nahrazuje odběr sputa bronchiální aspirát. CAVE Původci atypických pneumonií se kultivují na specifických médiích. CAVE Sputum ≠ vyplivnuté sliny.
- Hemokultury mají extrémně nízkou senzitivitu (pouze 5 – 14 %) a mají proto malý vliv na další léčbu CAP, nicméně při pozitivitě mohou „nasměrovat“ další terapii. U vybraných skupin pacientů (neutropenie, asplenie, imunodeficientní, AIDS, chronické jaterní choroby) smysl mají.
- Test na močové antigeny je dostupný pro Legionella pneumophila sérotyp I (odpovědný za většinu případů legionářské nemoci v USA) se senzitivitou a specificitou 90 – 99 % a pro pneumokoka se senzitivitou 80 % a specificitou > 90 %. CAVE Testy lze provést i po zahájení ATB terapie.
- PCR je možné provádět k detekci pneumokoků, legionel, mykoplasmat, chlamydií, mykobakterií a dalších.
- Sérologie je nyní na ústupu, nicméně stále má svou úlohu zejména u atypických původců.
- K posouzení aktivity onemocnění lze použít markery zánětu (CRP, PCT).
Terapie – o příjmu pacienta k hospitalizaci rozhoduje celkový stav pacienta (pomoci může CURB-65, jak již uvedeno, nutné brát s rezervou a použít zdravý rozum…).
- Obecná a režimová opatření. Důležitá je dostatečná výživa, hydratace a dále dechová rehabilitace. Někteří pacienti s těžkou CAP, kteří zůstávají hypotenzní i přes tekutinovou resuscitaci mohou mít adrenální insuficienci a profitovat z podání glukokortikoidů.
- Empirická ATB terapie. Se zahájením ATB nelze čekat terapie až do výsledku kultivací. Obecně platí, že ATB je nutné podat tak rychle, jak je to jen možné (optimálně do dvou hodin od přijetí). Při závažném průběhu indikována empiricky dvojkombinace ATB. Při nutnosti příjmu na ICU je vyšší riziko infekce PSAE nebo MRSA. CAVE Při terapii makrolidy nebo fluorochinolony v předchozích 3 měsících je zvýšené riziko infekce rezistentními pneumokoky. Délka terapie je otázkou. Standardně se ATB podávají 10 – 14 dnů. Některé studie ukázaly, že u nekomplikovaných CAP stačí 5 denní kůra fluorochinolony, delší léčbu naopak vyžadují závažné formy nebo CAP působené MRSA nebo PSAE. Horečka by měla klesat za 2 dny, stav nemocného se zlepšit za 3 dny, pokud ne, je třeba změnit ATB nebo pomýšlet na komplikace (empyém, absces). Kompletní regrese RTG změn trvá 1 – 3 měsíce.
- Podpůrná léčba. Nemocným by měla být aplikována mukolytika (acetylcystein, bromhexin, mesna), O2.
Empirická volba ATB terapie

Komplikace
- Lokální – pleuritida (40 %), absces (7 %), empyém (2%), plicní gangréna, ARDS, atelektáza, bronchiektázie
- Celkové – sepse s šokem, artritida, otitis, glomerulonefritis, endokarditis, meningitis, peritonitis.
Prevence – očkování proti pneumokokům (proti 13 a 23 serotypům) a proti chřipce.
Atypické CAP – atypické svým průběhem (horečka bez třesavky, dráždivý kašel s minimální expektorací, chudý fyzikální nález a častější extrapulmonální projevy – artralgie, myalgie, bolesti hlavy). Laboratorně spíše neutropenie → relativní lymfocytóza, ATB jsou indikována déle (14 – 21 dní) a to tetracykliny, makrolidy, fluorochinolony.
II. HAP
HAP může za více úmrtí, než infekce ostatních oblastí organismu (toto je samozřejmě ovlivněno i ostatními faktory, např. komorbidity a celkový stav organismu). V užším slova smyslu lze za HAP označit nozokomiální pneumonii u neventilovaného pacienta. Hlavním rozdílem oproti VAP je:
- výrazně větší podíl non-MDR patogenů a lepší základní imunita neintubovaných pacientů.
- častější jsou naopak anaeroby (větší riziko makroaspirace), ale specifická empirická terapie proti anaerobům není indikována. Diagnóza je obtížná, protože vzorek sputa na kultivaci musí pacient vykašlat, čehož není často schopen a hemokultury bývají pozitivní v < 15 % případů. Přes tato úskalí je prognóza HAP lepší než VAP.

III. VAP
Etiologie – působeny různě citlivými etiologickými agens:
- non-MDR (non multidrug-resistent), kam patří původci těžkých CAP. Dominují, pokud vznikne VAP do cca 7 dnů od příjmu do nemocnice.
- MDR (multidrug-resistent), nejčastěji MRSA a PSAE.
- U imunokompromitovaných časté i mykotické a virové VAP
Cca 5 – 10 % pacientů na UPV onemocní VAP. Časné HAP (< 4 dny od přijetí) jsou způsobeny komunitními agens (hemofilus, pneumokok). Pozdnější HAP jsou vyvolány S. aureus, PSAE, enterobaktery, KLPN nebo acinetobaktery. Cca ve 20 – 40 % je infekce polymikrobiální. Dle jedné studie je vhodná délka terapie 8 dnů, pokud není vyvolávajícím agens PSAE nebo acinetobakter (v tom případě by měla být 15 dnů).
Mezi patofyziologické mechanismy VAP patří kolonizace orofaryngu „nefyziologickými mikroorganismy (např. PSAE), jejich mikroaspirace do plic (při OTI dochází k hromadění sekretu nad manžetou) a oslabení protektivních faktorů hostitele.
Epidemiologie – cca 10 % ventilovaných pacientů na JIP má v „průměrný den“ VAP. Nejvyšší riziko je v prvních 5 dnech, poté nastává na 2 týdny plateau. Nicméně, riziko VAP u pacientů na UPV po dobu 30 dnů je 70 %.
Klinický obraz – viz CAP
Diagnostika – obtížná, protože zastínění na RTG S+P i zvýšení zánětlivých markerů u kriticky nemocných může způsobit řada jiných vyvolávajících příčin.
- Kvantitativní kultivace se stanovením počtu CFU umožní odlišit kolonizaci od VAP. Senzitivitu výrazně snižuje předchozí ATB léčba.
- Klinický přístup umožňuje vyvarovat se zbytečnému „přeléčení“ VAP. Proto vzniklo CPIS (Clinical Pulmonary Infection Score): https://www.mdcalc.com/clinical-pulmonary-infection-score-cpis-ventilator-associated-pneumonia-vap
Terapie
1. Empirická ATB terapie – výběr ATB terapie závisí na riziku přítomnosti MDR patogenů:
- Při nepřítomnosti rizikových faktorů MDR lze viz výše. Hlavním rozdílem oproti CAP je výrazně nižší incidence atypických patogenů (výjimkou jsou legionely).
- V přítomnosti rizikových faktorů MDR je vhodná léčba třemi látkami (dvě proti PSAE, jedna proti MRSA). Např. piperacilin-tazobaktem/meropenem + gentamicin/ciprofloxacin + vankomycin/linezolid.
Pokud je léčba účinná, dochází ke klinickému zlepšení po 2 – 3 dnech ATB terapie.
2. Specifická terapie – při identifikaci agens je možné redukovat ATB na jednu až dvě látky. Při negativním výsledku kultivace (zejména pokud byl vzorek odebrán před zahájením ATB terapie) je nutné zvážit, zda dále pokračovat v empirické terapii ATB terapii proti VAP a pokračovat v hledání jiného ložiska infekce, které má jiné běžné spektrum původců a tak i jinou empirickou ATB terapii. Pokud CPIS klesne během prvních 3 dnů, je možné ATB zastavit po 8 dnech. Selhání terapie:
- u 40 % VAP vyvolaných MRSA léčba vankomycinem selhává, stále roste jeho MIC. O 15 % účinnější je linezolid (adjustovaný na dávce).
- u 50 % VAP vyvolaných PSAE bez ohledu na druhu ATB.
Včasná diagnostika selhání terapie je velice obtížná, pomůže opakovaná kalkulace CPIS (nejdůležitějším parametrem je zlepšení oxygenace).
Komplikace – hlavní komplikací je prodloužení UPV (běžně o týden), pobytu na JIP i v nemocnici. Nekrotizující infekce mohou vést ke vzniku bronchiektázií a jizvení s následnými recidivami pneumonií. Obecnou komplikací je ztráta aktivní svalové hmoty a významné prodloužení fáze rekonvalescence.
Prognóza – obecně, lze říci, že se mortalita VAP pohybuje okolo 25 %. Záleží na mnoha faktorech, např. komorbidity, celkový stav pacienta, dále původci onemocnění (např. MDR). Infekce Stenotrophomonas maltophilia je markerem velmi špatné prognózy, protože znamená, že pacientův imunitní systém je výrazně kompromitován.
Prevence – lze identifikovat několik možností prevence:
- Nejdůležitějším preventivním krokem je zkrácení UPV. Nelze ovšem spěchat s předčasným weaningem a extubací, protože reintubace sebou nese výrazné riziko dalších mikroaspirací.
- Zdá se, že výskyt časné VAP může snížit krátká kůra profylaktické ATB terapie, naopak její protahování vede k selekci MDR patogenů (VAP způsobená PSAE je u pacientů, kteří dosud neužívali ATB raritní).
- Prevencí mikroaspirace může být zvednutí horní poloviny těla do úhlu 30° – 45°.
- Vyvarování se látek, které zvyšují pH žaludku, které samo o sobě sterilizuje žaludeční obsah (risk to benefit – VAP x stresový vřed).
Plicní absces
Definice – nekróza a kavitace plicního parenchymu jako následek infekce. Lze jej rozdělit na akutní (< 4 – 6 týdnů trvání, 60 %) a chronický (delší doba trvání, 40 %).
Etiologie
- Primární absces (cca 80 %) nejčastěji aspirací v terénu zdravých plic, bývá vyvolán anaeroby.
- Sekundární absces vzniká v terénu již postiženým plic (nejčastěji za obstrukcí následkem cizího tělesa nebo tumoru) nebo celkové choroby organismu (imunosuprese, AIDS).
Epidemiologie – muži jsou postiženi častěji než ženy. Mezi rizikové faktory vzniku patří snížený stav vědomí, alkoholismus, užívání drog, křeče, mozkové a kardiální postižení, porucha bulbárních funkcí, neuromuskulární poruchy a poruchy jícnu (např. GERD).
Patofyziologie
Primární absces – anaerobní baktérie nebo mikrofilní streptokoky (původem z gingiválních krčků) jsou mikroaspirovány a následně se z nich vyvíjí pneumonitida (zhoršená tkáňovým poškozením při aspiraci žaludeční kyseliny). Po dalších 7 – 14 dnech dochází k rozvoji nekrózy a dutiny. Díky menšímu uhlu odstupu hlavního bronchu je výrazně častěji postižena pravá plíce.
Sekundární absces – mikrobiální spektrum je velmi široké, často G- tyčinky (včetně PSAE), navíc např. imunosuprimovaní pacienti bývají často osídleni různými mikroorganismy, které absces nevyvolaly. O to důležitější je kultivace cíleně odebraného materiálu. Patogeneze záleží na predisponujícím faktoru:
- při obstrukci dochází k infekci stagnujícího sekretu
- imunosuprese s predispozicí ke vzniku abscesu řadou oportunních patogenů
- septická embolizace vzniká při infekční endokarditidě (zejména trikuspidální chlopně, často S. aureus) nebo Lemierově syndromu, při kterém se infekce z nazofaryngu (nejčastěji Fusobacterium necrophorum) šíří na krk, vzniká infekční tromboflebitida jugulární žíly s rizikem septické embolizace.
Klinický obraz – zpočátku podobné pneumonii (horečky, kašel, expektorace, bolesti na hrudníku), při chronickém abscesu únava, noční poty a anémie chronických chorob. Někdy pacienti popisují putridně chutnající a zapáchající sputum. U aerobních původců bývá průběh fulminantnjší s horečkami a rychlou progresí. U velkého abscesu přítomno oslabené dýchání a ztemnělý poklep. Často si lze všimnout i vadné dentice.
Diagnostika – fyzikální vyšetření má nízkou senzitivitu i specificitu,
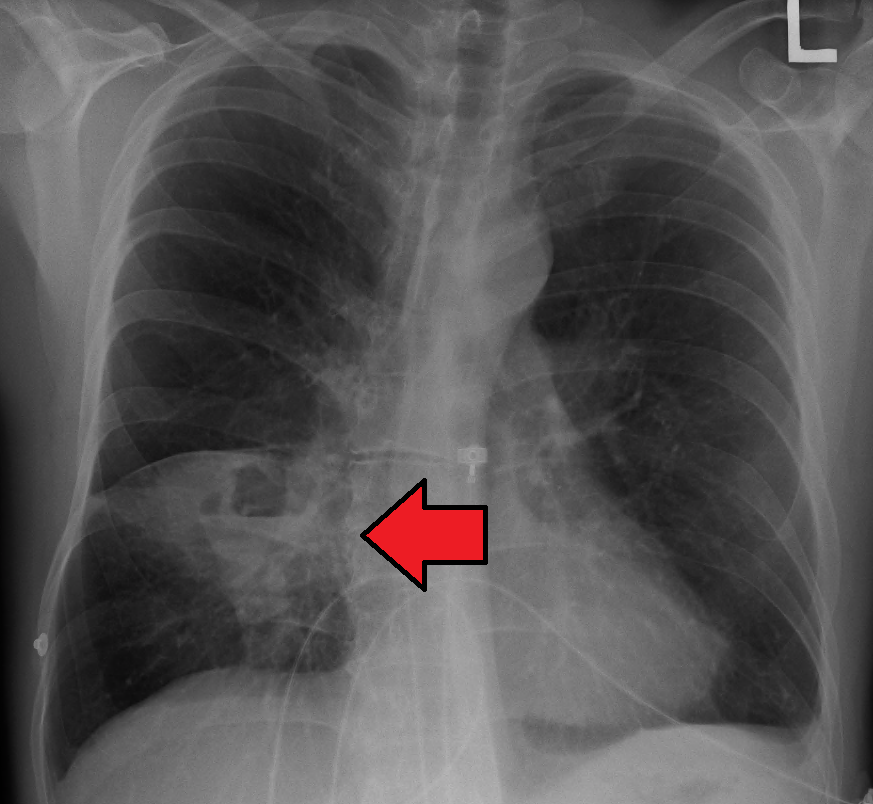
- Základem jsou zobrazovací metody. Na RTG S+P se zobrazuje silnostěnná dutina s hladinkou (obr. dole vlevo). CT hrudníku je metodou volby (obr. dole vpravo), jednak absces odhalí dříve, jednak napoví i ohledně vlastní příčiny abscesu (obstrukce, tumor).
- V odhalení vyvolávajícího agens je vhodný odběr sputa (barvení podle Grama a kultivace) a hemokultury. Invazivní možností je kultivace BAL, transbronchiální aspirace nebo CT navigovaná perkutánní jehlová aspirace.
CAVE U sekundárního abscesu nebo při selhání ATB terapie je nutné uvažovat o kultivačně náročnějších agens (mykózy, viry).

Terapie
1. ATB terapie
- Základem léčby primárního abscesu je klindamycin (600 mg i.v. 3 x denně → 300 mg p.o. 4 x denně) nebo amoxicilin-klavulanát. Terapie by měla trvat, dokud absces nezmizí nebo neregreduje do jizvičky (3 – 14 týdnů).
- U sekundárního abscesu je důležitá identifikace agens a cílená terapie.
2. Při velikosti abscesu > 6-8 cm je selhání samotné ATB terapie pravděpodobné. Je proto třeba zvážit současnou chirurgickou resekci nebo perkutánní drenáž u rizikových pacientů.
Komplikace – velká kavita se může transformovat do pneumatocele (perzistující cysta) nebo bronchiektázie. Mezi další komplikace patří recidiva abscesu, vznik empyému, hemoptýza nebo masivní aspirace obsahové abscesové dutiny.
Prognóza a prevence – mortalita primárního abscesu je cca 2 %, naopak u sekundárního abscesu je výrazně vyšší (v některých studiích až 75 %). Negativně prognostické faktory jsou věk > 60 let, velikost abscesu > 6 cm, trvání > 8 týdnů, jako původce aerobní bakterie, přítomnost sepse.
Prevencí je protekce dýchacích cest, dostatečná hygiena dutiny ústní, minimalizace sedace, a elevace hlavy jako prevence aspirace.