402. Struktura a metabolismus kostí
Kostní tkáň se po celý život remodeluje (současná tvorba kostní tkáně osteoblasty a její degradace osteoklasty). Plní ochrannou a podpůrnou funkci, navíc je rezervoárem kalcia, magnézia, fosforu, sodíku a ostatních iontů, dále v její dřeni probíhá krvetvorba. Kost spotřebuje 10 % srdečního výdeje. Složení kosti:
- Organická extracelulární hmota, která je z 90 – 95 % tvořena kolagenem typu I, zbytek je heterogenní. Bodová mutace genu pro α1 řetězec (COL1A1) nebo α2 řetězec (COL1A2) vede k osteogenesis imperfecta.
- Minerální hmota je tvořena špatně krystalizujícím hydroxyapatitem (sloučenina kalcia a fosfátů), který je uložen v otvorech mezi kolagenními fibrilami. Organizace kolagenu tak výrazně ovlivňuje mineralizaci kosti.
- Buňky:

Osteoblasty – polarizované buňky mezenchymálního původu, které se nachází v jedné vrstvě na povrchu novotvořené kosti (endostu nebo periostu). Vytváří jednu vrstvu organické matrix, která se následně mineralizuje a apozicí tak tvoří novou kost. Základní stavební jednotkou kosti je Haverský systém, který vzniká zahájením produkce matrix osteoblasty, které se jí postupně obalí a stávají se osteocyty, které jsou uloženy v lakunách a jsou spojeny sérií kanálků s krevním řečištěm uloženým v Haverském kanálku. Produkují FGF23 (fibroblast growth factor 23), který je zásadní ve fosfátovém metabolismu. Mineralizace matrix spongiózy i kompakty začíná brzy po produkci organické matrix (primární mineralizace) a probíhá po několik týdnů, někdy i déle (sekundární mineralizace). Zánik osteocytů je následován resorpcí matrix.
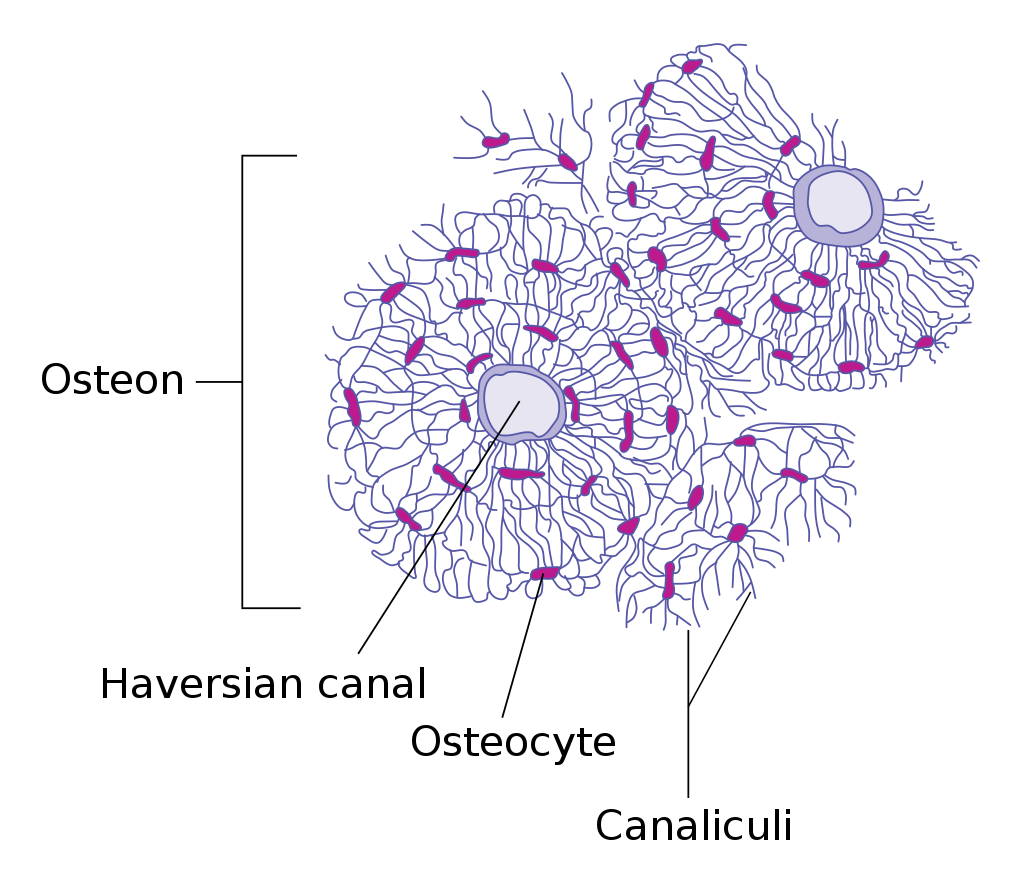
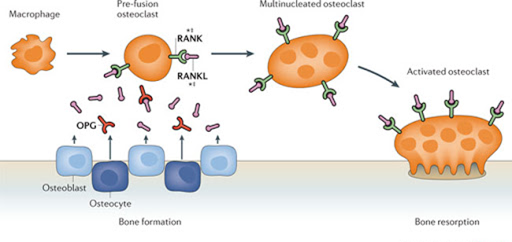
Osteoklasty – mnohojaderné buňky (vznikající fúzí prekurzorů makrofágů), které jsou zodpovědné na osteoresorpci, ke které dochází ve vroubkovaných otvorech (Howshipovy lakuny) na povrchu kosti, kam se osteoklasty připojují na komponenty kostní matrix (osteopontin) a secernují H+ (generovány karboanhydrázou typ II a extracelulárně vylučovány ATPázou) a Cl– spolu s proteinázami (někdy nazýván „extracelulární lyzozomy“) s následným rozpouštěním minerální komponenty. Jejich produkce je ovlivněna různými faktory:
- M-CSF (macrophage colony-stimulating factor) umožňují fúzi progenitorových buněk do osteoklastů
- RANK (člen rodiny TNF) je exprimován na povrchu progenitorů osteoblastů a fibroblastů stromatu. Ligand RANK se váže na progenitorech osteoklastů a stimuluje jejich proliferaci a aktivaci.
- osteoprotegerin („návnada“) váže RANKL a diferenciaci osteoklastů inhibuje
- PTH, 1,25(OH)2D nepřímo zvyšují aktivitu i počet osteoklastů
- kalcitonin přímo inhibuje osteoklasty
- estradiol snižuje kostní resorpci
Osifikace
Osifikace může být intramembranózní, kdy dochází ke vzniku kosti bez přítomnosti chrupavky (kosti lebky, klíční kost, ploché kosti) nebo převážně enchondrální, kdy kost vzniká remodelací a osifikací chrupavky. Během tohoto procesu chondrocyty proliferují, mineralizují matrix, hypertrofují a následně umírají. Tento proces je regulován jednak lokálními faktory (IGF-1 a -II, lhh, PTHrP, FGF23), jednak hormony (GH, glukokortikoidy, estrogeny).
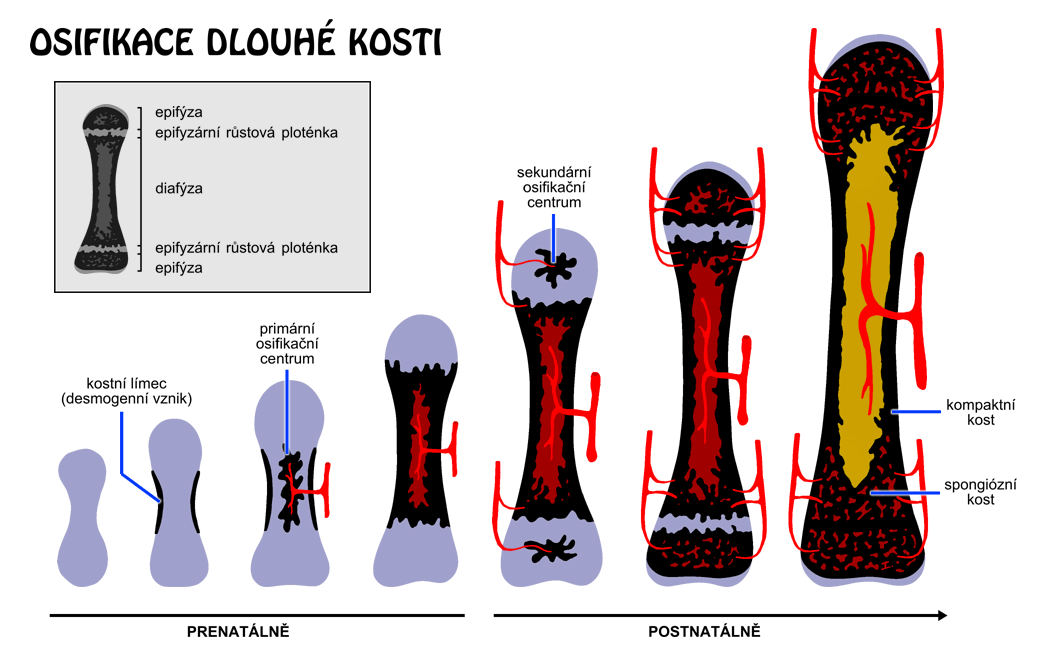

Nová kost je celulární a jsou pro ni typické hrubé a náhodně uspořádané svazky kolagenu („plsťovitá kost“ – „woven bone“). Zralá kost je uspořádána lamelárně okolo centrálních cév (Haverský systém). Růst dlouhých kostí do délky je závislý na proliferaci chondrocytů růstových plotének, do šířky kostní novotvorbou v oblasti periostu a resorpcí endostálně. U dospělých (po uzávěru růstových chrupavek) již kost do délky neroste, její remodelace pokračuje po celý život. K remodelaci dochází i podél místa působení mechanického stresu, který je vnímán osteocyty, které předávají signál osteoblastům. Ke stanovení míry remodelace a převahy jedné z jejich složek je vhodné stanovení produktů:
- osteoblastů, např. osteokalcin, kostní izoforma ALP, N-terminální fragment prokolagenu III a
- osteoklastů, např. hydroxyprolin, pyridinolin a deoxypyridinolin v moči, kostní izoforma kyselé fosfatázy a C terminální fragment kolagenu III, protože molekuly kolagenu III jsou spojeny s extracelulární matrix pomocí hydroxypyridinilových vazeb a po resorpci osteoklasty lze tyto peptidové řetězce zachytit v moči a plazmě.
404. Osteoporóza
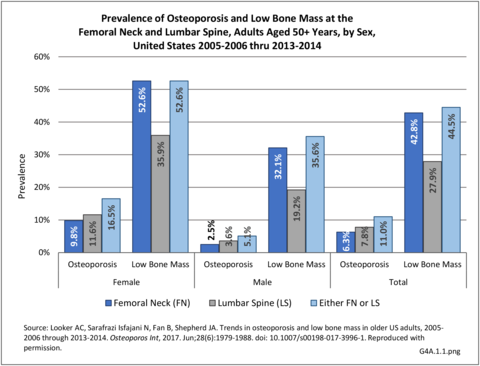
Definice – redukce kostní hmoty, která zvyšuje riziko zlomenin. Dle WHO je osteoporóza definována jako kostní denzita > -2,5 SD pod průměr pro dané pohlaví (T-skóre), osteopenie jako T skóre -1,0 až -2,5.
Epidemiologie – prevalence osteoporózy u 20 % žen a 5 % mužů ve věku 50–70 let, nad 70 let u 75 % žen a 20 % mužů (ženy postiženy cca 4x častěji než muži) a tedy stoupá s věkem.
Patofyziologie
1. Remodelace kostí – během dospívání roste nová kost do délky a zároveň dochází k apozici na vnější povrch a k adaptaci vláken na vnější stresové stimuly. Největší hustotu má kost v časné dospělosti (tato hustota závisí z 50 – 80 % na genetických faktorech, zbytek jsou faktory prostředí). V dospělosti pak probíhá remodelace kosti, která má dva hlavní úkoly – opravy mikrotraumat s další adaptací vůči stresu a udržení hladiny kalcia v krvi. Tato remodelace je regulována různými hormony (PTH, vitamín D, estrogeny, androgeny, interleukiny a další), které ve svém důsledku rozhodnou, zda převáží osteoresorpce nebo osteoprodukce. Hlavním cytokinem odpovědným za aktivaci osteoklastů je RANK (receptor activator of nucelar factor-κB ligand), který je secernován osteoblasty a váže se na RANKL (RANK ligand), naopak, „návnada“ na RANK je osteoprotegerin, jehož exprese je zvyšována estrogeny, a který vychytává RANK, ovšem bez aktivace osteoklastů.
Během časné dospělosti je úroveň osteoprodukce a osteoresorpce vyvážená, ale ve věku nad 30 let začíná pomalu převažovat osteoresorpce (toto je individuálně odlišné) a výrazně se urychlí po menopauze. Pokud jsou u trabekulární kosti zničeny trabekuly, neexistuje dále „šablona“ pro novotvorbu kosti a následná likvidace kosti je velmi výrazná, u kortikální kosti dochází k jejímu difuznímu „prořídnutí“ a ztenčení kortikalis. Dochází tak k biomechanické degeneraci kosti.
2. Fyzická aktivita – čím vyšší aktivita, tím vyšší kostní hmota (nízká u kvadruplegiků, vysoká u atletů), nejvíce je výsledná kostní hmota ovlivněna, pokud k tomuto stimulu (pozitivními i negativnímu) dojde během růstu, méně již během dospělosti.
3. Kouření – toxický efekt na osteoblasty a nepřímo modulace metabolismu estrogenů.
4. Kalcium – při nedostatku kalcia a jiných faktorů potřebných k růstu (kalorie, proteiny a minerály) může být vrcholová kostní denzita nižší, což zvýší riziko rozvoje osteoporózy v pozdějším věku. Při nižším příjmu kalcia dochází ke zvýšení hladiny PTH, který zvyšuje hydroxylaci a vznik 1,25(OH)2D v ledvinách a tak i resorpci kalcia ze střeva i reabsorpci z distálního tubulu. Tento kompenzační mechanismus je ale dlouhodobě nevýhodný, protože zrychluje ztrátu kostní hmoty. Denní příjem < 0,4 g/den je pro skelet nepříznivý, optimální je 1 – 1,2 g/den.
5. Vitamín D – deficit vitamínu D je přítomen zejména u starších osob, lidí ze severských oblastí a s malnutricí a vede ke sekundárnímu hyperparathyreoidismu se všemi důsledky. Deficit je variabilní během roku (nejvíce v zimě). Optimální příjmem je 800 – 1000 IU/den. Ukazuje se jako pravděpodobné, že deficit vitamínu D je rizikových faktorem vzniku tumorů (kolorekta, prostaty, prsu), autoimunitních poruch a diabetu.
6. Estrogeny – deficit estrogenů (zejména v období menopauzy) zvýrazňuje nerovnováhu ve prospěch osteoresorpce (zvýšení produkce RANKL a snížení osteoprotegerinu). Buňky kostní dřeně (makrofágy, prekurzory osteoklastů, mastocyty) i kostí (osteoblasty, cyty i klasty) obsahují estrogenové receptory. Závažnost ztráty kostní hmoty po menopauze je individuální a nejde předpovědět. Remodelace je vázaná zejména na kostní povrch, tedy i trámce trabekulární kosti a díky tomu, že je tento povrch u trabekulární kosti vyšší, je častěji právě tato kost u postmenopauzální osteoporózy postižena (časté fraktury obratlů).
7. Chronické choroby – riziko osteoporózy zvyšují četné choroby (viz tabulka):
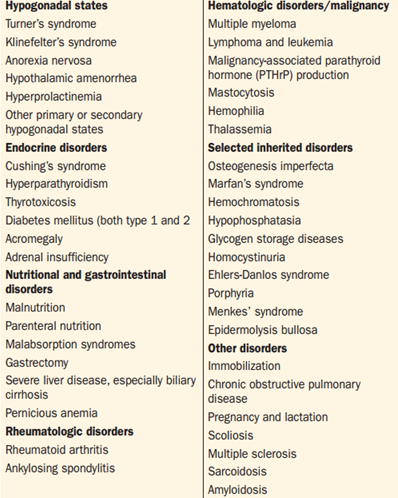
8. Léky – riziko osteoporózy zvyšuje zejména léčba glukokortikoidy, antikonvulziva (indukce metabolismu vitamínu D), imunosupresiva (cyklosporin, takrolimus), inhibitory aromatázy u karcinomu prsu, SSRI, PPI, pioglitazon.
Diagnostika
1. Anamnéza a fyzikální vyšetření – nutné pečlivé posouzení rizikových faktorů (obecně věk, předchozí zlomeniny, rodinná anamnéza zlomeniny pánve, nízká tělesná hmotnost, kuřáctví, alkoholismus, glukokortikoidy, revmatoidní artritida).
Kdy stanovit BMD…
- obecně lidé > 50 let s anamnézou fraktury
- ženy po menopauze a > 65 let
- muži > 70 let
- lidé s výraznými rizikovými faktory (revmatoidní artritida, dlouhodobě glukokortikoidy)
Kdy provést RTG páteře
- ženy 50 – 64 let a muži 50 – 69 let s následující stavy (nízkoenergetické trauma, pokles výšky > 4 cm, dlouhodobá léčba kortikoidy)
- ženy 65 – 70 let a muži 75 – 80 let s T-skóre < -1,5
- ženy > 70 let, muži > 80 let s T-skóre < -1,0
2. DXA (Dual-energy X-ray absorptiometry) – zlatým standardem stanovení kostní denzity (BMD). Dva rentgenové paprsky určité energie prochází tkání, měří se jejich energie po průchodu, algoritmem se stanoví BMD. Jelikož paprsky prochází předozadně, neumí přístroj odhadnout, zda k oslabení dochází díky měkkým tkáním nebo kosti, díky tomu i přes korekci mají štíhlí lidé falešně nižší BMD, naopak osteofyty BMD falešně zvyšují.

Výsledek se stanoví v T-skóre (směrodatná odchylka oproti zdravé populaci pro dané pohlaví). Větší výpovědní hodnotu může mít Z-skóre, které se stanovuje (také v SD) s ohledem nejen na pohlaví, ale i na věk a rasu (např. 60 letá žena může mít Z-skóre ještě -1, ale T-skóre už – 2,5, protože v této skupině je nižší kostní denzita běžná). Screeningově lze použít i ultrazvuk, výzkumně CT a MRI.

3. Laboratorní testy – doporučený je celkově krevní obraz, kalcémie, 24h kalciurie, jaterní a renální testy, 25(OH), PTH, TSH (hypertyreoidismus). Dále:
- dexametazonový test a kortizol v moči při podezření na Cushingův syndrom
- železo, folát, vitamín B12, albumin, cholesterol a KO+diff při podezření na malabsorpci a malnutrici
- protilátky proti gliadinu a endomyziu event GFS při podezření na celiakii
- elektroforéza bílkovin séra a moči při podezření na myelom (často nalezen MGUS, který progreduje do myelomu v 1 % ročně)
4. Biochemické markery kostního metabolismu – většinou substance vznikající při kostní resorpci nebo produkci. Hlavní úlohou je monitorace odpovědi na léčbu (odebrat před zahájením léčby a po 3 – 6 měsících:
- markery osteoprodukce – osteokalcin, kostní izoenzym ALP, P1NP (N-terminální propeptid prokolagenu I).
- markery osteoresorpce – hydroxyprolin, pyridinolin a deoxypyridinolin v moči, kostní izoforma kyselé fosfatázy, CTX (C terminální fragment kolagenu III).
Terapie
1. Redukce rizikových faktorů – před zahájením léčby je vhodné stanovit riziko vzniku fraktury (např. FRAX kalkulátor, dostupný na https://www.sheffield.ac.uk/FRAX/tool.aspx?country=9) s následným snížením rizikových faktorů (redukce medikace ovlivňující BMD, při substituci hormony štítné žlázy kontrola TSH, omezení kouření i pití alkoholu, zahájení fyzické aktivity). Dále je nutné upravit režim i okolí k zamezení pádu (schody, koberce, omezení hypnotik apod.).
2. Fyzické cvičení – u mladých jedinců je důležité k dosažení maximální geneticky dané BMD, u postmenopauzálních žen zpomaluje ztrátu kostní hmoty, ale již nevede k jejímu nárůstu. Vhodná je jakákoliv aktivita, plavání a vodní aktivity mají menší efekt (voda nadnáší…).
3. Dietní doporučení
Kalcium – optimální denní dávka je 1 – 1,2 g/den. Jednotlivá dávka by neměla být podávána větší než 600 mg protože poté již klesá opravdu resorbovaná frakce. Vysoké dávky kalcia byly spojeny s vyšším rizikem srdečních chorob.
CAVE Při anamnéze nefro- nebo urolitiázy by před zahájením substituce měla být stanovena kalciurie.
Vitamín D – cílem je hladina 25(OH)D > 30 ng/ml. U pacientů s velmi nízkou hladinou je možné jednorázové podání 50 – 100 kIU následováno pravidelnou suplementací. Ta by měla být dle pravidelnosti expozice slunečním paprskům od 800 IU denně u člověka bývajícího často venku, po 2000 IU a vyšší u jedince bez expozice. Vždy je vhodná současná suplementace vápníkem, zejména při současné léčbě denosumabem a bisfosfonáty (VIGANTOL 1 kapka = 500 IU).
Ke karboxylaci osteokalcinu je nutný vitamín K (dlouhodobá terapie warfarinem byla spojena s redukcí BMD). Dále je nutná dostatečná energetická i proteinová suplementace.
4. Farmakoterapie
Estrogeny – snižují kostí obrat, snižují produkci RANKL a zvyšují osteoprotegerin. Jednoznačně snižují riziko zlomeniny, ale o 40 % zvyšují riziko CMP, o 100 % hluboké žilní trombózy a o 26 % riziko karcinomu prsu, nejsou proto k léčbě osteoporózy schváleny.
Raloxifen – patří k modulátorům estrogenových receptorů (SERM). Váže se na receptory Erα a Erβ, které se nachází na osteoblastech i osteoklastech. Indikován u posmenopauzálních žen s T < -2,5 jako lék druhé volby při nesnášenlivosti bisfosfonátů. Vzhledem ke snížení rizika karcinomu prsu je indikován spíše u mladších pacientů, naopak zvyšuje riziko hluboké žilní trombózy i iktu a obecně není doporučen u žen > 70 let věku s anamnézou trombembolie.
Bisfosfonáty – syntetická analoga endogenních pyrofosfátů, ale vazba P-C-P zajišťuje, že na rozdíl od pyrofosfátů nepodléhá štěpení a není metabolizován. Ve skeletu se se retinuje cca 50 – 60 % (inkorporuje se do něj a inhibuje zde i mevalonátovou cestu, což vede k dezintegraci cytoskeletu a apoptóze osteoklastů), zbytek je vyloučen ledvinami, nejsou proto vhodné při GF < 0,5 ml/s. Aplikace per os je spojena s rizikem iritace horního GIT (korozivní ezofagitida, vředová choroba, CAVE u NSAID).
CAVE Při zlomenině je nutné bisfosfonáty na 3 měsíce vysadit, protože prodlužují tvorbu kostního svalku a zvyšují výskyt pakloubů!
- alendronát – 70 mg p.o. 1x týdně
- risendronát – 35 mg p.o. 1x týdně
- ibandronát – 150 mg p.o. 1x měsíčně, 3 mg i.v. 1x za 3 měsíce BONVIVA
- zolendronát – 5 mg i.v. 1x ročně (ACLASTA)
Nežádoucí účinky:
- osteonekróza čelisti většinou vzniká po zubních operacích, při kterých je obnažena kost, obvykle u onkologicky nemocných pacientů, u kterých jsou užívány vysoké dávky bisfosfonátů.
- atypická fraktura femuru vzniká obvykle v místě diafýzy a její příčinou je pravděpodobně bisfosfonáty indukovaná suprese intrakortikální remodelace, která za normálních okolností vede k reparaci mikrotraumat. Je nutné přerušení antiresorpční léčby, naopak pomoci může teriparatid.
Stroncium ranelát – má středně významný antiresorpční účinek, je místo kalcia ukládán do hydroxyapatitu. Je kontraindikován u pacientů s anamnézou trombembolie, ICHS, nemoci periferních a mozkových tepen a neléčené hypertenze.
Denosumab – monoklonální protilátka IgG2 proti RANKL, který inhibuje zrání osteoklastů z prekurzorů a jejich adhezi na povrch kosti. I zde byly pozorovány atypické fraktury femuru. Efekt denosumabu je vysoce reverzibilní s pokračováním osteoresorpce po přerušení léčby. Podává se jednou za půl roku.
Teriparatid – chronická expozice PTH vede k osteoresorpci, naopak při jeho krátkodobé intermitentní aplikaci dochází k osteoanabolickému efektu (zvýšený „nábor“ osteoblastů a inhibice jejich apoptózy). Teriparatid je polypeptid 1-34hPTH, tedy fragment odpovědný za biologickou funkci PTH. Obrazem efektu je výrazné zvýšení P1NP po zahájení léčby. Je doporučeno jej podávat maximálně 2 roky a tuto léčbu již neopakovat.
Monitorace terapie – za signifikantní rozdíl se považuje změna BMD přesahující 4 % u obratlů a 6 % u pánve. Proto my měla být DXA prováděna nejdříve po 2 letech. U markerů kostního metabolismu se za signifikantní považuje změna 30 – 40 %.
Glukokortikoidy indukovaná osteoporóza
Ztráta kosti je nejvýznamnější ihned po zahájení léčby (trabekulární kost je postižena výrazněji než kortikální). Mechanismem nepříznivého efektu na kostní tkáň je inhibice osteoblastů, stimulace osteoklastů, inhibice absorpce kalcia a naopak indukce kalciurie a snížení produkce adrenálních androgenu i pohlavních hormonu varlaty a vaječníky.
CAVE U každého pacienta s terapií glukokortikoidy > 3 měsíce by měla být provedena DXA.
U každého pacienta by měla být snaha o topické podávání, redukci rizikových faktorů (viz výše) a dostatečnou suplementaci vitamínem D a kalciem. U pacientů s již vzniklou osteoporózou jsou vhodné bisfosfonáty a teriparatid.
405. Pagetova choroba
Epidemiologie a etiologie – autoptická prevalence je 3 % u pacientů > 40 let a stoupá s věkem. Z nejasných důvodů klesá prevalence a závažnost a stoupá věk manifestace. Etiologie je nejasná:
- Jistá je genetická složka (pozitivní rodinná anamnéza u příbuzného I. stupně zvyšuje pravděpodobnost vzniku 7 – 10x). Identifikovány i kandidátní geny (např. kódující RANK).
- V buňkách nemocných častěji identifikován genom paramyxovirů (spalničky, RS virus).
Patofyziologie – pagetické osteoklasty jsou velké buňky s mnoha jádry, které mají cca 9x vyšší osteoresorpční potenciál, protože jsou hypersenzitivní k induktorům osteoresorpce (1,25(OH)2D, RANKL i IL-6 a mají overexpresi antiapoptotického onkogenu bcl-2). Pagetova choroba se tak dělí na tři fáze:
- fáze – osteoresorpce s hyperaktivitou osteoklastů
- fáze – osteoprodukce se sekundární hyperaktivitou osteoblastů, kdy je resorbovaná normální kost nahrazená méněcennou dezorganizovanou „plstěnou kostí„.
- fáze osteosklerózy (fáze vyhoření), kdy klesá osteoresorpce a vzniklá kost je málo vaskularizovaná tvrdá, pagetická kost.
Diagnóza je většinou stanovena při pátrání po zvýšených hodnotách ALP nebo při provedení RTG vyšetření z jiné indikace.
CAVE U jednoho pacienta se mohou nacházet v různých lokalitách různé fáze.
Klinický obraz + diagnostika – nejčastějším místem postižení jsou lebka, páteř, pánev, femur a tibie.
1. Klinický obraz
- Bolest (při zvýšené vaskularizaci, expandujících lytických lézích, zlomeninách, ohybu kostí nebo dalších deformitách a při sekundární osteoartróze). Bolest v oblasti zad může vznikat díky postižení obratlů, stenóze foramin s neurologickými příznaky, spodylartróze apod., v oblasti lebky vzniká při vysokému obratu v lebečních kostech, dále může docházet k prominenci parietálních nebo frontálních kostí a stenóze foramin lebky s neurologickými příznaky. Postižení obličejových kostí může vést k deformitám.
- Zlomeniny nejčastěji v oblasti diafýzy femuru. Tumory (zejména osteosarkomy) jsou raritní.
- Na končetinách mohou být horké zatvrdliny označující místa kostních lézí.
CAVE U pacientů s aktivní formou onemocnění a více místy postižení může docházet k syndromu vysokého srdečního výdeje až k srdečnímu selhání (nejčastěji u predisponovaného pacienta).


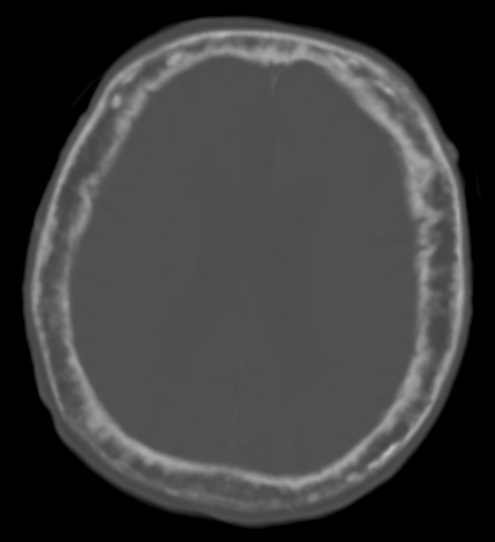
2. RTG nález – zvětšení celé kosti, ztluštění kortikální kosti, její celkové zhrubění a přítomnost typických lytických nebo sklerotických lézí.

3. 99mTc scintigrafie kostí

4. Biochemické vyšetření – zvýšení markerů osteoprodukce i osteoresopce, zejména ALP. Z nejasných důvodů nebývá zvýšení osteokalcin. Kalcémie i fosfatémie bývají normální.
CAVE Výjimkou může být hypokalcémie vzniklá při zahájení léčby bisfosfonáty, kdy je potlačena osteoresorpce, ale osteoprodukce pokračuje. Před zahájením léčby bisfosfonáty proto musí probíhat suplementace kalciem a vitamínem D.
Terapie – farmakoterapie je indikována ke kontrole příznaků u vysoce aktivní choroby (bolest, zlomeniny, neurologické komplikace apod.). Cílem léčby je snížení osteoresorpce a sekundárně i osteoprodukce. Vhodné jsou bisfosfonáty (u vysoce aktivní choroby je lékem volby zolendronát), které jsou kontraindikovány u onemocnění ledvin (CKD < 0,5 ml/s). Vždy je potřeba dostatečná substituce kalcia i vitamínu D, k léčbě je schválen i kalcitonin.
Osteopetróza
Etiologie a patogeneze – základním defektem je postižení osteoklasty zprostředkované osteoresorpce. Popsáno nejméně 9 mutací
- mutace chloridového kanálu (CLCN7, 75 % AD a 10 – 15 % AR osteopetrózy)
- mutace ostatních genů jsou vzácnější, např. nadprodukce osteoprotegerinu (vychytává RANKL, který tak nemůže aktivovat osteoklasty), mutace karboanhydrázy II (osteoklasty ji potřebují k produkci protonů) apod.
Klasifikace – z genetického hlediska existuje 9 typů osteopetrózy. Obecně lze rozdělit dle průběhu na:
- AR těžká forma s prevalencí 1 : 200 – 500 tisíc se selháním remodelace a zúžením kostních foramin pro hlavové nervy i kostní dřeně s rozvojem extrameduálrní hematopoézy. Při absenci osteoresorpce vzniká hypokalcémie. Neléčena vede ke smrti ve věku do 5 let.
- AD lehká forma s prevalencí 1 : 100 – 500 tisíc bývá obvykle objevena na základě typických RTG změn. Často nevyžaduje léčbu.
Diagnostika
- RTG – symetrické zvýšení kostní hmoty se ztluštěním kortikální i trabekulární kosti, střídají se sklerotické a jasné oblasti. Paranazální a mastoidní dutiny jsou často hypopneumatické.
- Laboratorní nálezy – zvýšení sérové TRAP (tartarát-rezistentní kyselé fosfatázy, izoforma 5b je specifická pro osteoklasty). U těžkých forem může být hypokalcémie.

Terapie – příznivé výsledky má transplantace kostní dřeně u HLA identických jedinců, u neidentických jsou výsledky horší. Cílem této léčby je dát vznik normálním progenitorovým buňkám, od kterých jsou odvozeny osteoklasty. Při neurologických obtížích vyplývajících z komprese nervů je indikována chirurgická intervence.